Infekcija virusom humane imunodeficijencije (engl. human immunodeficiency virus = HIV) nastaje kao posljedica infekcije jednim od dva srodna retrovirusa (HIV–1 i HIV–2) koji napadaju CD4+ limfocite i uzrokuju oštećenje stanične imunosti povećavajući tako rizik pojave nekih infektivnih bolesti i tumora. Inicijalna infekcija može se očitovati kao nespecifična febrilna bolest. Rizik daljnjih komplikacija, koje ovise o stupnju imunodeficijencije, proporcionalan je smanjenju broja CD4+ limfocita u perifernoj krvi. HIV može izravno oštetiti mozak, spolne žlijezde, bubrege i srce, uzrokujući kognitivno oštećenje, hipogonadizam, insuficijenciju bubrega, i kardiomiopatiju. Klinička slika varira u rasponu od asimptomatske infekcije do sindroma stečene imunodeficijencije (AIDS), koji je definiran ozbiljnim oportunističkim infekcijama ili malignim bolestima uz broj CD4+ limfocita <200/μL. HIV infekcija se može dijagnosticirati detekcijom protutijela, nukleinske kiseline (HIV RNK) ili antigena (p24). Testiranje bi trebalo ponuditi svim odraslim ljudima, kao i adolescentima. Cilj liječenja jest suzbijanje replikacije HIV virusa pomoću kombinacije ≥ 3 lijeka koji inhibiraju enzime virusa; ukoliko se suprimira replikacija virusa, liječenje omogućuje oporavak imunološkog sustava kod većine pacijenata.
(Vidi također HIV infekcija u dojenčadi i djece.)
Glavno obilježje retrovirusa je njihova sposobnost umnažanja (replikacije) mehanizmom reverzne transkripcije kojim nastaje kopija DNK koja se ugrađuje u genom stanice domaćina. Nekoliko retrovirusa, uključujući dvije vrste HIV-a i dvije vrste humanog T-limfotropnog virus (HTLV-[XRef]), u ljudi uzrokuju ozbiljne poremećaje.
Infekcije virusom HTLV
|
Infekcije humanim T-limfotropnim virusom (HTLV) 1 ili 2, mogu uzrokovati T-stanične leukemije i limfome, limfadenopatiju, hepatosplenomegaliju, kožne bolesti, kao i imunodeficijenciju. Neki pacijenti zaraženi HTLV-om razvija infekcije slične onima koje se javljaju u pacijenata zaraženih HIV-om. HTLV-1 također može uzrokovati mijelopatiju.
u većini slučajeva se prenosi
no, HTLV-1 se može prenijeti
|
HIV-1 uzrokuje većinu infekcija virusom HIV-a u svijetu, no HIV-2 izaziva značajan dio infekcija u nekim dijelovima zapadne Afrike. U nekim područjima zapadne Afrike prisutna su oba virusa, a moguća je i dvojne infekcija ovim virusima. HIV-2 čini se manje virulentnim od HIV-1.
HIV–1 pojavio se u središnjoj Africi u prvoj polovici 20. stoljeća kad je srodan virus u čimpanza prvi put zarazio čovjeka. Globalna epidemija HIV infekcije započela je koncem 1970–ih godina, dok je AIDS prvi puta zabilježen 1981. godine.
Svjetska zdravstvena organizacija (WHO) procjenjuje (1) da je 2019. oko 38 milijuna ljudi, uključujući 1,8 milijuna djece (< 15 godina), živjelo s HIV-om diljem svijeta; od ukupnog broja, oko 25,7 milijuna živi u subsaharskoj Africi. Oko 85% ljudi s SMD-om imaju samo suhu formu SMD. Među ljudima koji su znali da su zaraženi, 67% je pristupilo liječenju. U 2019. oko 690 000 ljudi umrlo je od bolesti povezanih s AIDS-om diljem svijeta (64% u podsaharskoj Africi), u usporedbi s 1,9 milijuna 2004. i 1,4 milijuna 2010. U 2019. oko 1,7 milijuna ljudi, uključujući 150 000 djece, bilo je novozaraženo HIV-om, u usporedbi s 3,4 milijuna novih infekcija 1996. godine. Većina novootkrivenih infekcija (95%) bilježi se u zemljama u razvoju; više od jedne polovine čine žene. U mnogim zemljama subsaharske Afrike, incidencija HIV infekcije značajno opada u odnosu na vrlo visoke stope od desetljeća prije; usprkos tome, ostaju važne praznine u ispunjavanju zahtjeva Svjetske zdravstvene organizacije Fast-Track strategy to end the AIDS epidemic by 2030.
Procijenjeno je da je 2015. godine u SAD-u 1,2 milijuna ljudi u dobi ≥ 13 godina živjelo s HIV-om; u 15% HIV infekcija još nije otkrivena. U 2018. bilo je 22% manje slučajeva u odnosu na 2008. i 7% manje u odnosu na 2014. U 2016. godini otkriveno je 39,782 novih infekcija HIV-om. Više od dvije trećine (67% ili 26,570) novih infekcija pojavljuje se u muškaraca koji imaju odnose s drugim muškarcima. Među muškarcima koji imaju odnose s drugim muškarcima, broj novih infekcija iznosio je 10,223 u muškaraca crne rase tj. Afroamerikanaca, 7,425 u Latinoamerikanaca i 7,390 u muškaraca bijele rase (2).
AIDS
AIDS je definiran jednim ili više od sljedećeg:
-
Infekcija HIV-om koja uzrokuje bilo koju od određenih bolesti ([XRef] [3])
-
Broj CD4 + T-limfocita (pomoćničke stanice) < 200/μL
-
Postotak CD4+ stanica ≤ 14%
AIDS-definirajuće bolesti su
-
Teške oportunističke infekcije
-
Određeni tumori (npr. Kaposi sarkom, non-Hodgkin limfom) koje predisponira nedostatna stanično posredovana imunost
-
neurološfki poremećaj
AIDS-definirajuće bolesti
-
Bakterijske infekcije, višestruke ili rekurirajuće
-
Kandidoza bronha, dušnika ili pluća
-
Kandidoza jednjaka
-
Rak vrata maternice, invazivni
-
Kokcidioidomikoza, diseminirana ili ekstrapulmonalna
-
Kriptokokoza, ekstrapulmonalna
-
Kriptosporidioza, kronična crijevna (traje > 1 mj.)
-
Citomegalovirusna bolest (osim jetre, slezene ili limfnih čvorova), početak u dobi starijoj od 1 mj.
-
Citomegalovirusni retinitis (uz gubitak vida)
-
Encefalopatija uzrokovana HIV-om
-
Herpes simpleks: kronični ulkusi (u trajanju duljem od 1 mj.) ili bronhitis, pneumonitis ili ezofagitis (početak u starijoj dobi od 1 mj.)
-
Histoplazmoza, diseminirana ili ekstrapulmonalna
-
Izosporijaza (cistoizosporijaza), kronična intestinalna (trajanje > 1 mjesec)
-
Kaposijev sarkom
-
Burkittov limfom
-
Imunoblastični limfom
-
Primarni limfom mozga
-
Mycobacterium avium kompleks (MAC) ili Mycobacterium kansasii, diseminirano ili izvanplućno
-
Mycobacterium tuberculosis, bilo koje lokacije, diseminirana ili ekstrapulmonalna infekcija
-
Mycobacterium, druge vrste ili neidentificirane vrste, diseminirana ili ekstrapulmonalna
-
Pneumocystis jirovecii (ranije poznat kao Pneumocystis carinii) upala pluća
-
Pneumonija, rekurirajuća
-
Progresivna multifokalna leukoencefalopatija
-
Salmonella septikemija (netifusna), rekurirajuća
-
Toksoplazmoza mozga, početak u dobi > 1 mjeseca
-
Sindrom propadanja uzrokovan HIV-om
|
|
Vidi također Revised Surveillance Case Definition for HIV Infection.
|
AIDS-definirajuće bolesti
Ovaj koronarni prikaz prsnog koša CT-om pokazuje više mikronodularnih zamućenja u oba plućna parenhima kod pacijenta u južnoj Kaliforniji, poznatoj endemskoj regiji u kojoj Coccidioides immitis, zemljišna gljivica koja uzrokuje kokcidioidomikozu, često se nalazi. Lezije nalikuju milijarnoj tuberkulozi. U endemskim područjima, diseminirana kokcidioidomikoza stvara slične lezije.
Slika ustupljena ljubaznošću Edward J. Cachay.
Literatura
-
1. UNAIDS.org: Fact Sheet: Latest Statistics on the Status of the AIDS epidemic.
-
2. Centers for Disease Control and Prevention (CDC)Centers for Disease Control and Prevention (CDC): HIV in the United States: At a Glance.
-
3. Selik RM, Mokotoff ED, Branson, B, et al: Revised Surveillance Case Definition for HIV Infection—United States, 2014. MMWR63 (RR03): 1-10, 2014.
Prijenos
Prijenos HIV-a
Za prijenos virusa HIV–a neophodan je dodir s tjelesnim tekućinama—poglavito krvlju, sjemenom tekućinom, vaginalnim sekretom, majčinim mlijekom, slinom ili eksudatom iz kožnih promjena, rana i promjena na sluznicama—u kojima se nalaze slobodne čestice virusa ili inficirane stanice. Mogućnost prijenosa virusa veća je što je veća koncentracija virusa u krvi, što je slučaj tijekom primarne infekcije, čak i kad je asimptomatska. Mogućnost prijenosa slinom i kapljicama koje nastaju tijekom kašljanja ili kihanja zapravo je samo teoretska i izuzetno malena.
HIV se ne prenosi uobičajenim socijalnim kontaktom, kao niti bliskim (nespolnim) kontaktom na poslu, u školi ili kod kuće.
Prijenos je obično
-
Spolni put: izravni prijenos genitalnih, rektalnih ili oralnih sekreta tijekom spolnog odnosa
-
Iglom ili kirurškim instrumentima: dijeljenje onečišćenih igala ili kontakt s onečišćenim instrumentima
-
Preko majke: tijekom porođaja ili dojenjem
-
Transfuzijom krvnih preparata ili transplantacijom
Prijenos HIV-a spolnim putem
Izgleda da spolne aktivnosti poput felacija ili kunilingusa predstavljaju nizak rizik za prijenos infekcije, iako nisu posve sigurni (vidi tablicu Rizik prijenosa HIV-a za razne spolne aktivnosti). Gutanje sjemene tekućine ili vaginalnog sekreta ne povećavaju značajno rizik. Međutim, ranice u usnoj šupljini mogu povećati rizik prijenosa.
Oblici spolnog ponašanja s najvećim rizikom prijenosa su oni koji uzrokuju ozljede genitalne sluznice. Receptivni analni odnos predstavlja najveći rizik. Upala sluznice olakšava prijenos HIV-a; spolno prenosive bolesti, kao što su gonoreja, klamidijske infekcije, trihomonoza, a osobito one koje uzrokuju ulceracije (npr. čankroid, herpes, sifilis), povećavaju rizik višestruko. Drugi oblici spolnog odnosa koji uzrokuju traumu sluznice uključuju 'fisting' (umetanje dijela ili cijele šake u rektum ili vaginu) i korištenje seksualnih igračaka. Kada se koriste tijekom odnosa s HIV-pozitivnim partnerom i / ili s više partnera, ova ponašanja povećavaju rizik od prijenosa HIV-a.
U heteroseksualnih osoba procjenjeni rizik prijenoapo spolnom odnou iznosi oko 1/1000; međutim, rizik se povećava u sljedećim slučajevima:
Čini se da obrezivanje u muškaraca smanjuje rizik zarzaze HIV-om za oko 50% odstranjivanjem dijela genitalne sluznice (tj. prepucija) koja je osjetljivija na HIV infekciju od orožnjenog, slojevitog skvamoznog epitela koji pokriva ostatak penisa.
Nedavni dokazi pokazuju da ljudi zaraženi HIV-om kod kojih je antiretrovirusna terapija smanjila količinu virusa ispod trenutne detektabilne razine (virusno suprimirana) ne prenose virus spolnim putem svojim partnerima. Virus koji se ne može otkriti jednak je virusu koji se ne može prenijeti.
Rizik od prijenosa HIV-a ovisno o vrsti spolne aktivnosti
|
Rizik
|
Aktivnost
|
|---|
|
Ne postoji (osim ako su prisutne ranice)
|
Ljubljenje ne koristeći jezik (tzv. 'suho')
Trljanje tijelima i masaža
Upotreba i umetanje vlastitih seksualnih naprava (npr. seksualnih igračaka)
Stimulacija spolovila od strane partnera, no bez kontakta sa sjemenom ili vaginalnom tekućinom
Kupanje ili tuširanje s partnerom
Kontakt s izmetom ili urinom, ukoliko je koža neoštećena
|
|
Teorijski (izuzetno nizak rizik, osim ako su prisutne ranice)
|
Ljubljenje koristeći jezik (tzv 'vlažno')
Felacio (oralni seks pružen muškarcu) bez ejakulacije, ukoliko se koristi kondom
Kunilingus (oralni seks pružen ženi), ukoliko se koristi mehanička zaštita
Oralno-analni kontakt
Penetracija vagine ili anusa prstima, s li bez rukavica
Korištenje i umetanje zajedničkih, no dezinficiranih seksualnih naprava
|
|
Niska
|
Felacio bez korištenja kondoma i uz ejakulaciju
Kunilingus, ukoliko se ne koristi mehanička zaštita
Vaginalni ili analni odnos, ukoliko se kondom ne koristi ispravno
Korištenje i umetanje zajedničkih, no ne dezinficiranih seksualnih naprava
|
|
visoko
|
Vaginalni ili analni odnos s ili bez ejakulacije, ukoliko se kondom ne koristi ili se ne koristi ispravno
|
Prijenos posredovan iglama ili medicinskim instrumentima
Rizik prijenosa nakon ozljede kože medicinskim instrumentom koji je kontaminiran zaraženom krvlju iznosi iznosi oko 1:300 ukoliko se nakon incidenta ne provede postekspozicijska profilaksa; pravovremena postekspozicijska profilaksa smanjuje rizik na manje od 1:1500. Rizik je veći u slučaju dublje ozljede ili inokulacije krvi (npr. ubod kontaminiranom šupljom iglom). Rizik je također veći u slučaju ozljede šupljom iglom ili prilikom punkcije arterije i vene u usporedbi s ozljedom čvrstim iglama ili drugim medicinskim instrumentima obloženim krvlju zbog prijenosa veće količine krvi. Dakle, korištenje igala koje su upotrijebili drugi intravenski korisnici droga predstavlja vrlo visok rizik prijenosa.
Nije poznato koliki je rizik prijenosa HIV-a sa zaraženog zdravstvenog djelatnika ukoliko se on tijekom rada pridržava potrebnih mjera zaštite, no čini da je rizik minimalan. Opisan je slučaj jednog stomatologa koji je tijekom 1980–ih godina HIV–om zarazio više od šest pacijenata, no način prijenosa nije utvrđen. Otkriveno je još nekoliko slučajeva zaraze HIV–om među pacijentima o kojima su skrbili HIV–pozitivni liječnici, uključujući i kirurge.
Prijenos s majke na dijete
HIV se može prenijeti s majke na potomstvo
-
putem posteljice
-
u tijeku porođaja
-
putem majčinog mlijeka
Bez liječenja, rizik od prijenosa prilikom porođaja iznosi oko 25 do 35%.
HIV se izlučuje i majčinim mlijekom, te dojenjem od strane neliječene majke biva zaraženo još 10 od 15% novorođenčadi koja do tada nisu bila zaražena.
Stopa prijenosa se značajno smanjuje liječenjem HIV-pozitivnih majki antiretrovirusnim lijekovima tijekom trudnoće, porođaja i dojenja.
Porođaj carskim rezom, kao i liječenje djeteta nekoliko tjedana nakon rođenja također smanjuju rizik.
Budući da se mnoge HIV-pozitivne trudnice liječe ili uzimaju profilaksu, incidencija AIDS u djece se smanjuje u mnogim državama (vidi HIV infekcija u dojenčadi i djece)
Prijenos vezan uz transfuziju i transplantaciju
Probirom darivatelja krvi testiranjem na antitijela na HIV-1 i 2, kao i na HIV RNK, rizik od prijenosa transfuzijom je smanjen na minimun. Trenutni rizik od prijenosa HIV-a putem transfuzije krvi u SAD-u vjerojatno je manji od 1/2,000,000 po transfundiranoj jedinici. Međutim, u mnogim zemljama u razvoju, u kojima se ne radi probir krvi i krvnih preprarata na HIV, rizik od prijenosa HIV-a transfuzijom i dalje je visok.
U rijetkim slučajevima HIV se može prenijeti transplantacijom organa HIV-seropozitivnog donora. Infekcija HIV-om zabilježena je u primatelja bubrega, jetre, srca, gušterače, kostiju i kože (organi koji u sebi sadrže krv), no probir na HIV znatno umanjuje rizik od prijenosa. Rizik prijenosa HIV-a još je manji u slučaju transplantacije rožnice, liofilizirane ili etanolom tretirane kosti, svježe smrznute kosti bez koštane srži, liofilizirane tetive ili fascije, kao i liofilizirane i ozračene dure mater.
Prijenos HIV-a moguć je umjetnom oplodnjom koristeći sjeme HIV-pozitivnih donora. Zabilježeni su neki slučajevi zaraze u ranim 1980-im, prije nego što su uvedene mjere zaštite.
Pranje sjemena se u SAD-u smatra učinkovitom metodom smanjivanja rizika od prijenosa HIV-a od HIV-pozitivnog donora.
Epidemiologija
Epidemiologija HIV infekcije
Dva su različita epidemiološka obrasca širenja HIV-a.
-
Muškarci koji imaju seksualne odnose s muškarcima
-
Spolni odnos između muškaraca ili kontakt sa zaraženom krvi (npr. dijeljenjem igala među intravenskim korisnicima droga; transfuzijom prije uvođenja probira darivatelja)
-
Spolni odnos između muškaraca i žena (podjednako utječe na muškarce i žene)
U većini zemalja prisutna su oba obrasca, međutim prvi obično prevladava u razvijenim zemljama, dok drugi prevladava u Africi, Južnoj Americi i južnoj Aziji.
U zemljama u kojima dominira heteroseksualni put prijenosa, infekcija HIV–om širi se istim putevima kojima se odvijaju trgovina i transport robe, kao i ekonomska migracija u gradove odakle se sekundarno prenosi u ruralna područja. U Africi, osobito južnoj, epidemija HIV–a usmrtila je na desetke milijuna mlađih odraslih osoba, time ostavivši milijune siročadi. Čimbenici koji pogoduju širenju uključuju
Međutim, zahvaljujući međunarodnoj suradnji, od 2016. godine 19,5 milijuna ljudi koji žive s HIV-om imaju pristup antiretrovirusnom liiječenju, čime je u mnogim zemljama drastično smanjena stopa smrtnosti i prijenos HIV-a.
Veliki broj oportunističkih infekcija nastaje uslijed reaktivacije latentne infekcije. Stoga epidemiološki čimbenici koji određuju prevalenciju latentnih infekcija u populaciji značajno utječu na rizik pojave određenih oportunističkih infekcija. U mnogim zemljama u razvoju, prevalencija latentne tuberkuloze i toksoplazmoze u općoj populaciji veća je nego u razvijenim zemljama. Posljedično epidemiji HIV-om uzrokovane imunosupresije u ovim zemljama, zabilježen je dramatičan porast incidencije reaktivirane tuberkuloze i toksoplazma encefalitisa. Slično tome, u SAD-u je zbog HIV infekcije zabilježen porast incidencije kokcidiodomikoze, inače učestale na jugozapadu zemlje, te histoplazmoze, učestale na srednjem zapadu.
Infekcija humanim herpesvirusom 8, koja dovodi do razvoja Kaposijevog sarkoma, česta je u muškaraca koji imaju odnose s drugim muškarcima (MSM populaciji) ali nije česta među ostalim HIV oboljelim skupinama u SAD-u i Europi. Stoga su u SAD-u više od > 90% bolesnika s AIDS-om koji su razvili Kaposijev sarkom muškarci koji imaju odnose s drugim muškarcima.
Patofiziologija
Patofiziologija HIV infekcije
HIV se veže i penetrira u domaćinove T stanice putem CD4+ molekula i kemokinskih receptora (vidi prikaz Pojednostavljeni životni ciklus HIV-a). Nakon vezanja za stanicu domaćina, virus otpušta svoju RNK i enzime u stanicu.
Za odvijanje replikacije virusa neophodna je reverzna transkriptaza (RNK-ovisna DNK polimeraza), enzim koji prepisuje HIV RNK i omogućuje stvaranje provirusne DNK; u tijeku ovog procesa nastaju i brojne pogreške tj. mutacije i time novi genotipovi HIV virusa Mutacije mogu dovesti do nastanka virusa koji je otporniji na imunološki sustav domaćina i na antiretrovirusne lijekove.
Provirusna DNK potom ulazi u staničnu jezgru i integrira se u DNK stanice domaćina koristeći enzim HIV integrazu. Svakom diobom stanice, integrirana provirusna DNK se udvostručuje zajedno s DNK stanice domaćina. Posljedično tome, iz provirusne DNK procesom transkripcije nastaje novu virusna RNK nakon čega slijedi translacija u virusne proteine, kao što su glikoproteini virusne ovojnice gp40 i gp120. Virusni proteini se potom povezuju u HIV virione na unutarnjoj strani stanične membrane gdje se procesom pupanja ovijaju dijelom stanične membrane domaćina i napuštaju stanicu. Svaka stanica domaćina može stvoriti na tisuće novih viriona.
Nakon pupanja HIV proteaza cijepa prekursorske proteine HIV–a čime virion poprima svoj zreli, infektivni oblik.
Pojednostavljeni životni ciklus HIV-a
|
HIV se veže i prodire u T-limfocite domaćina, te potom otpušta svoju RNK i enzime u stanicu. HIV-reverzna transkriptaza prepisuje virusnu RNK u provirusnu DNK. Provirusna DNK ulazi u jezgru stanice domaćina, gdje se pomoću enzima intgraze integrira u DNK domaćina. Stanica domaćina potom proizvodi RNK i proteine HIV-a. Proteini HIV–a tvore virusne čestice tj. virione koji pupanjem iz stanične membrane napuštaju stanicu. HIV proteaza cijepa virusne proteine, čime iz nezrelog nastaje zreli, infektivni virion.
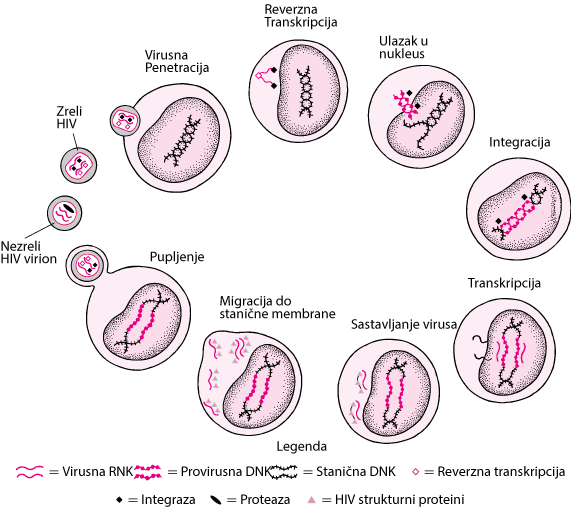 |
Više od 98% viriona koji cirkuliraju plazmom potječe iz zaraženih CD4+ limfocita. Jedan dio zaraženih CD4+ limfocita predstavlja rezervoar HIV–a iz kojeg se populacija virusa može neprestano obnavljati (npr. u slučaju prekida antiretrovirusnog liječenja).
U umjereno teškoj ili teškoj HIV infekciji svakodnevno nastaje i razgrađuje se oko 108 do 109 viriona. Prosječni poluživot HIV-a u plazmi je oko 36 sati, oko 24 sata unutar stanice i oko 6 sati kao izvanstanični virus. Svaki dan se oko 30% ukupnog tereta HIV-a kod zaražene osobe preda. Također, 5 do 7% CD4 stanica mijenja se dnevno, a cijeli skup CD4 stanica mijenja se svaka 2 dana (1). Dakle, AIDS je rezultat kontinuirane i dosljedne replikacije HIV-a, što dovodi do virusa i imunološki posredovanog ubijanja CD4 limfocita. Ovako intenzivna virusna replikacija pogoduje nastanku brojnih grešaka tijekom transkripcije, što rezultira brojnim mutacijama. One pak povećavaju vjerojatnost nastanka sojeva virusa otpornih na djelovanje imunološkog sustava domaćina i lijekova.
Imunološki sustav
Dvije osnovne posljedice zaraze HIV-om su
CD4+ limfociti dio su stanične imunosti, te, u manjoj mjeri, humoralne. Smanjenje broja CD4+ limfocita posljedica je:
-
Izravnog citotoksičnog djelovanja prilikom replikacije HIV-a
-
Citotoksičnosti posredovane stanicama
-
Oštećenja timusa što narušava proizvodnju limfocita
Zaraženi CD4+ limfociti imaju poluživot od oko 2 dana, što je mnogo kraće nego od nezaraženih. Stupanj oštećenja populacije CD4+ limfocita proporcionalan je količini viriona u plazmi, tj. razini HIV viremije. U inicijalnoj, odnosno primarnoj infekciji viremija je vrlo visoka (>106 kopija/ml) koju prati drastičan pad broja cirkulirajućih CD4+ limfocita.
Normalan broj CD4 +limfocita iznosi oko 750/μl, no imunološki sustav je tek neznatno oštećen dok god je njihov broj iznad >350/μl. Nakon što broj CD4+ limfocita padne ispod 200/μL, oštećenje stanične imunosti je značajno i omogućuje nastanak oportunističkih infekcija.
Humoralna imunost je također narušena. Hiperplazija B limfocita u limfnim čvorovima uzrokuje limfadenopatiju, kao i povećanu proizvodnju protutijela na otprije poznate antigene, tj. hipergamaglobulinemiju. Ukupna razina protutijela (osobito IgG i IgA) i titar protutijela na ranije antigene (npr. na citomegalovirus [CMV]) može biti vrlo visok. Međutim, nastanak protutijela na nove antigene (primjerice one u cjepivima), smanjuje se kako se broj CD4+ limfocita smanjuje.
Ovakva abnormalna imunološka aktivacija može biti i posljedica apsorpcije komponenti crijevnih bakterija. Još je nepoznat točan mehanizmam kojim imunološka aktivacija doprinosi smanjenju broja CD4+ limfocita i imunosupresiji.
Ostala tkiva
HIV također zahvaća i druge stanice imunološkog sustava (npr. dendritičke stanice kože, makrofage, stanice mikroglije), kao i stanice mozga, genitalnog trakta, srca i bubrega, uzrokujući time oštećenja pripadajućih organskih sustava.
Sojevi HIV-a u određenim anatomskim cjelinama, poput živčanog sustava (mozak i cerebrospinalni likvor) i genitalnom sustavu (sjeme, cervikovaginalna tekućina), mogu biti genetički drugačiji od onih u plazmi, sugerirajući da su selekcionirani ili adaptirani na određene anatomske cjeline (2-4). Dakle, razina HIV i obrasci otpora u tim odjeljcima može mijenjati neovisno od onih u plazmi.
Napredovanje bolesti
Tijekom prvih nekoliko tjedana primarne infekcije pojavljuju se humoralni i stanični imunološki odgovor:
-
Humoralni: protutijela na HIV obično se pojavljuju unutar nekoliko tjedana od infekcije; međutim, ta protutijela nisu u stanju u potpunosti kontrolirati infekciju jer paralelno nastaju i mutirani oblici virusa na koje postojeća proutijela ne djeluju.
-
Stanični: imunost posredovana stanicama značajna je u početku infekcije jer omogućuje kontrolu visokih razina viremije (obično više od 106 kopija/ l). No, s obzirom na brzu mutaciju virusnih antigena, citotoksičnost posredovana limfocitima kod velike je većine pacijenata bezuspješna u kontroli HIV infekcije.
Razina HIV viriona u plazmi, izražena brojem HIV RNK kopija u mililitru plazme, stabilizira se nakon otprilike 6 mjeseci na razini (tzv. zadana razina) koja varira uvelike među pacijentima, ali prosječno iznosi od 30,000 do 100,000/ml (4,2 do 5 log110/mL). Što je viša njihova početna razina, to je brži pad broja CD4+ limfocita do granice koja ozbiljno narušava imunost(< 200/mcL) i rezultira pojavom AIDS-definirajućih oportunističkih infekcija i tumora. (5-6).
Rizik, kao i težina oportunističkih infekcija, AIDS-a i pojave AIDS-povezanih tumora određena je dvama faktorima:
Rizik pojave nekih određenih oportunističkih infekcija raste nakon što broj CD4+ limfocita padne ispod 200 /μL, a nekih drugih ispod 50 /μL, kao u sljedećima:
Za svakih 3 puta (0.5 log10) porasta razine HIV RNK u plazmi neliječenog pacijenta, rizik od progresije do AIDS-a i smrti kroz iduće 2 do 3 godine povećava se za 50% (6).
Bez liječenja rizik progresije infekcije HIV–om do AIDS–a iznosi oko 1–2% godišnje za prve 2 do 3 godine nakon infekcije, a nakon toga 5– 6% godišnje. Praktično svi neliječeni bolesnici u konačnici razviju AIDS.
Literatura u vezi patofiziologije
-
1. Ho DD, Neumann AU, Perelson AS, et al: Rapid turnover of plasma virions and CD4 lymphocytes in HIV-1 infection. Nature 12;373(6510):123-6, 1995. doi: 10.1038/373123a0
-
2. Bednar MM, Sturdevant CB, Tompkins LA, et al: Compartmentalization, viral evolution, and viral latency of HIV in the CNS. Curr HIV/AIDS Rep 12(2):262-271, 2015. doi:10.1007/s11904-015-0265-9
-
3. Mabvakure BM, Lambson BE, Ramdayal K, et al: Evidence for both intermittent and persistent compartmentalization of HIV-1 in the female genital tract. J Virol 93(10):e00311-19, 2019. doi:10.1128/JVI.00311-19
-
4. Ghosn J, Viard JP, Katlama C, et al: Evidence of genotypic resistance diversity of archived and circulating viral strains in blood and semen of pre-treated HIV-infected men. AIDS (London, England). 18(3):447-457, 2004. doi: 10.1097/00002030-200402200-00011
-
5. Lavreys L, Baeten JM, Chohan V, et al: Higher set point plasma viral load and more-severe acute HIV type 1 (HIV-1) illness predict mortality among high-risk HIV-1-infected African women. Clin Infect Dis 1;42(9):1333-9, 2006. doi: 10.1086/503258
-
6. Lyles RH, Muñoz A, Yamashita TE, et al: Natural history of human immunodeficiency virus type 1 viremia after seroconversion and proximal to AIDS in a large cohort of homosexual men. Multicenter AIDS cohort study. J Infect Dis 181(3):872-80, 2000. doi: 10.1086/315339
Simptomi i znakovi
Simptomi i znaci HIV infekcije
Inicijalna HIV infekcija
Inicijalna, primarna infekcija HIV–om može biti asimptomatska ili se očitovati prolaznim i nespecifičnim simptomima (akutni retrovirusni sindrom).
Oralna kandidijaza (sluznica usana)
Slika prikazuje oralnu kandidijazu koja se manifestira u obliku bijelog eksudata na zadebljanoj, crvenoj i ogoljeloj površini sluznice usana.
© Springer Science+Business Media
Oralna kandidijaza (jezik)
Slika prikazuje oralnu kandidijazu koja se manifestira u obliku bijelog eksudata na zadebljanoj, crvenoj i ogoljeloj površini sluznice jezika.
© Springer Science+Business Media
Akutni retrovirusni sindrom obično se javlja nakon 1 do 4 tjedna od infekcije i traje od 3 do 14 dana. Simptomi i znakovi podsjećaju na one u infektivnoj mononukleozi ili bezazlenoj, nesecifičnoj virusnoj infekciji, a mogu se javiti vrućica, slabost, umor, osip, grlobolja, artralgija, generalizirana limfadenopatija, pa i aseptički meningitis.
Nakon povlačenja simptoma akutne retrovirusne infekcije, većina pacijenata, čak i bez liječenja, određeni broj godina (2 do 15 godina) nemaju nikakve simptome ili su oni tek blage i nespecifični.
Simptomi koji se javljaju tijekom ovog razmjerno asimptomatskog razdoblja mogu biti uzrokovani izravnim djelovanjem virusa HIV-a ili oportunističkim infekcijama. Navedeni su najčešći:
Česta je i pojava blaže do umjerene citopenije (npr. leukopenije, anemije, trombocitopenije) koja je najčešće asimptomatska. Kod nekih se bolesnika javljaju sindrom propadanja (koji može biti povezan s anoreksijom i povećanim katabolizmom zbog infekcije) i blaga vrućica ili proljev.
Napredovanje infekcije HIV-om
Kada broj CD4+ limfocita padne ispod razine od < 200/mcL, nespecifični simptomi se pogoršavaju uz razvoj prema AIDS-definirajućim bolestima (vidi AIDS-definirajuće bolesti).
U pacijenata s HIV-om, određeni sindromi su česti i mogu zahtijevati drugačiji pristup (vidi tablicu Česte manifestacije HIV infekcije prema organskim sustavima). Neki pacijenti prezentiraju se tumorima (npr. Kaposijevim sarkomom, B-staničnim limfomom) koji su češće pojavnosti, teže kliničke slike ili imaju jedinstvena obilježja u pacijenata s HIV infekcijom (vidi Česti tumori u HIV oboljelih pacijenata). Mogući su i različiti neurološki poremećaji.
Evaluacijom se često otkriju infekcije koje se rijetko susreću u općoj populaciji, kao što su
Ostale infekcije, koje se također javljaju u općoj populaciji, no ukolio su težeg tijeka ili se javljaju učestalo sugeriraju mogućnost AIDS-a su
Manifestacije HIV infekcijeDiseminirana bartoneloza u HIV infekcije
Ovaj HIV oboljeli pacijent ima diseminirane kožne papule po licu te egzofitične nodule na kapcima.
© Springer Science+Business Media
Krustozni (norveški) svrab
Slika prikazuje difuzno ljuskanje i hiperkeratotične plakove u HIV oboljelog pacijenta s krustoznim svrabom.
© Springer Science+Business Media
Kaposijev sarckom (vezan uz AIDS)
Kaposijev sarkom (KS) je vaskularni tumor uzrokovan infekcijom humanim herpesvirusom tip 8. AIDS-vezani Kaposijev sarkom je agresivna, multicentrična tumorska bolest koja zahvaća lice, trup, sluznice, limfni sustav ili gastrointestinalni sustav. Lezije se pojavljuju u obliku plavkastih ili ljubičastih makula, plakova i tumoroznih tvorbi.
Slika ustupljena ljubaznošću Sol Silverman, Jr., Public Health Image Library of the Centers for Disease Control and Prevention.
Kaposijev sarkom (rani stadij)
Ljubičasto-crveni čvorovi na donjem kapku u HIV-oboljelog pacijenta suspektni za Kaposijev sarkom.
© Springer Science+Business Media
Kaposijev sarkom (lice)
Slika prikazuje Kaposijev sarkom na licu, uhu i vratu.
© Springer Science+Business Media
Kaposijev sarkom (rame)
Slika prikazuje diseminirani ovalni plak (Kaposijev sarkom) na ramenu HIV oboljelog pacijenta.
© Springer Science+Business Media
Kaposijev sarkom (ruka)
Slika prikazuje ljubičaste plakove na podlaktici muškarca oboljelom od HIV-a.
© Springer Science+Business Media
Oralna vlasasta leukoplakija
Oralna vlasasta leukoplakija javlja se kao verukozna bijela izraslina na lateralnom rubu jezika.
Image courtesy of J.S. Greenspan, BDS, University of California, San Francisco and Sol Silverman, Jr., DDS via the Public Health Image Library of the Centers for Disease Control and Prevention.
Analni karcinom
Ova fotografija prikazuje kondilome (1) i invazivni karcinom skvamoznih stanica (2) uzrokovan perzistentnom infekcijom humanim papiloma virusom (HPV) kod osobe zaražene HIV-om.
Slika ustupljena ljubaznošću Edward J. Cachay.
Najčešće kliničke manifestacije HIV infekcije po organskim sustavima
|
Sindrom
|
Uzrok
|
Dijagnostička evaluacija
|
Liječenje
|
Simptomi / Komentari
|
|---|
|
CBC = kompletna krvna slika; CMV = citomegalovirus; CSF = cerebrospinalna tekućina; HPV = humani papiloma virus; IVIG = IV imunoglobulin; MAC = Mycobacterium avium kompleks; PCR = lančana reakcija polimeraze; PZR = parcijalno tromboplastinsko vrijeme; TBC = tuberkuloza; TMP/SMX = trimetoprim/sulfametoksazol; VZV = varicella-zoster virus.
|
|
Antiretrovirusni lijekovi i liječenje uzroka Navedeni su u ovom odjeljku o liječenju samo ako nema specifičnijeg liječenja.
|
|
srčani
|
|---|
|
Kardiomiopatija
|
Izravno virusno oštećenje srčanih miocita
|
Ehokardiografija (ultrazvuk srca)
|
Antiretrovirusni lijekovi
|
Simptomi zatajenja srca
|
|
Gastrointestinalna TB
|
|---|
|
Ezofagitis
|
Kandidoza, CMV, ili herpes simpleks virus
|
Ezofagoskopija s biopsijom ulkusa
|
Liječi se antimikoticima ili antiviroticima.
|
Disfagija, anoreksija
|
|
Gastroenteritis ili kolitis
|
Salmonela crijeva, MAC, Cryptosporidium (kriptosporidioza), Cyclospora (ciklosporijaza), CMV, mikrosporija, Cystoisospora (Isospora) belli (cistoizosporijaza), ili Clostridioides difficile
|
Kulture i mrlje stolice ili biopsija, ali određivanje uzroka može biti teško
|
Liječenje uzroka
-
Antibiotici za liječenje Salmonella infkecije, MAC, i C. difficile infekcije
-
TMP/SMX za Cyclospora
-
Antimikrobna terapija za Cystoisospora i microsporidia
-
Antivirusni lijekovi za CMV
|
Proljev, gubitak težine, grčevi u trbuhu
|
|
Kolecistitis ili kolangitis
|
CMV, Cryptosporidium, Cyclospora ili microsporidia
|
Ultrazvuk ili endoskopija
|
Antivirusni lijekovi za CMV
Antimikrobni lijekovi za Cryptosporidium, Cyclospora i microsporidia
|
Moguća bol ili opstrukcija
|
|
Analne, rektalne i perirektalne lezije
|
Herpes simplex virus
Genitalne bradavice ili analni malignom uzrokovan HPV-om
Proktitis uzrokovan Neisseria gonorrhoeae or Chlamydia trachomatis
|
Pregled
Bojenje po Gramu i kultura
Biopsija
Ispitivanje nukleinske kiseline
|
Liječenje uzroka
|
Visoka učestalost u muškaraca koji imaju odnose s drugim muškarcima koji su zaraženi HPV-om tijekom rceptivnog analnog odnosa
|
|
Hepatocelularno oštećenje uzrokovano virusima hepatitisa, oportunističkim infekcijama ili toksičnošću antivirusnih lijekova
|
TBC, MAC, CMV ili pelioza (bartoneloza)
kronični hepatitis B ili kronični hepatitis C, koje HIV može pogoršati
|
Razlikovanje od hepatitisa zbog antiretrovirusnih ili drugih lijekova
Ponekad je potrebna biopsija jetre
|
Liječenje uzroka
|
Simptomi hepatitisa (npr. anoreksija, mučnina, povraćanje, žutica)
|
|
Ginekološki
|
|---|
|
Vaginalna kandidoza
|
Candida
|
vidi: Dijagnoza
|
vidi: Liječenje
|
Moguće težeg tijeka ili rekurirajuća
|
|
Zdjelična upalna bolest (PID)
|
Neisseria gonorrhoeae, Chlamydia trachomatis ili drugi česti patogeni
|
vidi: Dijagnoza
|
vidi: Liječenje
|
Moguće težeg tijeka, atipična i slabijeg odgovora na liječenje
|
|
Hematološki
|
|---|
|
Anemija
|
Multifaktorski:
HIV-om inducirana supresija koštane srži
Imunološki posredovano oštećenje perifernih živaca
Anemija kronične bolesti
Infekcije, osobito ljudski parvovirus B-19, diseminirani MAC ili histoplazmoza
Maligni tumori
|
vidi: Evaluation of Anemia
Za infekciju parvovirusom B19, pregled koštane srži (zbog provjere prisutnosti multinuklearnih eritroblasta) ili PCR iz seruma ili koštane srži
|
Liječenje uzroka
Transfuzija po potrebi
Eritropoetin za anemiju uzrokovanu antineoplastičnim lijekovima i zidovudinom ukoliko postoji potreba za transfuzijom i razina eritropoetina je ispod 500 mU/L
IVIG za parvovirus
|
Uz parvovirus, ponekad akutna teška anemija
|
|
Trombocitopenija
|
Imunološki posredovana trombocitopenija, toksičnost lijekova, HIV-om inducirana supresija koštane srži, imunološki posredovano oštećenje perifernih živaca, infekcije ili maligni tumori
|
CBC, testovi zgrušavanja, PTT, periferni bris, biopsija koštane srži ili mjerenje von Willebrandovog faktora
|
Antiretrovirusni lijekovi
IVIG u slučaju krvarenja ili preoperativno
Moguće anti–Rho (D) IgG, vinkristin, danazol ili interferon
Ukoliko je teška i refrakterna na liječenje, splenktomija
|
Često asimptomatski i može se pojaviti kod inače asimptomatske HIV infekcije
|
|
Neutropenija
|
HIV-om izazvana supresija koštane srži, imunološki posredovana periferna destrukcija, infekcije, rak ili toksičnost lijekova
|
vidi: Dijagnoza
|
Za tešku neutropeniju (< 500/mcL) plus groznicu, odmah antibiotici širokog spektra
Ukoliko je uzrokovana lijekom, faktori stimulacije granulocitnih kolonija ili granulocitnih i makrofagnih kolonija
|
—
|
|
Neurološki
|
|---|
|
Blago do teško kognitivno oštećenje sa ili bez motoričkih nedostataka
|
Izravno oštećenje mozga izazvano virusom
|
Razina HIV RNK u cerebrospinalnom likvoru (CSL)
CT ili MRI za provjeru atrofije mozga (nespecifična)
|
Antiretrovirusni lijekovi, koji mogu umanjiti nastalo oštećenje i poboljšati funkciju, premda blaži oblik kognitivne disfunkcije obično zaostaje, čak i u liječenih bolesnika
|
Progresija do demencije neuobičajena je u liječenih bolesnika
|
|
Uzlazna paraliza
|
Guillain-Barréov sindrom ili CMV poliradikulopatija
|
MR leđne moždine
Pretrage CSL-a
|
Liječenje CMV poliradikulopatije
Suportivno liječenje Guillain-Barréovog sindroma
|
Neutrofilna pleocitoza u bolesnika s CMV poliradikulopatijom, koja može klinički djelovati kao bakterijski meningitis
|
|
Akutni ili subakutni žarišni encefalitis
|
Toxoplasma gondii (toksoplazmoza)
|
CT ili MRI koji mogu prikazati prstenaste lezije, osobito u području bazalnih ganglija
Dokazivanje protutijela u CSL-u (osjetljiva, no ne i specifična pretraga)
PCR testiranje na T. gondii DNA u cerebrospinalnom likvoru
Biopsija mozga (rijetko indicirana)
|
Piremetamin, folna kiselina, sulfadiazin i moguće trimetoprim/sulfametoksazole (klindamicin u slučaju alergije na sulfa preparate— vidi: Liječenje bolesnika s AIDS-om i drugom imunosupresivnosti)
Često doživotna terapija održavanja
|
Primarna profilaksa s klindamicinom i pirimetaminom ili trimetoprimom/sulfametoksazolom (kao za Pneumocystis pneumonija) indiciran za pacijente s brojem CD4 od < 100/mcL i prethodna toksoplazmoza ili pozitivna antitijela; može se prekinuti ako se broj CD4 poveća na > 200/mcL tijekom ≥ 3 mjeseca kao odgovor na antiretrovirusnu terapiju
|
|
Subakutni encefalitis
|
CMV
Rjeđe, herpes simplex virus ili varicella-zoster virus
|
CSF PCR
Odgovor na liječenje
|
Antivirusni lijekovi
|
S CMV, često delirij, paraliza kranijalnih živaca, mioklonus, napadaji i progresivno oštećenje svijesti pri prezentaciji
Najčešće dobar odgovor na liječenje
|
|
Mijelitis ili poliradikulopatija
|
CMV
|
MR leđne moždine
CSF PCR
|
Antivirusni lijekovi
|
Simulira Guillain-Barréov sindrom
|
|
Progresivni encefalitis samo bijele tvari
|
Progresivna multifokalna leukoencefalopatija zbog reaktivacije latentne JC virusne infekciju
HIV
|
MRI mozga
Pretrage CSL-a
|
Antiretrovirusni lijekovi koji će omogućiti oporavak imunodeficijencije (ne postoji antivirusni lijek za JC virus)
|
Obično fatalno unutar nekoliko mjeseci
Može odgovoriti na antiretrovirusne lijekove
|
|
Subakutni meningitis
|
Coccidioidomycosis, Cryptococcus (kriptokokozas), Histoplasma (histoplasmoza) ili Mycobacterium tuberculosis
|
CT ili MR
Bojanje CSL-a, dokazivanje antigena i kultura
|
Liječenje uzroka
|
Ishodi poboljšani ranim liječenjem
|
|
Periferna neuropatija
|
Izravni učinci HIV-a ili CMV-a ili toksičnost antivirusnih lijekova
|
Povijest
Ispitivanje osjetilne i motoričke funkcije
|
Liječenje uzroka ili ukidanje toksičnih lijekova
|
Vrlo često
Nije brzo reverzibilna
|
|
Oftalmološki
|
|---|
|
Retinitis
|
CMV ili VZV)
|
Izravna retinoskopija
|
Specifični anti-CMV lijekovi
|
Zahtijeva pregled specijalista
VZV uzrokuje akutnu retinalnu nekrozu kod nekih pacijenata s AIDS-om
|
|
Oralno
|
|---|
|
Oralna kandidijaza
|
Imunosupresija uzrokovana HIV-om
|
Pregled
|
Sistemski antifungici
|
Moguće bezbolno u ranim fazama
|
|
Intraoralni ulkusi
|
Herpes simpleks virus ili aftozni stomatitis
|
Pregled
|
Za aftozne ulkuse, intralezijski ili sistemski kortikosteroidi i sistemski montelukast i talidomid
Za herpes, aciklovir
|
Može biti ozbiljno i dovesti do pothranjenosti
|
|
Parodontna bolest
|
Mješovita oralna bakterijska flora
|
Pregled
|
Poboljšana higijena i prehrana
Antibiotici
|
Može biti ozbiljno, s krvarenjem, oticanjem i gubitkom zuba
|
|
Bezbolna intraoralna masa
|
Kaposijev sarkom, limfom, ili tumori inducirani HPV-om
|
Biopsija
|
Liječenje novotvorine
|
—
|
|
Bezbolne bijele filiformne mrlje na stranama jezika (oralna dlakava leukoplakija)
|
Epstein-Barr virus
|
Pregled
|
Aciklovir
|
Obično asimptomatski
|
|
plućni
|
|---|
|
Subakutni (povremeno akutni) upala pluća
|
Mikobakterije, gljive poput P. jirovecii, C. neoformans, H. capsulatum, Coccidioides immitis, ili Aspergillus
|
pulsnu oksimetriju
Rendgenski snimak prsnog koša
Kožni testovi (ponekad lažno negativni zbog anergije)
Ponekad nužna bronhoskopija s posebnim bojanjima i kulturama uzoraka bronhalnog lavata
|
Liječenje uzroka
|
Možda kašalj, tahipneu i prsima nelagoda pri predstavljanju
Blaga hipoksija ili povećani alveolarno-arterijski gradijent kisika koji se mogu pojaviti prije dokaza upale pluća na rendgenskoj snimci
|
|
Akutna (povremeno subakutna) upala pluća
|
Tipični bakterijski uzročnici odn Haemophilus, Pseudomonas, Nokardija, ili Rhodococcus
|
U bolesnika s poznatim HIV-om ili sumnjom na HIV i upalu pluća, isključivanje oportunističkih ili neobičnih patogena
|
Liječenje uzroka
|
Možda kašalj, tahipneu i prsima nelagoda pri predstavljanju
|
|
Traheobronhitis
|
Candida ili herpes simpleks virus
|
—
|
Liječenje uzroka
|
Možda kašalj, tahipneu i prsima nelagoda pri predstavljanju
|
|
Subakutna ili kronična pneumonija ili medijastinalna adenopatija
|
Kaposijev sarkom ili B-stanični limfom
|
CT prsnog koša
Bronhoskopija
|
Liječenje uzroka
|
Možda kašalj, tahipneu i prsima nelagoda pri predstavljanju
|
|
Renalni
|
|---|
|
Nefrotski sindrom ili bubrežna insuficijencija
|
Izravno virusno oštećenje, što rezultira žarišnom glomerulosklerozom
|
Biopsija bubrega
|
Antiretrovirusni lijekovi ili ACE inhibitori mogu koristiti
|
Povećana učestalost u Afroamerikanaca i pacijenata s niskim brojem CD4
|
|
Poremećaj bubrežnih tubula (glikozurija, proteinurija)
|
Neki antivirusni lijekovi
|
Pretraga mokraće i / ili krvne pretrage
|
Smanjenje doze ili ukidanje antivirusnog lijeka
|
—
|
|
Koža
|
|---|
|
Herpes zoster
|
Virus varicella-zoster
|
Klinička evaluacija
|
Aciklovir ili srodni lijekovi
|
Uobičajen
Mogući prodromni simptomi poput blage do jake boli ili trnaca prije pojave kožnih lezija
|
|
Herpes simpleks ulkusi
|
Herpes simpleks virus
|
Uobičajeno klinička evaluacija
|
Antivirusni lijekovi ako su lezije teške, opsežne, postojane ili diseminirane
|
Atipične lezije herpesa simpleksa koje su opsežne, teške ili dugotrajne
|
|
Svrab
|
Sarcoptes scabiei
|
Klinička procjena i skarifikat
|
vidi: Liječenje
|
Moguće su teške hiperkeratotične lezije
|
|
Ljubičaste ili crvene papule ili čvorići
|
Kaposijev sarkom ili bartoneloza
|
Biopsija
|
Antiretrovirusni lijekovi i liječenje uzroka
|
—
|
|
Kože lezija sa središnjim udubljenjem
|
Kriptokokoza ili molluscum contagiosum
|
vidi: Dijagnoza and vidi: Dijagnoza
|
vidi: Liječenje
|
Može biti vidljivi znak kriptokokemije
|
|
Sistemski
|
|---|
|
Sepsa i septički šok uzrokovani bolničkim gram-negativnim i stafilokoknim infekcijama, diseminirane oportunističke infekcije
|
Gram-negativni bacili, Staphylococcus aureus, Candida, Salmonella, M. tuberculosis, MAC ili H. capsulatum
|
hemokulture
pregled koštane srži
|
Liječenje uzroka
|
—
|
|
Sindrom propadanja (značajan gubitak težine)
|
Multifaktorski, uključujući AIDS, s AIDS-om povezane oportunističke infekcije i maligni tumori, i / ili hipogonadizam uzrokovan AIDS-om
|
Definiran kao gubitak više od 10% tjelesne težine
|
Antiretrovirusni lijekovi (osnovno liječenje ovog sindroma)
Liječenje infekcije u podlozi; liječenje hipogonadizma uzrokovanog AIDS-om ukoliko postoji indikacija
Mjere za poboljšanje apetita i kalorijskog unosa
|
—
|
Dijagnoza
Dijagnoza HIV infekcije
Na HIV infekciju treba posumnjati u pacijenata s perzistirajućom, neobjašnjivom, generaliziranom limfadenopatijom ili bilo kojom AIDS-definirajućom bolesti (vidi AIDS-definirajuće bolesti). Također, na infekciju HIV-om treba posumnjati i u visokorizičnih osoba s nespecifičnim simptomima koji mogu biti odraz primarne infekcije HIV-om.
Dijagnostičke pretrage
Određivanje HIV protutijela osjetljiva je i specifična metoda dokazivanja infekcije HIV–om, osim tijekom prvih nekoliko tjedana od infekcije. Međutim, HIV p24 antigen (osnovni protein virusa) već je prisutan u krvi tijekom većeg dijela tog vremena i može se otkriti analizama. Trenutno se preporučuju kombinirani imunotestovi 4. generacije kojiima se dokazuju protutijela na HIV-1 i HIV-2, kao i na p24 antigen (p24 je protein jezgre virusa). Laboratorijske inačice testova imaju prednost u odnosu na 'point-of-care' testove, no oba se mogu učiniti brzo (unutar 30 minuta). Ukoliko je rezultat testa pozitivan, potrebno je učiniti test za diferenciranje HIV-1 i HIV-2, kao i određivanje HIV RNK u plazmi.
Imunoenzimski testovi (ELISA) ranijih generacija vrlo su osjetljivi, međutim kako se njima ne dokazuje antigen, ne mogu dokazati infekciju tako rano kao kombinirani testovi 4. generacije. Nadalje, rezultati su rijetko lažno pozitivni. Stoga se svaki pozitivan nalaz ELISA–om mora potvrditi specifičnijim testom kakav je Western blot. Međutim, ovi testovi imaju nedostatke:
-
Izvođenje ELISA-a zahtijeva složenu opremu.
-
Izvođenje Western blota zahtijeva dobro obučene tehničare, te je skupo.
-
Ukupno trajanje izvođenja testa traje barem jedan dan.
Noviji 'point-of-care' testovi koji koriste krv ili slinu (npr. aglutinacija čestica, imunokoncentracija, imunokromatografija) mogu biti biti učinjeni brzo (u 15 minuta), te su jednostavni za izvođenje, tako omogućujući testiranje u različitim sredinama, a pacijent rezutat doznaje odmah. U razvijenim zemljama pozitivne rezultate brzih testova potrebno je potvrditi standardnim krvnim testovima (npr. ELISA s ili bez Western blota), dok se u zemljama u razvoju u svrhu potvrde ponavlja jedan ili više drugih brzih testova. Negativne rezultate nije potrebno potvrditi.
Ukoliko unatoč negativnom rezultatu testa na HIV protutijela postoji sumnja na infekciju (npr. tijekom prvih tjedana od infekcije), može se učiniti određivanje HIV RNK u plazmi. Testovi umnažanja nukleinskih kiselina veoma su osjetljivi i specifični. Testovi za utvrđivanje koncentracije HIV RNK (samog virusa) zahtijevaju naprednu tehnologiju, poput RT–PCR (engl. reverse transcription–PCR) ili bDNK (engl. branched DNA) kojima se može dokazati i vrlo niska koncentracija virusnih čestica. Određivanje antigena p24 pomoću ELISA-e je manje osjetljiv i specifičan test od izravnog dokazivanja HIV RNK u krvi.
Praćenje
Nakon što se potvrdi infekcija HIV-om, potrebno je odrediti:
I jedno i drugo koriste se u prognostičke svrhe, te za praćenje učinkovitosti liječenja.
Broj CD4+ limfocita izračunava se kao umnožak sljedećega:
-
Broja leukocita (npr. 4000 stanica/ml)
-
Postotak leukocita kojeg čine limfociti (npr. 30%)
-
Postotak limfocita kojeg čine CD4+ limfociti (npr. 20%)
Koristeći gore navedene vrijednosti, broj CD4+ limfocita (4000 x 0.3 x 0.2) je 240 stanica/ml, ili oko 1/3 normalnog broja CD4+limfocita u odraslih osoba, što iznosi oko 750 ± 250/μL.
HIV virusno opterećenje
Razina HIV RNK u plazmi (engl. viral load) odraz je stupnja replikacije HIV–a. Što je viša zadana vrijednost (relativno stabilna razina viremije koja nastupa nakon primarne infekcije), brže opada broj CD4+ limfocita i veći je rizik od pojave oportunističke infekcije, čak i u bolesnika bez simptoma.
HIV genotip može se odrediti iz uzorka krvi; testiranje nije dostupno u svakom laboratoriju. Genotipizacija HIV-a koristi se za određivanje mutacija odgovornih za rezistenciju na određene antiretrovirusne lijekove što će pomoći u odabiru najučinkovitije kombinacija lijekova za pojedinog pacijenta.
Određivanje stadija bolesti
Stadij HIV infekcije može se odrediti na temelju broja CD4+ limfocita. U bolesnika ≥ 6 godina, stadiji su:
-
Stadij 1: ≥ 500 stanica/μL
-
Stadij 2: 200 do 499 stanica/μL
-
Stadij 3: < 200 stanica/μL
Broj CD4+ limfocita nakon 1-2 godine liječenja govori o krajnjoj mogućnosti imunološkog oporavka; taj se broj kod nekih bolesnika unatoč dugotrajnoj supresiji replikacije HIV-a neće u potpunosti oporaviti.
Stanja povezana s HIV-om
Dijagnostika raznih oportunističkih infekcija, malignih tumora i drugih sindroma koji se javljaju u HIV bolesnika opisana je u drugim poglavljima ovog PRIRUČNIKA. U mnogih se susreću stanja jedinstvena za HIV infekciju.
Hematološki poremećaji (npr. citopenije, limfomi, maligni tumori) su česti, a moguće ih je uspješno dijagnosticirati punkcijom i biopsijom koštane srži. Ova procedura pomaže u dijagnosticiranju diseminirane infekcije s MAC-om, M. tuberculosis, Cryptococcus, Histoplasma, human parvovirus B19, P. jirovecii i Leishmania. U većina se bolesnika nalazi normocelularna ili hipercelularna koštanu srž unatoč perifernoj citopeniji, što ukazuje na destrukciju stanica na periferiji. Zalihe željeza u organizmu obično su normalne ili povećane, sukladno anemiji kronične bolesti (poremećaj reutilizacije željeza). Česte su blaga do umjerena plazmocitoza, limfoidni agregati, povišen broj histiocita i razni oblici displazije hematopoetskih stanica.
HIV-povezani neurološki sindromi mogu se diferencirati putem lumbalne punkcije i analizom cerebrospinalnog likvora te CT-om ili MRI-jem s kontrastom (vidi tablicu Česte manifestacije HIV infekcije po organskim sustavima).
Testiranje na HIV (koga testirati?)
Testiranje na HIV treba ponuditi svim odraslim osobama i adolescentima, posebice trudnicama, bez obzira na njihov percipirano rizik. One pod povećanim rizikom, osobito spolno aktivnim osobama koje imaju više spolnih partnera i ne primjenjuju mjere zaštite, testirati treba svakih 6-12 mjeseci. Svako se testiranje mora obaviti uz maksimalnu diskreciju i zaštitu povjerljivosti ispitivane osobe, po mogućnosti besplatno, te mora biti dostupno u što više javnih i privatnih institucija diljem svijeta.
Svjetska zdravstvena organizacija predlaže da se u zemljama s niskim i srednjim dohotkom testiranje na HIV provodi kombinacijom 2 različita brza testa na antitijela (vidi Consolidated guidelines on HIV testing services, July 2015). Brzi testovi imaju prednost jer nude preliminarne rezultate testa pri prvom susretu za manje od 25 minuta. Posebno su korisni za ljude koji se vjerojatno neće vratiti po rezultate testa. Osobe koje se testiraju na HIV trebale bi također dobiti informacije o uslugama prevencije, njege i liječenja (uključujući poveznice na internetske resurse kada je to prikladno).
Prognoza
Prognoza za HIV infekciju
Rizik razvoja AIDS-a, smrti, ili oboje moguuće je predvidjeti
Za svaki trostruki (0.5 log10) porast viremije, smrtnost u naredne 2 do 3 godine povećava se za oko 50%. Morbiditet i mortalitet povezani s HIV-om ovise o broju CD4+ limfocita, pri čemu je najveća smrtnost zbog HIV-a pri razinama < 50/μL. Ipak, s učinkovitim liječenjm, razina HIV RNK pada do nemjerljive razine, CD4 broj se povećava a rizik od bolesti i smrti pada, iako ostaje viši no u populacije iste dobi bez infekcije HIV-om (1).
Drugi, još nedovoljno istražen prognostički čimbenik je razina imunološke aktivacije koju određuje ekspresija aktivacijskih biljega na CD4+ i CD8+ limfocitima. Aktivacija, koja može biti uzrokovana translokacijom bakterija kroz HIV-om oštećenu sluznicu kolona, snažan je prognostički pokazatelj, no test nije u kliničkoj upotrebi jer nije široko dostupan, a i budući da antiretrovirusna terapije uvelike mijenja prognozu, ovaj je test ustvari manje važan.
Podskupina bolesnika s HIV-om (nazvani engl. 'long-term nonprogressors' ili dugoročni neprogresori) unatoč tome što ne uzimaju ART zadržavaju visok broj CD4+ limfocita i nisku razinu HIV-a u plazmi, te nemaju nikakvih simptoma. Ove osobe obično imaju snažan stanični i humoralni imunološki odgovor na soj HIV-virusa kojim su zaraženi, što se može potvrditi i in vitro testovima. Ovo je važno zbog sljedećega: ukoliko se te osobe zaraze drugim sojem HIV-a protiv kojeg njihov imunološki odgovor nije tako učinkovit, nastupa tipičniji obrazac progresije HIV bolesti. Dakle, njihov neobično djelotvoran imunološki odgovor na prvi soj ne odnosi se i na drugi soj. HIV bolesnike je u ovim slučajima važno savjetovati kako i dalje trebaju izbjegavati izloženost mogućoj HIV superinfekciji putem nezaštićenog spolnog odnosa ili dijeljenjem igala.
Izlječenje HIV-infekcije još nije moguće, stoga je nužno doživotno liječenje. HIV-bolesnike je važno poticati da antiretrovirusne lijekove uzimaju redovito. Opisani slučaj djeteta u kojeg je HIV-virus privremeno iskorijenjen nakon 15 mjeseci antiretrovirusne terapije pobudio je nadu u izlječenje. Međutim, replikacija HIV-a se u djeteta ipak nastavila. U velikom međunarodnom kliničkom ispitivanju, rizik od oportunističke infekcije ili smrti bilo kojeg uzroka, osobito zbog prerane koronarne bolesti, cerebrovaskularnih incidenata ili poremećaja rada jetre i bubrega, bio je značajno veći kada je antiretrovirusna terapija uzimana epizodično (utvrđeno kretanje broja CD4+ limfocita) nego kada je uzimana kontinuirano (1).
Literatura
-
1. Park LS, Tate JP, Sigel K, et al: Association of viral suppression with lower AIDS-defining and non-AIDS-defining cancer incidence in HIV-infected veterans: A prospective cohort study. Annals of Internal Medicine 169(2):87-96, 2018. doi: 10.7326/m16-2094
-
2. Strategies for Management of Antiretroviral Therapy (SMART) Study Group, El-Sadr WM, Lundgren J, et al: CD4+ count-guided interruption of antiretroviral treatment. N Engl J Med 30;355 (22):2283–96, 2006. doi: 10.1056/NEJMoa062360
Liječenje
Antiretrovirusni lijekovi
-
Kombinacije antiretrovirusnih lijekova ('antiretroviral therapy', ART tj. antiretrovirusno liječenje, ponekad se naziva 'highly active ART' ili HAART tj. visokoaktivna ART, ili 'combined ART', cART tj. kombinirana ART).
-
Kemoprofilaksa oportunističkih infekcija kod pacijenata s visokim rizikom
(Vidi također Lijekovi za liječenje HIV infekcije')
S obzirom da se komplikacije HIV bolesti mogu javiti i bolesnika s visokim brojem CD4+ limfocita ukoliko se ne liječe, te zbog toga što danas postoje znatno manje toksični ART, liječenje se preporučuje gotovo svim pacijentima. Prednosti ART-a nadmašuju rizike u svim ispitivanim skupinama bolesnika i uvjetima liječenja. U START (Strategic Timing of AntiRetroviral Treatment) studiji randomizirano je 5472 bolesnika s HIV infekcijom i brojem CD4+ limfocita >350 stanica/mL, te je dio bolesnika započeo s ART-om odmah (rani, neposredni početak), a u dijela je početak ART-a odgođen dok se broj CD4+ limfocita nije smanjio na <250 stanica/mL (odgođeni početak). Rizik od događaja povezanih s AIDS-om (npr. tuberkuloza, Kaposijev sarkom, maligni limfomi) i događaja koji nisu povezani s AIDS-om (npr. maligni tumori koji nisu povezani s AIDS-om, kardiovaskularne bolesti) bio je niži u skupini bolesnika s neposrednim početkom ART-a (1).
Vrlo mali broj iznimnih pacijenata mogu kontrolirati svoj HIV soj bez liječenja; održavaju normalnu razinu CD4+ limfocita u krvi i vrlo nisku razinu HIV-a u plazmi (dugoročni neprogresori) ili normalnu razinu CD4+ limfocita i nemjerljivu razinu HIV-a u plazmi (tzv. 'elite contollers' ili elitni kontrolori). Ovi pacijenti možda i ne trebaju ART, no studije koje bi to potvrdila nisu provedene jer je uzorak vrlo malen, a pacijenti se vjerojatno i bez ART-a dulje vrijeme osjećaju dobro.
Antiretrovirusno liječenje: Opća načela
Cilj ART-a je
Slabiji oporavak broja CD4+ limfocita vjerojatniji je ukoliko je njihov broj i na početku liječenja bio vrlo nizak (pogotovo <50/μL) i/ili je razina HIV RNK bila vrlo visoka. Međutim, određeni boljitak može se postići i u osoba s uznapredovalom imunosupresijom. Povećanje broja CD4+ limfocita povezano je sa smanjenjem rizika pojave oportunističkih infekcija, drugih komplikacija i smrti. Čak i kod stanja za koja ne postoji specifično liječenje (npr. kognitivna disfunkcija povezana s HIV–om) ili koja su se ranije smatrala neizlječivima (npr. progresivna multifokalna leukoencefalopatija) može nastupiti poboljšanje ukoliko se postigne imunološki oporavak. Ishod je poboljšan i za pacijente s malignim tumorima (npr. limfom, Kaposijev sarkom) i većinom oportunističkih infekcija.
Antiretrovirusno liječenje obično je uspješno ukoliko pacijenti uzimaju lijekove > 95% vremena. Međutim, nije uvijek lako postići suradljivost bolesnika. Djelomična supresija (razina viremije je snižena, no ne i nemjerljiva) doprinosi opstanku jedne ili više mutacija u HIV virusa koje virus čine djelomično ili potpuno rezistentnim na jedan ili više antiretrovirusnih lijekova. Liječenje u tom slučaju vjerojatno neće biti uspješno, osim ako se ne nastavi lijekom iz druge skupine na koju je virus još osjetljiv.
Bolesnici s akutnim oportunističkim infekcijama imaju najviše koristi od ranog započinjanja ART-a (početak ART u okviru liječenja oportunističke infekcije). Međutim, za neke oportunističke infekcije, kao što su tuberkulozni ili kriptokokni meningitis, studije upućuju da početak ART valja odgoditi dok se ne završi prva faza antimikrobnog liječenja.
Uspješnost ART-a procjenjuje se mjerenjem razine HIV RNK u plazmi svakih 8-12 tjedana prvih 4-6 mjeseci ili dok razina ne postane nemjerljiva, te svakih 3-6 mjeseci nakon toga. Povećanje razine HIV RNK najraniji je pokazatelj neuspjeha liječenja i može mjesecima prethoditi opadanju broja CD4+ limfocita. Zadržavanje postojećeg neuspješnog režima liječenja potpomaže selekciju rezistentnijih HIV mutanata. Međutim, u usporedbi s divljim tipom HIV-a, ovi mutanti imaju slabiju moć redukcije populacije CD4+ limfocita, te se stoga ponekad čak i neuspješni režimi liječenja nastavljaju ukoliko nije moguća bolja opcija.
Test probira na HIV
U slučaju neuspjeha liječenja potrebno je provesti ispitivanje osjetljivosti (rezistencije) na lijekove čime se procjenjuje osjetljivost dominantnog soja HIV-a na sve dostupne lijekove. Dostupni genotipski i fenotipski testovi kliničaru pomažu odabrati novi režim liječenja koji bi trebao sadržavati barem 2, a poželjno 3 lijeka na koje je soj HIV-a više osjetljiv. Dominantni soj HIV-a u plazmi bolesnika kojem je ukinuta ART može nakon više mjeseci ili godina ponovno postati soj divljeg tipa (tj. osjetljiv), jer se mutanti umnažaju sporije i tako bivaju zamijenjeni divljim tipom. Dakle, ukoliko bolesnik nije recentno liječen, stvarni opseg rezistencije na lijekove neće biti vidljiv iz samog testa rezistencije, no nakon što se liječenje nastavi rezistentni sojevi često se bude latencije i zamijenjuju divlji soj HIV-a.
Mnogi pacijenti koji žive s HIV infekcijom liječe se složenim režimima koji uključuju više tableta kako bi kontrolirali razinu HIV RNK (viremija), a da nakon neuspjeha liječenja nije učinjeno nikakvo uobičajeno testiranje rezistencije na lijekove. Uz dostupnost novih koformuliranih lijekova protiv HIV-a, režim liječenja mnogih pacijenata uvelike je pojednostavnjen, vođen testiranjem genotipova arhivirane HIV DNK (GenoSure Archive). Arhiva genotipa HIV DNK omogućuje uvid u rezistenciju virusa HIV-1 na antiretrovirusne lijekove kada se zbog nisku razine HIV RNK u plazmi (<500 kopija/mL) konvencionalno testiranje rezistencije ne može provesti. Test arhive genotipa HIV DNK analizira integriranu i neintegriranu arhiviranu HIV-1 provirusnu DNK ugrađenu u stanice domaćina. Test umnožava staničnu HIV-1 DNK iz zaraženih stanica u uzorcima pune krvi, a zatim koristi tehnologiju sekvenciranja nove generacije (tzv. next-generation sequencing) za analizu HIV-1 polimerazne regije. Pozitivna prediktivna vrijednost rezultata testa rezistencije arhive genotipa HIV DNK omogućuje kliničarima pronalazak do tad neidentificiranih mutacija koje nose rezistenciju, te odabir potencijalno jednostavnijeg režima liječenja s koformuliranim lijekovima (≥ 2 lijeka u jednoj piluli).
Imunorekonstruktivni upalni sindrom (IRIS)
Započinjanjem ART–a u nekih bolesnika može doći do kliničkog pogoršanja usprkos povišenju broja CD4+ limfocita, što je posljedica imunološke reakcije na subkliničke oportunističke infekcije ili na rezidualne mikrobne antigene nakon uspješnog izlječenja oportunističkih infekcija. IRIS se obično javlja u prvim mjesecima liječenja, ali ponekad i kasnije. IRIS može otežati tijek gotovo svake oportunističke infekcije, pa čak i tumora (npr. Kaposijevog sarkom), ali je obično samoograničavajući ili reagira na kratko liječenje kortikosteroidima.
Postoje dva oblika:
-
Paradoksalni IRIS, koji se odnosi na pogoršanje simptoma prethodno već dijagnosticirane infekcije
-
Razotkrivajući IRIS, koji se odnosi na prvo pojavljivanje simptoma infekcije koja do tada nije dijagnosticirana
Paradoksalni IRIS obično se javlja u prvim mjesecima liječenja i obično spontano prolazi. Ukoliko ne nastupi spontana rezolucija, daju se kortikosteroidi kroz kratko vrijeme, te su najčešće učinkoviti. Paradoksalni IRIS češće izaziva simptome, a vjerojatnije je da će simptomi biti teški ako je ART započeta ubrzo nakon početka liječenja oportunističke infekcije. Stoga se kod nekih oportunističkih infekcija početak ART-a odgađa dok se liječenjem oportunističke infekcije ona ne smanji ili eliminira.
U bolesnika s razotkrivajućim IRIS-om, novootkrivena oportunistička infekcija liječi se antimikrobnim lijekovima. Povremeno, kada su simptomi teški, koriste se i kortikosteroidi. Obično se kod pojave razotkrivajućeg IRIS-a ART nastavlja. Iznimka je kriptokokni meningitis. Tada se ART privremeno prekida dok se infekcija ne zaliječi.
Ponekad je teško utvrditi je li kliničko pogoršanje posljedica neuspjeha liječenja, IRIS-a ili obaju, te zahtijeva procjenu prisutnosti aktivne infekcije pomoću kultura.
Prekid antiretrovirusne terapije
Prekid ART je obično siguran ukoliko se svi lijekovi istovremeno prekinu, no razina nekih lijekova koji se sporije metaboliziraju (npr. nevirapin) može ostati visoka i time povećati rizik od razvoja rezistencije. Ponekad je potrebno prekinuti ART kako bi se provelo liječenje neke novonastale bolesti, ili smanjila ili procijenila toksičnost lijekova. Nakon prekida ART-a u svrhu procjene koji je lijek odgovoran za toksični učinak, može se ponovno započeti s pojedinačnim uvođenjem lijekova tijekom nekoliko dana što u većini slučajeva neće izazvati neželjene učinke. bolesnici koji su ranije razvili vrućicu ili osip dok su primali abakavir, u slučaju ponovne izloženosti ovom lijeku mogu razviti potencijalno fatalnu reakciju preosjetljivosti. Rizik od neželjene reakcije na abakavira je 100 puta veća u bolesnika s HLA-B * 57: 01, koji se mogu detektirati s genetičkom testiranju.
Savjeti i zamke
-
Ukoliko se u pacijenta koji je imao nepovoljnu reakciju na abakavir taj lijek ponovno uvede, može se javiti ozbiljna, potencijalno smrtonosna reakcija preosjetljivosti, te ga stoga valja izbjegavati. Rizik od neželjene reakcije na abakavira je 100 puta veća u bolesnika s HLA-B * 57: 01, koji se mogu detektirati s genetičkom testiranju.
|
Skrb na kraju života
Iako je antiretrovirusno liječenje dramatično produljilo životni vijek bolesnika s AIDS-om, mnogi bolesnici i dalje propadaju i umiru. Smrt može biti posljedica sljedećeg:
-
Nemogućnost redovnog uzimanja ART-a, što rezultira progresivnom imunosupresijom
-
Pojava neizlječivih oportunističkih infekcija i malignih tumora
-
Zatajenje jetre zbog hepatitisa B ili C
-
Ubrzano starenje i poremećaji povezani sa starenjem
-
Maligni tumori koji nisu povezani sa AIDS-om, a koji se s većom učestalošću javljaju u bolesnika s inače dobro kontroliranom HIV infekcijom
Smrt je rijetko iznenadna; bolesnik obično ima vremena razmisliti o mnogim stvarima i donijeti neke odluke. Ipak, neke je odluke dobro i pismeno zabilježiti i ovjeriti kod odvjetnika (npr. punomoć), s jasnim uputama o obliku i opsegu skrbi u terminalnom stadiju bolesti. Ostali pravni dokumenti, uključujući punomoći i oporuke, trebali bi biti riješeni. Ovi su dokumenti posebno važni za one pacijente čiji partneri, voljene osobe ili njegovatelji nisu zakonski priznati, što može rezultirati nemogućnošću posjeta tih partnera ili drugih voljenih osoba ili sudjelovanja u donošenju odluka ili obavljanju pogrebnih i ukopnih želja, isključenje iz nasljeđivanja imovine, uključujući i obiteljsku kuću, ili druge teške posljedice.
Kako se pacijenti bliže kraju života, kliničari će morati propisivati lijekove za kupiranje bolova, anoreksije, agitacije i drugih distresnih simptoma. Veliki gubitak tjelesne težine u terminalnom stadiju oboljelih od AIDS–a ponekad otežava higijenu i njegu kože bolesnika. Sveobuhvatna podrška koju pružaju domovi za nemoćne osobe pomaže mnogim pacijentima, jer su djelatnici hospicija često vješti u simptomatskom liječenju, te pomažu njegovateljima, kao i samom pacijentu u očuvanju njegove samostalnosti.
Literatura
-
1. INSIGHT START Study Group, Lundgren JD, Babiker AG, et al: Initiation of antiretroviral therapy in early asymptomatic HIV infection. N Engl J Med 373 (9):795–807, 2015. doi: 10.1056/NEJMoa1506816
Prevencija
Prevencija HIV infekcije
Cjepiva protiv HIV-a nije bilo moguće razviti jer su površinski proteini HIV-a skloni mutacijama što rezultira vrlo velikom raznolikošću tipova antigena. Ipak, u tijeku su ispitivanja raznih pokušaja cjepiva, a neki su se pokazali obećavajućim u kliničkim ispitivanjima. U ovom trenutku ne postoji djelotvorno cjepivo protiv AIDS-a.
Prevencija prijenosa
Vaginalni mikrobicidi (uključujući antiretrovirusne lijekove) umetnuti prije samog spolnog kontakta nisu se pokazali djelotvornima, dapače neki od njih čak i povećavaju rizik prijenosa virusa na ženu jer oštećuju prirodne barijere.
Učinkovite mjere uključuju:
-
Edukaciju opće populacije: Primjeri iz nekih zemalja, osobito Tajlanda i Ugande, pokazuju da je edukacija opće populacije vrlo učinkovita mjera u smanjenju stope zaraženih osoba. Budući da se HIV najčešće prenosi spolnim putem, edukacija o izbjegavanju nezaštićenih spolnih praksi je najrelevantnija mjera (vidi tablicu Rzik prijenosa HIV-a ovisno o vrsti spolne aktivnosti).
-
Praksa sigurnog seksa: Praksa sigurnog seksa između pacijenta zaraženog HIV-om čija infekcija nije virusno potisnuta i partnera koji nisu zaraženi HIV-om ključna je za sprječavanje širenja infekcije. Osim ako je poznato da partner zaražen HIV-om ima virusno potisnutu infekciju (tj. nemjerljivu količinu virusa) i veza ostaje monogamna, sigurni seks je ključan. Virusno potisnute osobe koje žive s HIV-om ne prenose virus spolnim putem svojim partnerima (taj virus koji se ne može otkriti jednak je virusu koji se ne može prenijeti) (1). Zašićen spolni odnos u jednakoj se mjeri preporučuje i partnerima koji su HIV-pozitivni; osobe zaražane HIV-om mogu jedna drugu izložiti soju HIV-a koji je rezistentan ili virulentniji od onoga kojim je sama zaražena, ali i drugim virusima (npr. citomegalovirusu, Epstein–Barrovom virusu, herpes simpleks virusu, virusu hepatitisa B), kao i sifilisu, te ostalim spolno prenosivim bolestima (sexually transmitted diseases, STD). Kondomi pružaju najbolju zaštitu. Lubrikante na bazi ulja valja izbjegavati jer mogu otopiti lateks, što kondom čini neučinkovitom mjerom zaštite. (Vidi također informacije od strane CDC-a na temu HIV Transmission.)
-
Savjetovanje za korisnike intravenskih droga: Savjetovanje o riziku od dijeljenja igala je važno, ali je vjerojatno učinkovitije ako se uz to korisnicima omogući pristup sterilnim iglama, kao i liječenje ovisnosti o drogama i rehabilitacija.
-
Povjerljivo testiranje na HIV: Testiranje treba ponuditi rutinski adolescentima i odraslim osobama u okviru svih oblika organzacije zdravstvene zaštite. Kako bi se rutinsko testiranje pojednostavnilo, u nekim se zemljama više ne zahtijeva pisani pristanak ili opsežno savjetovanje prije testiranja.
-
Savjetovanje za trudnice:Vertikalni prijesnos (prijenos s majke na dijete) je gotovo eliminiran uvođenjem testiranja na HIV, antiretrovirusnog liječenja, te, u razvijenim zemljama, korištenjem zamjenskog majčinog mlijeka. Ukoliko se testiranjem trudnice potvrdi HIV infekcija, trudnici treba objasniti rizik prijenosa infekcije na dijete. Trudnice koje ne prihvaćaju ART odmah valja dalje poticati da prihvate liječenje kako bi zaštitile nerođeno dijete, s kojim se obično počinje oko 14. tjedna trudnoće. Najčešće se koristi kombinirana terapija jer je učinkovitija od monoterapije i rjeđe dovodi do rezistencije na lijekove. Neki lijekovi mogu biti toksični za plod ili trudnicu, te ih treba izbjegavati. Ako je indicirano uvođenje ART-a, režim treba prilagoditi svakoj pojedinoj bolesnici i stadiju trudnoće, te ga nastaviti tijekom cijele trudnoće. Porođaj carskim rezom također smanjuje rizik prijenosa. Bez obzira na režim liječenja tijekom trudnoće i način porođaja, sve zaražene žene trebaju dobiti zidovudin i.v. tijekom i nakon porođaja, a novorođenčadi treba dati zidovudin p.o., te ga nastaviti sljedećih 6 tjedana (vidjeti također Prevencija perinatalnog prijenosa). Neke žene ipak se odluče za prekid trudnoće zbog straha od infekcije djeteta ili drugih razloga.
-
Probir krvi i organa na HIV: Prijenos infekcije transfuzije krvi vrlo j malo vjerojatan, no ipak moguć (u SAD-u) jer je tijekom rane infekcije test na HIV protutijela negativan. Stoga je danas u SAD-u obvezno testiranje krvi na prisutnost i protutijela i p24 antigena što dodatno smanjuje rizik prijenosa transfuzijom. Kako bi se taj rizik još više smanjio, osobama s nekim od rizičnih faktora preporuča se da se uzdrže od doniranja krvi i organa, čak i ako su recentno testirani na HIV i test je bio negativan. FDA (Food and Drug Administration) je izdao nacrt smjernica za odgodu darivanja krvi, uključujući odgodu za 12 mjeseci nakon najrecentnijeg spolnog kontakta za muškarce koji su imali odnos s drugim muškarcima, kao i za žene koje su imale odnos s muškarcem koji je imao spolni odnos s drugim muškarcem (vidjeti Revised Recommendations for Reducing the Risk of HIV Transmission by Blood and Blood Products). Na žalost, u zemljama u razvoju upotreba osjetljivih testova na HIV i odgoda doniranja organa, krvi i krvnih proizvoda ne provode se dosljedno.
-
Predekspozicijska profilaksa antiretrovirusnim lijekovima (PrEP): PrEP je namijenjen osobama koje nisu zaražene HIV-om, no izložene su visokom riziku (npr. imaju odnose s HIV pozitivnim partnerom), a koje svakodnevnim uzimanjem antiretrovirusnog lijeka smanjuju rizik od infekcije. Može se koristiti kombinacija tenofovir dizoproksil fumarata i emtricitabina (TDF/FTC). Korištenje PrEP-a ne umanjuje važnost korištenja drugih metoda zaštite od HIV infekcije, uključujući kondome i izbjegavanje rizičnih ponašanja (npr. dijeljenja igle). Nema dovoljno podataka o utjecaju TDF/FTC-a na djecu HIV-negativnih majki koje uzimaju PrEP tijekom trudnoće, premda do sada nisu zabilježeni nepovoljni učinci u djece HIV pozitivnih majki liječenih TDF/FTC-om. Još se proučava mogućnost primjene PrEP-a kod korisnika intravenskih droga u svrhu smanjenja rizika prijenosa infekcije. Proučavaju se i dugodjelujući antiretrovirusni agensi za daljnje poboljšanje PrEP-a u visokorizičnim populacijama s lošim pridržavanjem lijekova. Za trenutne preporuke od strane CDC-a, vidi Pre-Exposure Prophylaxis (PrEP).
-
Obrezivanje muškaraca: U mladih afričkih muškaraca obrezivanje se pokazalo kao učinkovita mjera u smanjenju rizika od zaraze HIV-om od ženskih partnera tijekom vaginalnog spolnog odnosa za oko 50%, a vjerojatno je jednako djelotvorno i u drugim zemljama. Smanjuje li obrezivanje rizik prijenosa HIV-a od HIV-pozitivnih muškaraca na ženske i muške partnere je još nepoznato.
-
Opće mjere zaštite: Svim zdravstvenim djelatnicima, uključivo i stomatolozima, preporučuje se nositi zaštitne rukavice u situacijama u kojima mogu doći u kontakt sa sluznicom ili tjelesnom tekućinom bolesnika, te ih je potrebno educirati o načinima sprječavanja ubodnih incidenata. I njegovatelji koji kod kuće skrbe o HIV bolesnicima preporučuje se nositi rukavice ukoliko su izloženi tjelesnim tekućinama bolesnika. Svaku radnu površinu ili instrument koji je kontaminiran krvlju ili drugom tjelesnom tekućinom potrebno je propisno očistiti i dezinficirati. Učinkovitim mjerama dezinfekcije smatraju se primjena topline, peroksida, alkohola, fenola i hipoklorita (bjelilo). Nije potrebno izolirati HIV pozitivne bolesnike, osim ako boluju od neke oportunističke bolesti koja to zahtijeva (npr. tuberkuloze).
-
Liječenje infekcije HIV-om: Liječenje ART-om smanjuje rizik prijenosa
Postekspozicijska profilaksa (PEP):
Moguće posljedice izlaganja HIV-u potaknuli su razvoj strategija i procedura, posebice preventivnog liječenja, kako bi se smanjila opasnost od infekcije zdravstvenih djelatnika.
Preventivno liječenje indicirano je nakon
-
Probijajuće ozljede u kojima je prisutna HIV-om zaražena krv (obično ubodi iglom)
-
Izlaganje sluznice (oka ili usta) većoj količini zaražene tjelesne tekućine kao što je sjeme, vaginalna tekućina, ili druge tjelesne tekućine koja sadrži krv (npr. amnionska tekućina)
Tjelesne tekućine poput sline, urina, suza, nosnog sekreta, povraćenog sadržaja ili znoja se ne smatraju potencijalno infektivnima, osim ako ne sadrže primjese krvi.
Nakon izlaganja zaraženoj krvi, izloženo je područje potrebno odmah oprati vodom i sapunom, a u slučaju ubodne rane i antiseptikom. Ako je sluznica bila izložena, ispire se velikom količinom vode.
Važno je zabilježiti:
-
Način izloženosti
-
Vrijeme proteklo od izloženosti
-
Klinički podaci (uključujući faktore rizika i serološke testove za HIV) o izvornom, HIV pozitivnom pacijentu i izloženoj osobi
Način izloženosti definirana je
-
Vrstom tjelesne tekućina koja je u pitanju
-
Je li se radilo o probijajućoj ozljedi (npr. ubod iglom, posjekotina oštrim predmetom) i koliko je ozljeda duboka
-
Je li zaražena tekućina došla u kontakt s oštećenom kožom (npr. ogrebana ili ispucala koža) ili sluznicom
Rizik od infekcije iznosi oko 0.3% (1: 300), nakon kožne izloženosti, te oko 0.09% (1:1100) nakon sluznične izloženosti. Ti se rizici razlikuju ovisno o količini prenesenog HIV virusa osobi s ozljedom; na količinu prensenog virusa utječe više čimbnika, uključujući viremiju HIV bolesnika i vrstu igle (npr. šuplja ili solidna). Međutim, ovi se čimbenici u preporukama za PEP više ne uzimaju u obzir.
Izvor se karakterizira ovisno o tome je li poznat ili nepoznat. Ako je izvor nepoznat (npr. igla na ulici ili u spremniku za oštar otpad) rizik treba procijeniti na temelju okolnosti izlaganja (npr. je li izlaganje nastupilo u području u kojem je intravenska uporaba droga rasprostranjena, je li igla odbačena u centru za liječenje ovisnosti o drogama). Ako je izvor poznat, ali nije poznat HIV status izvora, izvor bi trebao biti evaluiran za HIV rizik, a profilaksa razmotrena (vidi tablicu Preporuke za postekspozicijsku profilaksu).
Preporuke za postekspozicijsku profilaksu
|
Status infekcije izvora
|
Profilaksa
|
|---|
|
PEP valja razmotriti kao mogućnost, ovisno o individualnoj odluci koju zajedno donose izložena osoba i liječnik koji vrši evaluaciju. Ukoliko se započne PEP, a naknadno utvrdi da je izvorni bolesnik HIV-negativan, PEP se treba prekinuti.
|
|
Preuzeto iz preporuka od strane World Health Organization: Smjernice o postekspozicijskoj profilaksi HIV-a i upotrebi kotrimoksazola za profilaksu HIV-povezanih infekcija u odraslih, adolescenata i djece: Preporuke za javnozdravstveni pristup — Prosinac 2014. godine, dodatak smjernicama iz 2013. godine o upotrebi antivirusnih lijekova za liječenje i prevenciju HIV infekcije.
|
|
HIV pozitivni (simptomatska ili asimptomatska HIV infekcija, AIDS, akutna serokonverzija, ili potvrđena visoka viremija).
|
PEP s ≥ 3 antiretrovirusna lijeka
|
|
Izvor nepoznatog HIV statusa ili nepoznat izvor
|
Općenito, PEP nije opravdana*; međutim, PEP valja razmotriti ako se radi o rizičnom izvoru ili uvjeti u kojima je nastupilo izlaganje uključuju izloženost HIV-om zaraženim osobama
|
|
HIV-negativni (na temelju ispitivanja protutijela ili testova umnažanja nukleinskih kiselina)
|
PEP nije zajamčen
|
Ukoliko je indicirana, PEP je važno započeti što ranije nakon izlaganja. CDC preporučuje započinjanje PEP unutar 24 do 36 sati nakon izlaganja; ukoliko se radi o duljem periodu potrebno je konzultirati stručnjaka.
Provođenje PEP-a uvjetovano je rizik od infekcije; smjernice preporučuju antiretrovirusnu terapiju s ≥ 3 antiretrovirusna lijeka. Valja odabrati lijekove sa čim manjom mogućnošću nepovoljnih učinaka, i što jednostavnijim rasporedom uzimanja kako bi se potaknula suradljivost pacijenta. Preferirani režimi uključuju kombinaciju 2 NRTI-a i inhibitora integraze, bilo raltegravira ili dolutegravira. U bolesnika reproduktivne dobi preferira se raltegravir jer je dolutegravir moguće teratogen tijekom prvog tromjesečja trudnoće—to je pod epidemiološkim ispitivanjem. Alternativni režimi uključuju 2 NRTI plus inhibitor proteaze. Za detaljnije preporuke, vidi stranicu CDS-a na temu: Updated Guidelines for Antiretroviral Postexposure Prophylaxis After Sexual, Injection Drug Use, or Other Nonoccupational Exposure to HIV—United States, 2016 i Interim Statement Regarding Potential Fetal Harm from Exposure to Dolutegravir – Implications for HIV Post-exposure Prophylaxis (PEP).
Ukoliko je virus izvora rezistentan na ≥ 1 lijeka ili postoji sumnja na na to, valja konzultirati stručnjaka za antiretrovirusno liječenje i prijenos HIV-a. Međutim, dok se čeka mišljenje stručnjaka ili rezultati testiranja rezistencije na lijekove počinjanje PEP-a se ne smije odgađati. Također, izloženu osobu potrebno je odmah klinički evaluirati, pružiti savjetovanje, kao i praćenje nakon toga.
Prevencija oportunističkih infekcija
(Vidi također United States Public Health Service and the HIV Medicine Association of the Infectious Diseases Society of America’s Guidelines for Prevention and Treatment of Opportunistic Infections in HIV-Infected Adults and Adolescents.)
Učinkovita kemoprofilaksa dostupna je za mnoge oportunističke infekcije i smanjuje stope bolesti uzrokovane P. jirovecii, Candida, Cryptococcus, i MAC-om. Nakon što se broj CD4+ limfocita oporavi i ostane iznad normalne razine > 3 mjeseca, kemoprofilaksa se može prekinuti.
Primarna profilaksa ovisi o broju CD4+ limfocita
-
Broj CD4+ limfocita < 200/μL ili orofaringealna kandidoza (aktivna ili izliječena): Preporučuje se profilaksa protiv P. jirovecii pneumonije. Učinkovit lijek je trimetoprim / sulfametoksazol (TMP / SMX) u tabletama dvostruke doze jednom dnevno, triput tjedno. Neke nuspojave mogu se izbjeći doziranjem lijeka triput tjedno ili postupnim povećavanjem doze. Bolesnicima koji ne podnose TMP/SMX daje se dapson (100 mg jednom dnevno). Bolesnici s glukoza-6-fosfat dehidrogenazom (G6PD) s nedostatkom su izloženi riziku od razvoja teške hemolize pri primjeni dapsona i, stoga, treba se ispitati na nedostatak G6PD prije uporabe dapsona. U malog broja bolesnika koji zbog pojave ozbiljnih nuspojava (npr. vrućica, neutropenija, osip) ne podnose ni jedan od ova dva lijeka, može se dati pentamidin u obliku aerosola (300 mg jednom dnevno) ili atovakvon 1500 mg u jednoj dnevnoj dozi.
-
Broj CD4+ limfocita < 50/μL: Preporučuje se profilaksa diseminirane MAC infekcije azitromicinom ili klaritromicinom; ako bolesnik ne tolerira makrolide, može se koristiti rifabutin. Prednost se daje azitromicinu jer se može primijeniti i jednom tjedno u dozi do 1200 mg što pruža jednaku zaštitu (70%) kao i svakodnevna primjena klaritromicina, a uz to nema značajnijih interakcija s drugim lijekovima.
Ako postoji sumnja na latentnu TB (na temelju tuberkulinskog kožnog testa, testa otpuštanja interferona gama (IGRA), izlaganja visokog rizika, aktivne tuberkuloze u anamnezi ili boravka u području s visokom prevalencijom tuberkuloze), bolesniku treba dati izoniazid 5 mg/kg (do 300 mg) p.o. jednom dnevno uz piridoksin (vitamin B6) 10 do 25 mg p.o. jednom dnevno kroz 9 mjeseci kako bi se spriječila reaktivacija, neovisno o broju CD4+ limfocita.
Moguća je i primarna profilaksa nekih gljivičnih infekcija (npr. kandidoze jednjaka, kriptokoknog meningitisa ili pneumonije) peroralno flukonazolom, svakodnevno (100–200 mg dnevno) ili tjedno (jednokratno 400 mg), no ne provodi se često zbog visoke cijene, a dijagnosticiranje i liječenje ovih infekcija nije toliko zahtjevno i obično je uspješno.
sekundarna profilaksa (nakon suzbijanja početne infekcije) indicirana je ako su bolesnici imali nešto od sljedećeg:
Detaljne smjernice za profilaksu gljivičnih (uključujući Pneumocystis), virusnih, mikobakterijskih infekcija i toksoplazmoze dostupne su na: ClinicalInfo.
Cijepljenje
Preporuke od strane CDS-a (CDC 2020 recommendations) za cijepljenje HIV oboljelih pacijenata uključuju sljedeće:
-
Bolesnici koji do tada nisu primili konjugirano pneumokokno cjepivo (PCV13) ili polisaharidno pneumokokno cjepivo (PPSV23) trebaju dobiti PCV13, te nakon 8 tjedana PPSV23.
-
Svi pacijenti trebali bi se cijepiti cjepivom protiv gripe svake godine.
-
Sve bolesnike potrebno je cijepiti protiv hepatitisa B.
-
Bolesnici u kojih postoji rizik od hepatitisa A ili se žele zaštititi valja cijepiti protiv hepatitisa A.
-
Muškarce i žene odgovarajuće dobi treba cijepiti protiv humanog papiloma virusa (HPV) kako bi se spriječio nastanak raka grlića maternice i anusa vezanih s HPV-om.
-
Odrasle osobe koje ranije nisu cijepljenemeningokoknim cjepivom trebaju dobiti dvije doze MenACWY cjepiva u razmaku od 2 mjeseca.
-
Bolesnici koji nisu primili cjepivo protiv tetanusa-difterije-pertusisa (Tdap) u sklopu svojih završenih cjepivo protiv tetanusa-difterije (Td) seriji treba dati Tdap za njihov sljedeći Td booster. Za pacijente koji započinju ili nastavljaju s Td serijom, a još nisu primili Tdap, Tdap treba zamijeniti jednim od Td boostera.
Općenito, valja koristiti samo inaktivirana cjepiva. Takva cjepiva u HIV pozitivnh osoba rjeđe su učinkovita nego u kod onih koji su HIV-negativni.
Primjena cjepiva protiv herpesa zostera (za jačanje imuniteta kako bi se spriječila reaktivacija virusa u obliku zostera) mogla bi biti korisna u HIV-om zaraženih odraslih, ali je kontraindicirana ako je broj CD4+ limfocita <200 / ul. Originalno živo atenuirano cjepivo protiv zostera kontraindicirano je u bolesnika s oslabljenim imunološkim sustavom i ako je broj CD4 < 200/mcL. Međutim, novije rekombinantno cjepivo protiv zostera nije kontraindicirano u bolesnika s HIV-om. Ministarstvo zdravstva i socijalne zaštite SAD-a preporučuje da odrasle osobe s HIV-om starije od 50 godina prime cjepivo protiv rekombinantnog zostera, ali Savjetodavni odbor za praksu cijepljenja (ACIP) tek treba službeno preporučiti cijepljenje za sprječavanje herpes zostera kod osoba s HIV-om (vidi CDC 2020 Adult Conditions Immunization Schedule).
Budući da su živa cjepiva potencijalno opasna za pacijente s teškom imunosupresijom, treba potražiti sturčno mišljnje kada se radi o pacijentu u riziku za primarnu varicelu; preporuke se razlikuju (vidi informacije o cijepljenju u HIV oboljele dojenčadi i djece i tablicu Razmatranja o upotrebi živih cjepiva u djece s HIV infekcijom).
Literatura
-
1. Rodger AJ, Cambiano V, Bruun T, et al: Sexual activity without condoms and risk of HIV transmission in serodifferent couples when the HIV-positive partner is using suppressive antiretroviral therapy. JAMA 316(2):171-81, 2016. doi: 10.1001/jama.2016.5148
Ključne točke
-
HIV inficira CD4+ limfocite čime narušava staničnu imunost i, u manjoj mjeri, humoralnu imunost.
-
HIV se prenosi poglavito spolnim kontaktom, parenteralnom izloženošću zaraženoj krvi i prenatalnim i perinatalnim putem od majke.
-
Učestale mutacije virusa udružene s oštećenjem imunološkog sustava značajno oslabljuju sposobnost tijela da suzbije infekciju HIV-om.
-
Bolesnici s HIV bolesti obolijevaju od raznih oportunističkih infekcija i malignih tumora, te su oni i najčešći uzrok smrti u neliječenih bolesnika.
-
Dijagnoza se postavlja dokazivanjem protutijela, a potom se bolest prati mjerenjem viremije i broja CD4+ limfocita.
-
Liječenje se provodi kombinacijom antiretrovirusnih lijekova koji pomažu u oporavku imunološkog sustava u većine bolesnika, ako lijekove uzimaju redovito.
-
Bolesnike koje žive s HIV-om je potrebno povremeno savjetovati i ukazati na važnost prakticiranja zaštićenih spolnih odnosa, redovite tjelesne aktivnosti i zdrave prehrane, te smanjenja stresa.
-
Ukoliko je indicirano, preporuka je koristititi postekspozicijsku i predekspozicijsku profilaksu.
-
Ovisno o broju CD4+ limfocita bolesniku je potrebno dati primarnu profilaksu protiv oportunističkih infekcija.
Više informacija
Mogu bit korisni sljedeći alati za procjenu: Imajte na umu da The Manual nije odgovoran za sadržaj ovih izvora.
-
CDC 2020 Immunization Schedule: Recommended adult immunization schedule by medical condition and other indications
-
Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents: Drug-Drug Interactions: Informacije o farmakokinetičkim (PK) interakcijama između lijekova između antiretrovirusnih (ARV) lijekova i istodobnih lijekova koje su uobičajene i mogu dovesti do povećane ili smanjene izloženosti lijeku
-
Guidelines for Prevention and Treatment of Opportunistic Infections in HIV-Infected Adults and Adolescents
-
Guidelines on post-exposure prophylaxis for HIV and the use of co-trimoxazole prophylaxis for HIV-related infections among adults, adolescents and children: Preporuke za javnozdravstveni pristup - Prosinac 2014. godine, dodatak ARV smjernicama iz 2013. godine
-
National Institutes of Health's AIDSInfo: HIV-related research information from the NIH’s Office of AIDS Research (OAR), the National Institute Of Allergy and Infectious Diseases (NIAID), and the U.S. National Library of Medicine (NLM)
-
CDC: Post-Exposure Prophylaxis (PEP): Resursi za pružatelje usluga i potrošače u vezi s upotrebom antiretrovirusnih lijekova nakon jednog visokorizičnog događaja za zaustavljanje serokonverzije HIV-a
-
Primary Care Guidelines for the Management of Persons Infected with Human Immunodeficiency Virus: 2020 Update by the HIV Medicine Association of the Infectious Diseases Society of America: Smjernice temeljene na dokazima za zbrinjavanje ljudi oboljelih od HIV-a
-
Updated U.S. Public Health Service Guidelines for the Management of Occupational Exposures to HIV and Recommendations for Postexposure Prophylaxis Dopunjene smjernice od strane U.S. Public Health Service za postupanje kod profesionalne izloženosti HIV-u i preporuke za postekspozicijsku profilaksu
-
Revised Recommendations for Reducing the Risk of HIV Transmission by Blood and Blood Products, 2020: Revidirani dokument sa smjernicama koji daje ustanove za krv koje prikupljaju krv ili krvne sastojke, uključujući izvornu plazmu, s revidiranim preporukama za odgodu darivatelja za pojedince s povećanim rizikom od prijenosa HIV infekcije