Mnogi faktori su uključeni u uzrokovanje i dopuštanje neregulirane proliferacije stanica koja se javlja kod raka.
(Vidi isto Pregled raka.)
Stanična kinetika
Vrijeme generacije je vrijeme potrebno da stanica završi svoj ciklus diobe (vidi odlomak Stanični ciklus) i stvori 2 stanice kćeri. Maligne stanice, osobito one koji proizlaze iz koštane srži ili limfnog sustava, mogu imati kratko vrijeme generacije, a tu je obično manji postotak stanica u G0 (Fazi mirovanja). Početni eksponencijalni rast tumora slijedi faza ravnoteže, kad stopa ugibanja odgovara stopi stvaranja stanica kćeri. Usporavanje stope rasta može biti povezano sa iscrpljenom opskrbom hranjivim tvarima i kisika za brzi rast tumora. Manji tumori imaju veći postotak aktivno dijeljenih stanica nego veliki tumori.
Subpopulacije u mnogim tumorima, koje se prepoznaju po površinskim proteinima, mogu imati svojstva primitivne "normalne" matične stanice, kao što je pronađeno u ranom stadiju embrija. Tako ove stanice mogu ući u stanje proliferacije. One su manje osjetljive na ozljede lijekovima i zračenjem. Vjeruje se da upravo one nasele tumore nakon kirurške i kemijske terapije ili zračenja.
Stanična kinetika pojedinih tumora je važna pri planiranju antineoplastičkih protokola pa utječe na doziranje i na terapijske intervale. Mnogi antineoplastični lijekovi, kao što su antimetaboliti, su najučinkovitiji na stanice s aktivnim dijeljenjem, a neki lijekovi rade samo u određenom fazi staničnog ciklusa i time zahtijevaju produženu primjenu kako bi uhvatili stanicu u fazi diobe i maksimalne osjetljivosti.
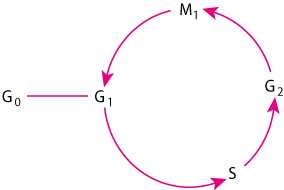
Stanični ciklus.
|
G0 = faza mirovanja (neproliferacija stanica); G1 = varijabilna pre-DNA sintetička faza (12 sati do nekoliko dana); S = sinteza DNA (obično 2 do 4 sata); G2 = sinteza post-DNA (2-4 h) - tetraploidna količina DNA se nalazi unutar stanica; M1 = mitoza (1 do 2 h).
|
Rast tumora i metastaziranje
Tijekom rasta novotvorina dobiva hranjive sastojke izravnom difuzijom iz krvotoka. Lokalni rast olakšavaju enzimi (npr. kolagenaze) i citokini koji razaraju ili mijenjaju susjedna tkiva. Kako se volumen tumora povećava, oni produciraju faktore tumorske angiogeneze, kao što su vaskularni endotelni faktor rasta (VEGF), koji promiču formiranje krvožilne opskrbe potrebne za daljnji rast tumora.
Gotovo od samog začetka, rak može otpuštati svoje stanice u krvotok. Po životinjskim modelima procjenjuje se da novotvorina promjera 1 cm zasijava u venski krvotok >1 milijun stanica/24 h. Cirkulirajuće stanice tumora su prisutne u mnogim pacijentima s uznapredovalim rakom, pa čak i u nekih s lokaliziranom bolešću. Premda većina tih stanica ugiba zbog ozljeđivanja u krvotoku, sićušni dio (mnogo manji od 1: 1 milijun) ipak prianja o žilni endotel i prodire u susjedna tkiva, stvarajući neovisne, udaljene presadnice. Metastatski tumori rastu na isti način kao i primarni, pa kasnije postaju ishodište daljnjih presadnica.
Eksperimenti ukazuju da je važna svojstvo metastatskih stanica da napadnu, migriraju, uspješno implantiraju i stimuliraju rast novih krvnih žila, koje vjerojatno predstavljaju podskup stanica u primarnom tumoru.
Imunološki sustav i rak
Maligne stanice tipično manifestiraju antigene koje imunološki sustav interpretira kao "ne-svoje". To često dovodi do uništenja malignih stanica kao kod bilo kojeg stranog osvajača. Ovo uništenje može biti dovršeno, u tom slučaju se rak nikada ne pojavljuje. Međutim, neke maligne stanice imaju ili dobivaju sposobnost da izbjegnu otkrivanje i / ili uništenje od strane imunološkog sustava, dopuštajući im da proliferiraju.
Iako imunološki sustav očito ima zaštitnu ulogu, nije jasno zbog čega ljudi sa urođenim ili stečenim imunološkim nedostacima imaju povećani rizik od samo nekih uobičajenih vrsta raka (npr. melanoma, karcinoma bubrežnih stanica, limfoma), a ne drugih (npr. rak pluća, dojke, prostate, debelog crijeva). Jedno razmatranje je da je bilo malo selektivnog evolucijskog pritiska za poboljšanje imunološkog odgovora na rak koji se javlja nakon starosti reprodukcije.
S druge strane, zloćudne stanice imaju snažan evolucijski pritisak da razviju načine za izbjegavanje imunološkog sustava. Jedan obrambeni mehanizam uključuje oponašanje normalnih stanica izražavanjem proteina kontrolne točke. Proteini kontrolne točke su molekule na površini stanice koje signaliziraju cirkulirajućim T-stanicama da je stanica koja ih nosi normalna i da ih ne treba napadati. Primjer je PD-L1 protein, kojeg prepoznaje molekula PD-1 na T stanicama; kada se PD-L1 veže na PD-1 na T stanici, ta stanica ne napada. Terapija raka pomoću monoklonskih antitijela koja blokiraju ili PD-L1 ili PD-1 (nazvani inhibitori kontrolne točke) tako može omogućiti imunološkom sustavu da napadne maligne stanice koje su prethodno zaštićene prisutnošću proteina PD-L1. CTLA-4 je još jedan protein kontrolne točke koji sprječava napad imunološkog sustava i može biti slično blokiran antitijelom. Budući da proteini kontrolnih točaka mogu biti prisutni na normalnim stanicama, terapija inhibitorima kontrolne točke može također potaknuti imunološki sustav da napadne te stanice.
Još jedan važan napredak u imunološkoj terapiji uključuje korištenje genetski modificiranih T-stanica (koje se nazivaju T-stanična [CAR-T] terapija kimernog antigena). U tom procesu, T stanice se uklanjaju iz pacijenta i genetski su modificirane da eksprimiraju receptore koji sadrže domenu prepoznavanja za specifični tumorski antigen vezan za intracelularne signalne domene koje aktiviraju T-stanicu. Kada se modificirane T stanice reinfuziraju, mogu napasti stanice koje nose taj specifični tumorski antigen.
Molekularni otkloni
Genetske mutacije su odgovorni za proizvodnju stanica raka, te su stoga prisutni u svih vrsta raka. Te mutacije mijenjaju količinu ili funkciju proteina koji nadziru stanični rast, diobu i popravak DNK. Dvije glavne skupine mutiranih gena su onkogeni i tumor– supresorski geni.
-
onkogeni
-
tumor supresorski geni
Onkogeni
Onkogeni su izmijenjeni normalni geni (proto–onkogeni) koji nadziru stanični rast. Njihove mutacije izravno i trajno potiču molekulske putove (npr. unutarstanični prijenos signala, čimbenici transkripcije, faktori rasta) nadzora staničnog rasta i diobe.
Postoji >100 poznatih onkogena koji u ljudi pridonose neoplastičnoj pretvorbi. Na primjer, RAS gen kodira ras protein koji nosi signale od receptora vezanih na membranu niz put RAS-MAP kinaze do stanične jezgre i time regulira staničnu diobu. Mutacije mogu izazvati neprimjereno aktiviranje Ras proteina s nekontroliranim rastom i diobom stanica. Doista, Ras protein je nenormalan u oko 25% humanih maligniteta.
Drugi su onkogeni upleteni u specifične oblike raka. To uključuje
-
HER2 (pojačan u raku dojke i želuca i rjeđe kod raka pluća)
-
BCRABL1 (translokacija 2 gena koja je temelj kronične mijeloične leukemije i nekih B-stanica akutne limfocitne leukemije)
-
CMYC (Burkittov limfom)
-
NMYC (rak ne-malih stanica pluća, neuroblastoma)
-
mutirani EGFR (Adenokarcinom pluća)
-
EML4ALK (translokacija koja aktivira tirozin kinazu ALK i uzrokuje jedinstveni oblik adenokarcinoma pluća)
Specifični onkogeni imaju važnu ulogu u dijagnostici, liječenju i prognozi (vidi pojedinačne oblike raka).
Onkogeni obično rezultiraju iz
-
Stečene točkaste mutacije somatske stanice (npr. zbog kemijskih karcinogena)
-
Amplifikacije gena (npr. povećanje broja kopija normalnog gena)
-
Translokacije (u kojima se komadi različitih gena spajaju u jedinstvenu sekvencu)
Te promjene ili mogu povećati aktivnost genskog produkta (protein) ili promijeniti njegovu funkciju. Povremeno, mutacija gena u zametnim stanicama rezultira nasljeđivanjem predispozicije za rak.
Tumor supresorski geni
Geni poput TP53, BRCA1 i BRCA2 igraju ulogu u normalnoj staničnoj diobi i popravku DNK i kritični su za otkrivanje neprimjerenih signala rasta ili oštećenja DNA u stanicama. Ako ti geni, kao posljedica naslijeđenih ili stečenih mutacija, više ne mogu funkcionirati, sustav za praćenje integracije DNA postaje neučinkovit, stanice sa spontanim genetskim mutacijama preživljavaju i dijele se, što rezultira tumorom.
Kao i za većinu gena, po dva alela kodiraju svaki supresorski gen. Manjkava kopija jednog gena može biti nasljedna, pa ostaje samo jedan djelatni alel za individualni tumor–supresorski gen. Ako je mutacija stečena u funkcionalnom alelu, gubi se normalni zaštitni mehanizam drugog normalnog gena za supresiju tumora.
Druga važna regulacijska bjelančevina, p53, sprječava repliciranje oštećene DNK u normalnim stanicama i potiče apoptozu u stanicama s abnormalnom DNK. Inaktivan ili promijenjen p53 dopušta stanicama s abnormalnom DNK preživljavanje i diobu. TP53 mutacije se prenose na stanice kćeri s velikom vjerojatnošću zloćudne pretvorbe. TP53Gen p53 je defektan u nizu malignih neoplazmi čovjeka.
BRCA1 i BRCA2 mutacije koje smanjuju funkciju povećavaju rizik od raka dojke i jajnika.
Drugi primjer, gen za retinoblastom (RB) kodira protein Rb, koji regulira stanični ciklus zaustavljanjem DNA replikacije. Mutacije RB gena javljaju se u mnogo humanih karcinoma te omogućuju zahvaćenim stanicama kontinuirano dijeljenje.
Kao i kod onkogena, mutacije tumor supresor gena kao što su TP53 ili RB u matičnim stanicama mogu rezultirati vertikalnim prijenosom i većom incidencijom raka u potomstvu.
Kromosomske anomalije
Kromosomske abnormalnosti mogu nastati delecijom, translokacijom ili duplikacijom. Ako te promjene aktiviraju ili inaktiviraju gene, tako da pogođenim stanicama pružaju proliferativnu premoć nad normalnima, onda može nastati rak. Kromosomski su otkloni opisani u nizu zloćudnih novotvorina čovjeka. U nekim urođenim bolestima (npr. Bloomov sindrom, Fanconijev sindrom, Downov sindrom) kromosomi lako pucaju i takvu djecu izlažu visokom riziku pojave akutne leukemije i drugih zloćudnih tvorbi.
Ostali utjecaji
Većina epitelnih karcinoma vjerojatno rezultira iz niza mutacija koje dovode do neoplastične pretvorbe. Na primjer, razvoj karcinoma debelog crijeva u obiteljskoj polipozi odvija se nizom genetskih događaja: hiperproliferacija epitela (gubitak supresorskog gena na kromosomu 5), rani adenom (promjena u metilaciji DNA), intermedijarni adenom (prekomjerna aktivnost RAS onkogena), kasni adenom (gubitak supresorskog gena na kromosomu 18) i na kraju rak (gubitak gena na kromosomu 17). Za metastaziranje su izgleda potrebne dodatne genetske preinake.
Telomere su kompleksi nukleoproteina koji tvore krajeve kromosoma i čuvaju njihov integritet. U normalnom tkivu, skraćivanje telomera (koje se javlja sa starenjem) predstavlja granicu stanične diobe. Ako se enzim telomeraza aktivira u stanicama tumora, potiče novu sintezu telomera i dopušta kontinuiranu proliferaciju tumora.
Čimbenici okoliša
Infekcije
Virusi doprinose patogenezi nekih humanih karcinoma (vidi tablicu Virusi povezani s rakom). Patogeneza može nastati integracijom genetskih elemenata virusa u DNK domaćina. Novonastali geni mogu utjecati na rast ili na diobu stanica, odnosno oštetiti normalne gene domaćina potrebne za nadzor staničnog rasta i diobe. Virusna infekcija može usto izazvati otklone imuniteta i osujetiti imuni nadzor nad početnim oblicima raka. HIV infekcija povećava rizik od određenog broja karcinoma (vidjeti Karcinomi uobičajeni kod HIV-inficiranih pacijenata).
Bakterije također mogu uzrokovati rak. Helicobacter pylori infekcija povećava rizik od nekoliko vrsta raka (adenokarcinom želuca, limfom želuca, limfom sluznice limfnog tkiva [MALT]).
Pojedini paraziti mogu dovesti do nastanka raka. Schistosoma haematobium uzrokuje kroničnu upalu i fibrozu mokraćnog mjehura, koja se zna prometnuti u karcinom. Opisthorchis sinensis se povezuje s rakom gušterače i žučnih vodova.
Zračenje
Ultraljubičasto zračenje može izazvati rak kože tako što oštećuje DNA (npr. bazalni i skvamozni karcinom, melanom). Tako nastaju dimeri timidina koji izbjegnu popravak zbog inherentnih mana u repariranju DNK (npr. xeroderma pigmentosum) ili zahvaljujući drugim, rijetkim i slučajnim pojavama. Pacijenti s inherentnim defektima u popravku DNA (npr. Xeroderma pigmentosum) ili oni kojima je imunitet potisnut lijekovima ili osnovnom bolešću, posebno su skloni raku kože zbog izloženosti ultraljubičastom zračenju.
Ionizirajuće zračenje je također karcinogeno. Na primjer, preživjeli nakon eksplozija atomskih bomba u Hirošimi i Nagasakiju imali su znatno višu incidenciju leukemija i drugih maligniteta od očekivane. Slično tome, izloženost terapijskim zračenjem može dovesti do leukemije, raka dojke i drugih solidnih tumora godinama nakon izlaganja. Ekspozicija dijagnostičkom zračenju također može povisiti rizik za nastanak raka (vidjeti Rizik medicinskog zračenja). Industrijska ekspozicija zračenju (npr. rudari urana) povezana je s pojavom raka pluća nakon latencije od 15–20 god. Dugotrajna profesionalna izloženost vanjskom zračenju, kao i deponiranom torij dioksidu, pogoduje nastanku angiosarkoma i akutne nelimfocitne leukemije.
Radon, radioaktivni plin koji se otpušta iz tla, povećava rizik za nastanak karcinoma pluća, osobito u pušača. Normalno, radon se brzo raspršuje u atmosferu i ne uzrokuje štetu. Međutim, kada se zgrada nalazi na tlu bogatom radonom, on može akumulirati unutar zgrade u dovoljno visokoj koncentraciji da prouzrokuje štetu. U ljudi koji također i puše, rizik od nastanka raka pluća se dalje povećava.
Lijekovi i kemikalije
Estrogen u oralnim kontraceptivima lagano može povećati rizik od raka dojke, no taj se rizik smanjuje tijekom vremena. Estrogen i progestin koji se koriste kao hormonska nadomjesna terapija, povećavaju rizik od nastanka raka dojke.
Dietilstilbestrolom (DES) povećava rizik od raka dojke u žena koje su uzimale lijek i povećava rizik od vaginalnih karcinoma u kćeri tih žena koje su bile izložene lijeku prije rođenja.
Dugotrajna upotreba anaboličkih steroida može povećati rizik od raka jetre.
Liječenje raka kemoterapijom ili u kombinaciji sa zračenjem povećava rizik od razvoja drugog karcinoma.
Kemijski karcinogeni mogu inducirati genske mutacije i uzrokovati nekontrolirani rast i formaciju tumora. (vidjeti tablicu Poznati kemijski karcinogeni). Neke tvari, zvane ko–kancerogeni, imaju vrlo malen ili nikakav onkogeni potencijal, ali pri istodobnom izlaganju povećavaju kancerogenost drugih spojeva.
Poznati kemijski karcinogeni
|
karcinogeni
|
Vrsta raka
|
|
• Zdravstveni radnici izloženi antineoplastičnim lijekovima također su izloženi riziku od štetnih učinaka na reprodukciju.
|
|
Okolišni i industrijski
|
|
Aromatski amini
|
Rak mjehura
|
|
Arsen
|
Rak pluća
Rak kože
|
|
Azbest
|
Rak pluća
Mezoteliom
|
|
Benzen
|
Leukemija
|
|
Kromati
|
Rak pluća
|
|
Ispušni produkti Dizela
|
Rak pluća
|
|
Formaldehid
|
Leukemija
Rak nosa
Nazofaringealni karcinom
|
|
Boje za kosu
|
Rak mjehura
|
|
Ionizirano zračenje
|
Leukemija
|
|
Prerađena mineralna vlakna
|
Rak pluća
|
|
Nikl
|
Rak pluća
Rak sinusa
|
|
Slikarski materijali
|
Rak pluća
|
|
Pesticidi, bez arsena
|
Rak pluća
|
|
Radon
|
Rak pluća
|
|
Radijacija
|
Različiti karcinomi
|
|
Ultraljubičasto zračenje
|
Rak kože
|
|
Vinil klorid
|
Jetreni angiosarkom
|
|
Način života
|
|
Betel orašasti plodovi
|
Orofaringealni rak
|
|
Duhan
|
Rak mjehura
Rak grlića maternice
Rak jednjaka
Rak glave i vrata
Rak bubrega
Rak pluća
Rak gušterače
Rak želuca
|
|
Lijekovi:
|
|
Alkilirajući lijekovi (ciklofosfamid, analozi platine)
|
Leukemija
|
|
Diethylstilbestrol (DES)
|
Cervikovaginalni rak u žena izloženih u maternici
|
|
Imunosupresivi
|
limfom
Rak kože
|
|
Oksimetolon
|
Rak jetre
|
|
Inhibitori topoizomeraze (antraciklini, etopozid)
|
Leukemija
|
Dijetetski tvari
Određene tvari koje se konzumiraju u prehrani mogu povećati rizik od raka. Na primjer, prehrana s visokim udjelom masti i sama pretilost su povezani s povećanim rizikom od raka debelog crijeva, dojke i karcinoma prostate. Ljudi koji konzumiraju velike količine alkohola imaju znatno veći rizik od razvoja raka glave, vrata i jednjaka. Dimljena i ukiseljena hrana ili meso spravljeno na visokoj temperaturi povećava rizik od razvoja raka želuca. Pretili ljudi imaju veći rizik od nastanka raka dojke, endometrija, debelog crijeva, bubrega i jednjaka.
Fizikalni čimbenici
Kronične upale kože, pluća, gastrointestinalnog trakta ili upale štitnjače mogu pogodovati razvoju raka. Bolesnici s dugotrajnim ulceroznim kolitisom i sklerozirajućim kolangitisom imaju povećan rizik za nastanka kolangiokarcinoma. Izloženost sunčevim i umjetnim svjetlima u solariju povećava rizik od raka kože i melanoma.
Imunološki poremećaji
Disfunkcije imunog sustava zbog genetskih mutacija, stečenih bolesti, starenja ili imunosupresivne terapije remete normalan imuni nadzor ranih novotvorina i povećavaju učestalost zloćudnih neoplazmi. Poznati imunološki poremećaji povezani s nastankom raka jesu: