Prijelaz iz života unutar maternice na život u vanjskom svijetu obuhvaća niz funkcionalnih promjena. Također vidi: Problemi u perinatalnom razdoblju.
Metabolizam neonatalnog bilirubina
(Vidi također Struktura i funkcija jetre i Neonatalna hiperbilirubinemija.)
Stare ili oštećene fetalne eritrocite iz cirkulacije uklanjaju retikuloendotelne stanice, koje pretvaraju hem u bilirubin (1 g Hb daje 35 mg bilirubina). Bilirubin prenose u jetru, gdje ulazi u hepatocite. Glukuronil transferaza potom konjugira bilirubin s uridin difosfoglukuronskom kiselinom (UDPGA) kako bi se stvorio bilirubin glukuronid (konjugirani bilirubin), koji se aktivno izlučuje u žučne kanaliće. Bilirubin diglukuronid ulazi u mekonij u probavnom sustavu, ali se ne može izbaciti iz tijela jer fetus u normalnim okolnostima nema stolicu. Enzim β-glukuronidaza, prisutan u resicama tankog crijeva fetusa, oslobađa se u crijevni lumen, gdje dekonjugira bilirubin glukuronid; slobodni (nekonjugirani) bilirubin zatim se reapsorbira iz probavnog trakta i ponovno ulazi u u fetalnu cirkulaciju. Fetalni bilirubin se eliminira iz cirkulacije fetusa u majčinu plazmu preko posteljice uslijed koncentracijskog gradijenta. Majčina jetra zatim konjugira i izlučuje fetalni bilirubin.
Rođenjem se gubi veza novorođenčeta s posteljicom. Jetra novorođenčeta nastavlja preuzimati, konjugirati i izlučivati bilirubin u žuč kako bi se mogao izbaciti stolicom, međutim, kako novorođenčetu nedostaje odgovarajuća bakterijska flora koja bi u crijevima oksidirala bilirubin u urobilinogen; bilirubin u nepromijenjenom obliku ostaje u stolici i daje joj karakterističnu svijetlo-žutu boju. Osim toga, probavni sustav fetusa i novorođenčeta sadrži β–glukuronidazu, koja dodatno dekonjugira određeni dio bilirubina. Hranjenje dovodi do gastrokoličnog refleksa te se određeni dio bilirubina izlučuje u stolicu prije nego što se uspije dekonjugirati i reapsorbirati. Međutim, u većine novorođenčadi nekonjugirani bilirubin se reapsorbira iz crijevnog lumena u cirkulaciju (enterohepatička cirkulacija bilirubina), doprinoseći fiziološkoj hiperbilirubinemiji i žutici.
Kardiovaskularna funkcija novorođenčeta
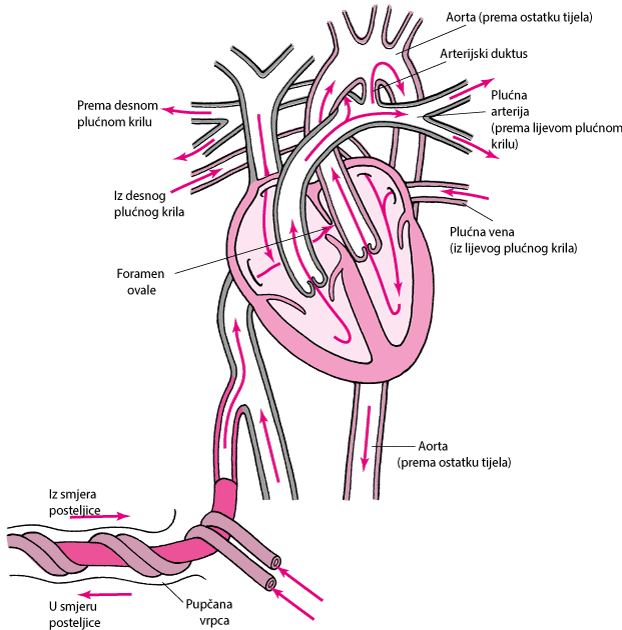
Fetalna cirkulacija je obilježena desno - lijevim pretokom krvi oko neventiliranih pluća kroz otvoreni ductus arteriosus (povezuje pulmonalnu arteriju sa aortom) i ovalni otvor (foreman ovale koji povezuje desni i lijevi atrij). Spomenuti pretoci (šantovi) nastaju uslijed visokog otpora u plućnim arteriolama i relativno niskog otpora u sistemskoj cirkulaciji i posteljici. Oko 90–95% srčanog izbačaja desne klijetke zaobilazi pluća i odlazi u sistemsku cirkulaciju. Duktus arteriosus se u fetusa održava otvorenim uslijed niskog sistemskog PaO2 (~25 mmHg) i lokalne sinteze prostaglandina. Foramen ovale ostaje otvoren zbog razlike u tlakovima između atrija: dok je tlak u lijevom atriju relativno nizak jer se iz pluća vraća mala količina krvi, u desnom atriju tlak je relativno visok zbog velike količine krvi koja se vraća iz posteljice.
Normalna cirkulacija u fetusa
|
U fetusu, krv koja ulazi u desnu stranu srca već je oksigenirana preko posteljice. Budući da pluća nisu ventilirana, samo mala količina krvi mora proći kroz plućnu arteriju. Većina krvi s desne strane srca zaobilazi pluća kroz
-
ovalni otvor
-
arterijski duktus
Obično se ove dvije strukture zatvaraju ubrzo nakon rođenja.
|
 |
Korjenite promjene fetalne cirkulacije nastupaju nakon prvih nekoliko udisaja kada se višestruko povećava protok krvi kroz pluća i funkcionalno zatvara foramen ovale. Otpor u plućnim arteriolama naglo pada zbog vazodilatacije uzrokovane širenjem pluća, povišenjem PaO2 i sniženjem PaCO2. Elastične sile rebara i stijenke prsnog koša smanjuju plućni intersticijski tlak povećavajući još više protok krvi kroz plućne kapilare. Povećan venski priliv iz pluća podiže tlak u lijevoj pretklijetki, čime se smanjuje razlika tlakova između lijeve i desne pretklijetke, što dodatno doprinosi funkcionalnom zatvaranju foramena ovale.
Prilikom uspostavljanja plućnog protoka krvi, povratak venske krvi iz pluća se povećava, povećavajući tlak u lijevoj pretklijetki. Udisanje zraka povećava PaO2 što rezultira konstrikcijom umblilkalnih arterija. Krvni protok kroz posteljicu je smanjen ili prestaje, smanjujući dotok krvi u desnu pretklijetku. Kao rezultat smanjenja tlaka u desnoj i povećanja tlaka u lijevoj pretklijetki dvije fetalne komponente interatrijskog septuma (septum primum i septum secundum) bivaju zajedno potisnuti čime se zaustavlja protok kroz foramen ovale. U većine ljudi spomenute pregrade s vremenom srastu čime se foramen ovale zatvara.
Ubrzo nakon rođenja dolazi do porasta sistemskog otpora koji postaje viši od plućnog, što je upravo obrnuto nego tijekom fetalnog života. Zbog toga se smjer toka krvi kroz duktus arteriosus mijenja, stvarajući lijevo–desni pretok krvi (prijelazna cirkulacija). Ovo stanje traje od nekoliko trenutaka nakon rođenja (kad se povećava protok kroz pluća i zbiva funkcionalno zatvaranje foramena ovale) do oko 24 do 72 h nakon rođenja, kad se duktus arteriosus obično zatvara. Krv koja ulazi u duktus i vasa vasorum aorte ima visoki PO2, te zajedno s promjenama metabolizma prostaglandina, dovodi do konstrikcije i zatvaranja duktus arteriosusa. Zatvaranjem duktus arteriosusa uspostavlja se cirkulacija adultnog tipa. Dvije klijetke usklađeno pumpaju krv a između plućne i sistemske cirkulacije nema značajnih pretoka( šantova).
U prvim danima života novorođenčeta stres može izazvati povratak na fetalni obrazac cirkulacije. Asfiksija s hipoksijom i hiperkapnijom uzrokuje konstrikciju plućnih arteriola i širenje duktus arteriosusa, obrćući proces koji je već opisan i dovodeći do desno–lijevog pretoka kroz sada otvoreni duktus arteriosus, ponovno otvoreni foramen ovale ili oboje. Kao posljedica toga, novorođenče postaje izrazito hipoksično. Opisano stanje naziva se perzistirajućom plućnom hipertenzijom ili perzistentnom fetalnom cirkulacijom. Cilj liječenja usmjeren je na osnovno stanje koje je dovelo do plućne vazokonstrikcije.
Endokrinološka funkcija u novorođenčeta
(Vidi također Pregled endokrinog sustava.)
Fetus u potpunosti ovisi o majci, tj. posteljici što se tiče opskrbe glukozom a sam ne doprinosi stvaranju glukoze. Zalihe glikogena fetus započinje stavrati već u ranom stadiju gestacije, a većinu glikogena nakuplja u drugoj polovici 3. tromjesečja. U novorođenčeta neposredno nakon poroda opskrba glukozom prestaje kada je prerezana pupčana vrpca, poslijedično tome, naglo rastu razine cirkulirajućeg adrenalina, noradrenalina i glukogona uz istovremeni pad razine inzulina. Ove promjene potiču glukoneogenezu i mobilizaciju jetrenih rezervi glikogena.
U zdravog novorođenčeta rođenog na termin razina glukoze je najniža 30 do 90 min. po rođenju, nakon čega je novorođenčad u pravilu u stanju održati normalnu homeostazu glukoze. Dojenčad koja je u najvećoj opasnosti od novorođenačke hipoglikemije je ona sa smanjenim rezervama glikogena (nedostaščad i prijevremeno rođena djeca), teško bolesna djeca s povećanim katabolizmom glukoze te djeca majki sa dijabetesom (radi privremenog hiperinzulinizma).
Hematopoetska funkcija u novorođenčeta
(Vidi također Perinatalna anemija.)
Tijekom trudnoće je stvaranje eritrocita isključivo pod nadzorom fetalnog eritropoetina produciranog u jetri, majčin eritropoetin ne prolazi kroz posteljicu. Fetalni eritrociti sadrže oko 55-90% fetalnog hemoglobina ( hemoglobin F ili hbF) koji ima veliki afinitet vezanja za O2. Kao rezultat toga u posteljici se održava visoki koncentracijski gradijent što omogućava obilni prijenos kisika iz maternalne na fetalnu cirkulaciju. Nakon rođenja visoki afinitet HbF za kisik je od manje koristi, naime HbF brzo otpušta O2 u tkiva što može biti i pogubno u slučaju teške plućne ili srčane bolesti s hipoksemijom.
Prijelaz od fetalnog do adultnog Hb započinje prije rođenja; nakon poroda, mjesto proizvodnje eritropoetina seli se iz jetre u osjetljivije peritubularne stanice bubrega putem nepoznatog mehanizma. Naglo povećanje Pao2 od oko 25 do 30 mm Hg u fetusu do 90 do 95 mm Hg u novorođenčetu odmah nakon poroda uzrokuje pad vrijednosti serumskog eritropoetina, a proizvodnja RBC-a se gasi između rođenja i oko 6. do 8. tjedna, uzrokujući tako fiziološku anemiju terminske novorođenčadi i pridonosi razvoju anemije prematuriteta. Ovo fiziološko smanjenje cirkulirajućih crvenih krvnih stanica stimulira proizvodnju crvenih krvnih stanica u srži i obično ne zahtijeva nikakvo liječenje.
Imunološka funkcija novorođenčeta
vidi Stanične komponente imunološkog sustava i Molekularne komponente imunološkog sustava.
Kod terminskog poroda većina imunoloških mehanizama nije potpuno razvijena, ovaj nepotpuni razvoj je naglašeniji što je gestacijska dob kod poroda kraća. Stoga su sva novorođenčad i mala djeca relativno imunodeficijentna u odnosu na odrasle te s povećanim rizikom za razvoj infekcija. Rizik se povećava s prijevremenim rođenjem, bolešću majke, novorođenačkim stresom i primjenom lijekova (npr. imunosupresiva i antikonvulziva). Oslabljenim imunološkim odgovorom novorođenčeta može se objasniti nedostatak znakova upale (npr. vrućice ili meningizma) u slučaju infekcije.
U fetusa su za upalni odgovor kojim se suzbijaju bakterijske i gljivične infekcije ključni fagociti koji postoje u stadiju razvoja žumanjčane vreće. Granulociti se mogu identificirati u 2.mjesecu trudnoće, a monociti u četvrtom. Njihova funkcija se pojačava sa gestacijskom dobi ali je i dalje niska u djece rođene na termin.
U vrijeme rođenja, ultrastruktura neutrofila je normalna, no u većine novorođenčadi je kemotaksija neutrofila i monocita usporena zbog unutarnjeg poremećaja pokretljivosti stanica i prianjanja za površine. Ovi su funkcionalni nedostaci izraženiji u prijevremeno rođene djece.
Oko četrnaestog tjedna trudnoće timus postaje funkcionalan te se u njemu gomilaju limfociti proizašli iz matičnih hemopoetskih stanica kako bi se dalje diferencirali. T limfociti nalaze u fetalnoj jetri i slezeni, ukazujući na to kako se u ovoj dobi zreli T limfociti razvijaju u sekundarnim perifenim limfatičnim organima. Timus je najaktivniji tijekom fetalnog razvoja i ubrzo nakon rođenja. On tijekom života in utero brzo raste i jasno je uočljiv na RTG slikama prsnog koša u zdravog novorođenčeta, dosežući vrhunac razvoja s 10 god., nakon čega postupno involuira kroz više godina.
Broj T limfocita u fetalnoj cirkulaciji se postupno povećava tijekom 2. tromjesečja, dosežući normalne vrijednosti sa 30 do 32 tjedana gestacije. U vrijeme rođenja, novorođenče, u usporedbi s odraslom osobom, ima relativnu T limfocitozu. Međutim, novorođenački T limfociti nisu tako učinkoviti kao T limfociti odrasle osobe. Primjerice, novorođenački T limfociti nisu nužno sposobni na odgovarajući način reagirati na antigene i stvarati citokine.
B limfociti se nalaze u fetalnoj koštanoj srži, krvi, jetri i slezeni oko 12. tj. gestacije. Oko 20 tjedna gestacija mogu se detektirati tragovi IgG i IgM, a oko 30og tjedna tragovi IgA; obzirom se fetus razvija u sredini bez antigena, tek se minimalna količina imunoglobulina prodcira in utero. Povišene razine IgM–a u serumu iz pupkovine ukazuju na antigensku stimulaciju in utero, obično uslijed prirođene infekcije. Skoro cjelokupni IgG je majčinog porijekla, a dolazi putem posteljice. Nakon 22 tj. gestacije, prijelaz IgG–a kroz posteljicu se povećava, da bi u vrijeme termina razine dosegle one u majke ili veće. U prijevremeno rođene djece razine IgG–a u vrijeme rođenja su smanjene i obrnuto prporcionalne gestacijskoj dobi.
Transplacentarni pasivni prijenos majčinog imuniteta pomoću IgG te sekretorni IgA i antimikrobni čimbenici u majčinom mlijeku (npr. IgG, sekretorni IgA, leukociti, bjelančevine komplementa, lizozim i laktoferin) nadomještaju nezreli imunološki sustav novorođenčeta i omogućuju otpornost na mnoge bakterije i viruse. Zaštitni imunološki čimbenici u majčinom mlijeku oblažu probavni i dišni sustav pomoću sa sluznicom povezanog limfatičnog tkiva i sprječavaju naseljavanje sluznica dišnim i crijevnim patogenima.
S vremenom pasivna imunost iščezava, a najmanja je sa 3 do 6 mj. Nedonoščad mogu razviti izrazitu hipogamaglobulinemiju u prvih 6 mjeseci života. Do 1. god., razina IgG–a raste na oko 60% prosječne vrijednosti u odrasle osobe. Razine IgA, IgM, IgD i IgE, koji ne prolaze kroz posteljicu, te se stoga u vrijeme rođenja mogu otkriti tek u tragovima, se tijekom djetinjstva polako povećavaju. IgG, IgM i IgA dosežu vrijednost kao u odrasle osobe s dobi od oko 10 god.
Iako odgovor protutijela na početne doze cjepiva može biti niži u nedonoščadi nego u terminske dojenčadi, prerano rođena dojenčad još uvijek mogu postići zaštitni odgovor na većinu cjepiva i trebala bi biti cijepljena po istom kalendaru kao donošena djeca. Međutim, dojenčad koja imaju < 2 kg kada prime prvu dozu cjepivo protiv hepatitisa B trebaju primiti 3 dodatne doze ako se prva doza daje kada su mlađi od 1 mjeseca (jer imaju smanjeni odgovor protutijela; 1).
Referenca neonatalne imunološke funkcije
-
1. Gagneur A, Pinquier D, Quach C: Immunization of preterm infants. Hum Vaccin Immunother 11(11):2556–2563, 2015. doi: 10.1080/21645515.2015.1074358.
Plućna funkcija novorođenčeta
Fetalni razvoj pluća napreduje kroz faze organogeneze i diferencijacije. Sa oko 25 tjedana gestacije u plućima su prisutne donekle razvijene alveole i tip II pneumociti koji produciraju surfaktant te nastavljaju maturaciju tijekom trudnoće. Pluća neprekidno produciraju tekućinu, transudat iz plućnih kapilara, uz surfaktant koji izlučuju pneumociti tipa II. Da bi se uspostavila normalna izmjena plinova po rođenju, plućna alveolarna i intersticijska tekućina se mora na odgovarajući način izbaciti, pritiskom na prsni koš čeda tijekom poroda i apsorpcijom tekućine u stanice pluća aktivacijom natrijevih kanala. Ovaj proces čišćenja događa se prvenstveno apsorpcijom tekućine u stanice u plućima putem aktivacije epitelnih natrijevih kanala. Kompresija prsnog koša fetusa tijekom poroda malo doprinosi čišćenju plućne tekućine (1). Prolazna tahipneja novorođenčeta je vjerojatno uzrokovana odgodom procesa klirensa tekućine.
U vrijeme poroda, uslijed elasticiteta rebara i snažnim udasima novorođenčeta zrak ulazi u bronhalno stablo te se u alveolima uspostavlja granica između zraka i tekućine. Tijekom prvih udaha surfaktant se otpušta na aerolikvidnu površinu. Surfaktant je mješavina fosfolipida (fosfatidilkolin, fosfatidilglicerol, fosfatidilinozitol), neutralnih lipida i 3 površinski aktivne bjelančevine. Pohranjen je u lamelarnim inkluzijama pneumocita tipa II. Smanjuje površinsku napetost, koja bi u suprotnom dovela do atelektaze i povećala rad i napor pri disanju. Surfaktant radi učinkovitije u manjim alveolama koje imaju veću tendenciju ka kolapsu, za razliku od većih alveola gdje je sila kolapsa manja (Laplacov zakon koji navodi da se u elastičnoj šupljini, tlak smanjuje kad se volumen povećava).
Prije 34 do 35 tjedana gestacije, surfaktant se često ne stvara u dovoljnim količinama kako bi spriječio atelektaze, te se razvija sindrom respiratornog distresa. Proizvodnja i funkciju surfaktanta može biti snižena u stanjma kao što su majčin dijabetes, sindrom aspiracije mekonija i neonatalna sepsa. Neonatalna produkcija surfaktanta u nedonoščeta može se pospiješiti davanjem kortikosteroida majci 24 do 48 sati prije poroda. Intratrahealni surfaktant se također može dati novorođenčadi nakon poroda.
Plućna funkcija novorođenčeta
-
1. Ramachandrappa A, Jain L: Elective cesarean section: Its impact on neonatal respiratory outcome. Clin Perinatol 35(2):373–393, vii, 2008. doi: 10.1016/j.clp.2008.03.006.
Bubrežna funkcija novorođenčeta
U vrijeme rođenja, bubrežna je funkcija općenito smanjena, osobito u prijevremeno rođene djece. GFR se progresivno povećava tijekom gestacije, osobito tijekom 3. tromjesječja. Iako se GFR naglo povećava u prvim mjesecima života, GFR, klirens ureje, i maksimalni tubularni klirens ne dostižu razine odraslih do dobi od 1 do 2 god.