RAK MOKRAĆNOG MJEHURA
INCIDENCIJA I EPIDEMIOLOGIJA
Godišnja incidencija u SAD-u je oko 74.000 slučajeva s 16.000 smrtnih ishoda. Srednja dob oboljelih je 65 god. Pušenju se pripisuje oko 50% rizika. Izloženost policikličnim aromatskim ugljikovodicima povećava rizik, osobito u sporih acetilatora. Rizik je povišen kod dimnjačara, kao i onih koji rabe sredstva za suho čišćenje ili sudjeluju u proizvodnji aluminija. Kronična izloženost ciklofosfamidu povećava rizik 9 puta. Infekcija sa Schistosoma haematobium također povećava rizik, osobito za planocelularni tip.
ETIOLOGIJA
Lezije koje pogađaju kromosom 9q nastaju rano. Delecije na 17p (p53), 18q (lokus DCC), 13q (RB), 3p i 5q su karakteristične za invazivne lezije. Česta je prekomjerna ekspresija receptora za faktor epidermalnog rasta i HER-2/neu receptora.
PATOLOGIJA
Preko 90% tumora potječe od prijelaznog epitela; 3% otpada na planocelularni, 2% na adenokarcinome, a <1% na neuroendokrine tumore malih stanica. Promjene se opažaju na mjestima koja okružuju rizični prijelazni epitel uključujući bubrežnu nakapnicu, ureter, mjehur i proksimalne 2/3 uretre. Oko 90% tumora raste u mjehuru, 8% u bubrežnoj nakapnici, a 2% u ureteru i uretri. Histološki stupanj utječe na preživljenje. Pojava recidiva ovisi o veličini, broju i načinu rasta primarnog tumora.
KLINIČKA SLIKA
Hematurija je početni simptom u 80–90%; međutim, cistitis je češći uzrok hematurije (22% svih hematurija) negoli karcinom mjehura (15%). U početku se stadij bolesti određuje endoskopski, a tako se provodi i liječenje. Površinski smješteni tumori odstranjuju se endoskopski; prodor u mišić zahtijeva opsežniju operaciju.
LIJEČENJE RAK MOKRAĆNOG MJEHURA
Liječenje se zasniva na proširenosti bolesti: površinska, invazivna ili metastatska. Učestalost iskazivanja je 75% za površinski, 20% za invazivni i 5% za metastatski. Površinske lezije se odstranjuju endoskopski. Premda je potpuna resekcija moguća u 80%, u 30–80% slučajeva dolazi do recidiva; do progresije u veći stupanj i stadij dolazi u 30%. Uštrcavanje Calmette-Guérinova bacila (BCG) u mokraćni mjehur smanjuje rizik recidiva za 40–45%. Recidiv se kontrolira svaka 3 mjeseca.
Standardna terapija bolesti s prodorom u mišićni sloj je radikalna cistektomija. Petogodišnje preživljenje je 70% za one bez prodora u perivezikularno masno tkivo ili limfne čvorove, 50% za one s prodorom u masno tkivo ali ne u limfne čvorove, 35% za one sa zahvaćenim jednim limfnim čvorom, a 10% za one sa šest ili više zahvaćenih limfnih čvorova. Bolesnici koji ne mogu podnijeti radikalnu operaciju imaju 30–35% 5-godišnje preživljenje nakon vanjske radioterapije s 5000–7000 cGy. Mjehur je moguće sačuvati u do 45% bolesnika primjenom dva ciklusa kemoterapije prema CMV protokolu (metotreksat 30 mg/m2 1. i 8. dan, vinblastin 4 mg/m2 1. i 8. dan, cisplatina 100 mg/m2 2. dan, svakih 21 dan), a zatim zračenjem s 4000 cGy uz istodobnu primjenu cisplatine.
Metastatska bolest se liječi polikemoterapijom, bilo CMV (vidi gore) ili M-VAC protokolom (metotreksat 30 mg/m2 1., 15. i 22. dan; vinblastin 3 mg/m2 2., 15. i 22. dan; doksorubicin 30 mg/m2 2. dan; cisplatina 70 mg/m2 2. dan; svakih 28 dana), ili se daje cisplatina (70 mg/m2 2. dan) plus gemcitabin (1000 mg/m2 1., 8. i 15. dan 28-dnevnog ciklusa) ili karboplatina plus paklitaksel. Oko 70% bolesnika odgovori na liječenje, a 20% ima potpuni odgovor; u 10–15% postigne se dugotrajno preživljenje bez znakova bolesti.
RAK BUBREGA
INCIDENCIJA I EPIDEMIOLOGIJA
Godišnja učestalost u SAD-u je oko 62.000 slučajeva s 14.000 smrtnih ishoda. Pušenje cigareta se povezuje s 20–30% slučajeva. Rizik je povišen kod stečene cistične bolesti bubrega. Postoje dva obiteljska oblika: rijetki autosomno dominantni sindrom i von Hippel–Lindauova bolest. Oko 35% oboljelih od von Hippel-Lindauove bolesti dobije rak bubrega. Incidencija je također povećana kod tuberozne skleroze i policističnih bubrega.
ETIOLOGIJA
Većina je slučajeva sporadična. Međutim, najčešća kromosomska abnormalnost (javlja se u 60%) je delecija ili preraspodjela 3p21-26. Gen za von Hippel-Lindau je mapiran u toj regiji i izgleda djeluje na ubikvitin ligazu koja utječe na regulaciju brzine transkripcije i sudjeluje u obradi oštećenih bjelančevina. Nejasno je kako lezije gena dovode do razvoja karcinoma.
PATOLOGIJA
Poznato je pet varijanti: tumori jasnih stanica (75%), kromofilni tumori (15%), kromofobni tumori (5%), onkocitni tumori (3%) i tumori sabirnog kanala (2%). Tumori jasnih stanica nastaju iz stanica proksimalnih zavijenih tubula. Papilarni tumori obično su bilateralni i multifokalni i često pokazuju trisomiju 7 i/ili trisomiju 17. Kromofobni i eozinofilni tumori rjeđe imaju kromosomske aberacije i sporijeg su tijeka.
KLINIČKA SLIKA
Klasični trijas—hematurija, bol u slabinama i tvorba u slabinama—viđa se samo u 10–20% bolesnika; najčešći individualni simptomi su: hematurija (40%), bol u slabinama (40%), palpabilna tvorba (33%) i gubitak na težini (33%). Mogu se pojaviti i paraneoplastični sindromi, npr. sindromi eritrocitoze (3%), hiperkalcijemije (5%) i nemetastatske jetrene disfunkcije (Staufferov sindrom) (15%). Obrada mora uključiti IV urografiju, ultrazvuk bubrega, CT trbuha i zdjelice, RTG prsnog koša, analizu urina i citološki pregled mokraće. U stadiju I bolest je ograničena samo na bubreg, u stadiju II bolest je unutar Gerotaove fascije, u stadiju III tumor je lokalno invazivan i zahvaća čvorove i/ili donju šuplju venu, a u stadiju IV dolazi do prodora u susjedne organe ili do razvoja udaljenih metastaza. Prognoza ovisi o stadiju: 5-godišnje preživljenje za stadij I iznosi 66%, za II 64%, za III 42% i za IV stadij 11%.
LIJEČENJE RAK BUBREGA
Radikalna nefrektomija je standard za stadij I, II i većinu bolesnika u stadiju III. Operacija može biti indicirana i u slučaju metastatske bolesti ako su lokalni simptomi nepodnošljivi (krvarenje, bol). Stopa terapijskog odgovora od 40–48% postignuta je s pet različitih monoterapija, sunitinib (50 mg/dan 4 tjedna od 6), sorafenib (400 mg 2× na dan) i temsirolimus (25 mg IV tjedno) i srodni lijek, everolimus (10 mg PO dnevno), inhibitor PD1, nivolumab i kabozantinib (60 mg PO dnevno), inhibitor MET, AXL i receptora rasta vaskularnog endotela (VEGFR). Za sunitinib i sorafenib misli se da su antiangiogeni zbog inhibicije kinaza u tumorskim stanicama. Temsirolimus je inhibitor mTOR. Nivolumab omogućuje aktiviranje T-stanica koje ubijaju tumorske stanice. U oko 10–15% pacijenata s uznapredovalim stadijem bolesti od pomoći mogu biti interleukin 2 i/ili intrferon α (IFN-α). Dodavanje bevacizumaba uz IFN-α poboljšava stopu odgovora. Neke su remisije trajne. Kemoterapija je od male ili nikakve koristi.
RAK TESTISA
INCIDENCIJA I EPIDEMIOLOGIJA
Godišnja incidencija iznosi oko 8430 slučajeva s 380 smrtnih ishoda. Incidencija je najveća od 20–40 god. Javlja se 4–5 puta češće u bijelaca nego crnaca. Rizik je povišen kod kriptorhidnih testisa. Rana orhiopeksija može spriječiti razvoj raka testisa. Rizik je povišen i kod sindroma testikularne feminizacije, a Klinefelterov sindrom je povezan s tumorom zametnih stanica medijastinuma.
ETIOLOGIJA
Uzrok je nepoznat. Bolest je povezana s karakterističnim citogenetskim defektom, izokromosomom 12p.
PATOLOGIJA
Postoje dvije glavne podvrste: seminom i neseminom. Na svaku podvrstu otpada ~50% slučajeva. Seminom ima sporiji tijek i jako je osjetljiv na radioterapiju. Definirane su četiri podvrste neseminoma: embrionalni karcinom, teratom, koriokarcinom i tumor endodermalnog sinusa (žumanjčane vreće).
KLINIČKA SLIKA
Bezbolna tvorba testisa je klasičan prvi znak. Ako postoji bol, tada diferencijalno dijagnostički u obzir dolazi epididimitis ili orhitis; može se pokušati liječiti kratkotrajnom antibiotskom terapijom. Određivanje stupnja bolesti (proširenosti) uključuje mjerenje tumorskih markera (biljega) α-fetoproteina (AFP) i β-humanog korionskog gonadotropina (hCG) u serumu, RTG prsnog koša, te CT trbuha i zdjelice. Stupanj bolesti prema proširenosti u limfne čvorove određuje se prilikom operacije primarnog tumora kroz ingvinalni kanal. Stadij I bolesti je ograničen na testis, epididimis ili sjemenovod; stadij II zahvaća retroperitonealne limfne čvorove; a bolest u stadiju III proširena je izvan retroperitoneuma. Među oboljelima od seminoma 70% je u stadiju I, 20% u stadiju II i 10% u stadiju III. Među bolesnicima sa neseminomskim tumorom zametnih stanica po 33% otpada na svaki od stadija. hCG može biti povišen bilo kod seminoma ili neseminoma, dok je AFP povišen samo kod neseminoma. Oko 95% bolesnika se izliječi ako se provede primjerena terapija. Primarni neseminom u medijastinumu je udružen s akutnom leukemijom ili drugim hematološkim bolestima i ima lošiju prognozu od primarnih tumora testisa (~33%).
LIJEČENJE RAK TESTISA (SLIKA 72-1)
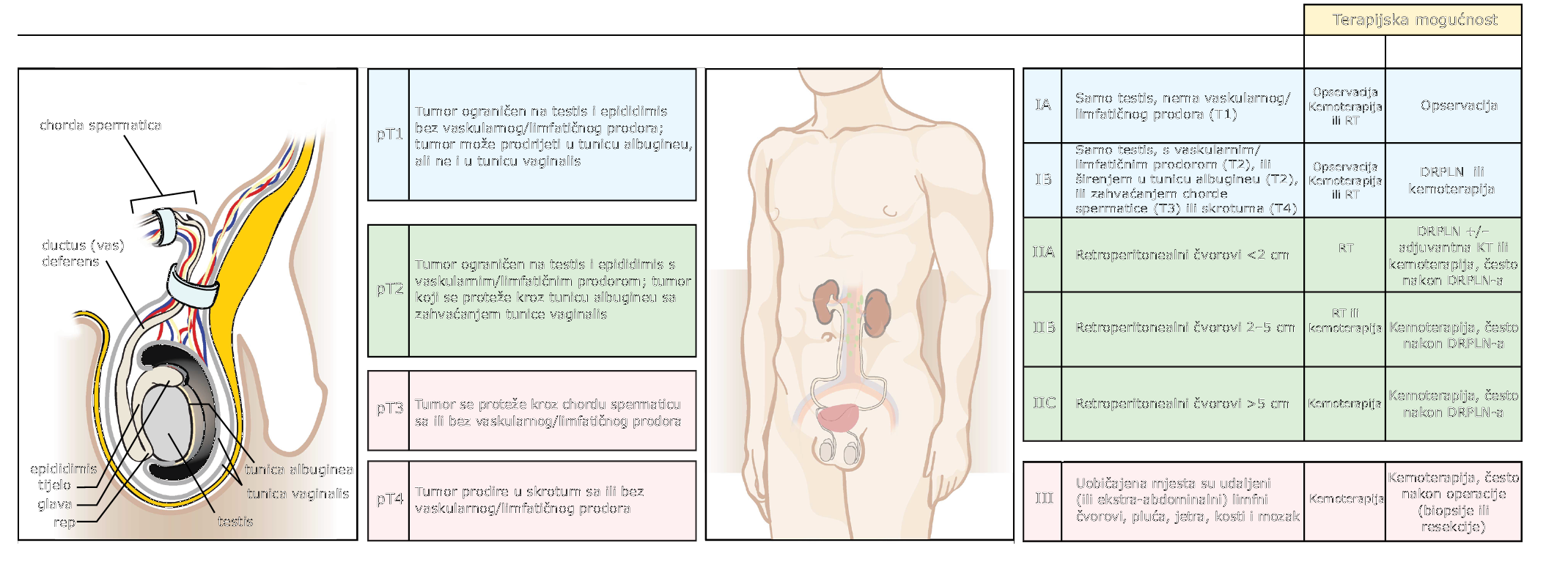
SLIKA 72-1 Određivanje stadija (proširenosti) i liječenje tumora zametnih stanica. DRPLN = disekcija retroperitonealnih limfnih čvorova; RT = radioterapija.
Seminom u stadiju I i II učinkovito se liječi ingvinalnom orhiektomijom nakon koje slijedi retroperitonealna radioterapija (2500–3000 cGy). Za neseminom stadija I i II učinkovita je ingvinalna orhiektomija sa disekcijom retroperitonealnih limfnih čvorova. Bolesnicima koji imaju ili jedan ili drugi histološki tip s jako uvećanim čvorovima ili stadij III bolesti, daje se kemoterapija. Standardnu terapiju čine 4 ciklusa cisplatine (20 mg/m2 1.–5. dana), etopozida (100 mg/m2 1.–5. dana) i bleomicina (30 mg/m2 2., 9., 16. dan) svakih 21 dan. Ako se tumorski markeri vrate na 0, rezidualne se tvorbe reseciraju. Uglavnom se radi o nekrotičnim tvorbama ili teratomima. Terapija spašavanja je predviđena za onih 25% koji nisu izliječeni primarnom terapijom.
Opširnije vidi u Scher HI, Rosenberg JE, Motzer RJ: Bladder and Renal Cell Carcinomas, pogl. 114, str. 575; i Motzer RJ, Fedlman DR, Bosl GJ: Testicular Cancer, pogl. 116, str. 588, u HPIM-19.