INCIDENCIJA I EPIDEMIOLOGIJA
Najčešći tumor u žena. U SAD-u je 2015. godine dijagnosticirano 234.190 slučajeva, a 40.730 žena je umrlo od raka dojke. Muškarci također obolijevaju od raka dojke, ali je omjer Ž:M 150:1. Rak dojke je ovisan o hormonima. Žene koje su kasno dobile prvu menstruaciju, one s ranom menopauzom i prvom trudnoćom do 18 godina imaju značajno manji rizik. Prosječna Amerikanka ima rizik oko 1 prema 9 da će tijekom života dobiti rak dojke. Masnoće u prehrani su sporan faktor rizika. Oralni kontraceptivi imaju mali ili nikakav učinak na rizik, ali smanjuju rizik od raka endometrija i jajnika. Namjeran prekid trudnoće ne povećava rizik. Nadomjesna terapija estrogenima može neznatno povećati rizik, ali blagotvorni učinci estrogena na kvalitetu života, mineralnu gustoću kostiju i smanjenje rizika od kolorektalnog karcinoma izgleda nadilazi porast broja kardiovaskularnih bolesti i tromboza. Žene koje su bile liječene radioterapijom prije 30. godine života imaju povećani rizik. Rizik od raka dojke povećava se kada su tu bolest imale i sestra i majka.
GENETIKA
Vjerojatno je 8–10% slučajeva raka dojke naslijeđeno obiteljski. Mutacije BRCA-1 čine oko 5%. BRCA-1 se nalazi na kromosomu 17q21 i čini se da sudjeluje u popravku DNK posredstvom transkripcije. U žena Ashkenazi židova šansa da imaju zajedničku mutaciju (gubitak adenina i gvanina na poziciji 185) iznosi 1%. Sindrom BRCA-1 uključuje povećani rizik od raka jajnika kod žena i raka prostate u muškaraca. BRCA-2 na kromosomu 11 može objasniti 2–3% karcinoma dojke. Mutacije su povezane s povećanim rizikom od raka dojke kod muškaraca i žena. Mutacije zametnih stanica na p53 (Li-Fraumenijev sindrom) vrlo su rijetke, no takve su obitelji sklone pojavi raka dojke, sarkoma i drugih malignoma. Mutacije zametnih stanica na PALB2, hCHK2 i PTEN mogu objasniti neke obiteljske karcinome dojke. Sporadični karcinomi dojke pokazuju mnoge genetske promjene, uključujući prekomjernu ekspresiju HER-2/neu u 25% slučajeva, mutacije na p53 u 40%, te gubitak heterozigotnosti na drugim mjestima (lokusima).
DIJAGNOZA
Rak dojke obično se dijagnosticira biopsijom čvora otkrivenog mamografijom ili palpacijom. Ženama treba naglašavati važnost mjesečnog samopregleda dojki. Žene koje nisu u menopauzi (u premenopauzi), a imaju sumnjivu tvorbu ili tvorbu benignog izgleda (malu) treba ponovno pregledati za 2–4 tjedna (Sl. 70-1). Tvorbu u premenopauzalnih žena koja postoji za vrijeme ciklusa i svaku tvorbu kod žena u postmenopauzi treba aspirirati. Ako je tvorba cista ispunjena tekućinom koja nije krvava i koja nakon aspiracije nestaje, pacijentica se vraća rutinskom probiru. Ako se nakon aspiracije ciste tvorba smanji ali u potpunosti ne iščezne ili je tekućina krvava, pacijenticu treba uputiti na mamografiju i ekscizijsku biopsiju. Ako je tvorba solidna, pacijenticu treba podvrgnuti mamografiji i ekscizijskoj biopsiji. Pokazalo se da probirna mamografija koja se vrši svake druge godine počevši od 50. godine spašava živote. Dvojbe u pogledu probirne mamografije počevši od 40. godine života odnose se na sljedeće činjenice: (1.) bolest je mnogo rjeđa u dobnoj skupini od 40 do 49 godina, a probir je u pravilu manje uspješan za rjeđe probleme; (2.) mamografske promjene koje se nađu u dobi od 40. do 49. godine rjeđe su karcinom; i (3.) oko 50% žena u 40-tim godinama koje jednom godišnje vrše preventivni pregled jednom ima patološki nalaz koji zahtijeva dijagnostičku obradu (obično biopsiju), pa ipak vrlo je mali broj otkrivenih karcinoma. Međutim, mnogi vjeruju u vrijednost mamogarfije kao probirne pretrage počevši u dobi od 40 godina. Nakon 13–15 godina praćenja, žene koje su s preventivnim pregledima započele u dobi od 40 godina imaju malu korist što se tiče preživljenja. Žene s pozitivnom obiteljskom anamnezom raka dojke češće imaju lažno negativan mamografski nalaz. Za te je žene MR bolja probirna pretraga. Za žene s bujnim dojkama (>50% fibroglandularnog tkiva) se kaže da su pod povećanim rizikom (1,2 do 2 puta), ali nije jasno da li zahtijevaju pojačani nadzor.
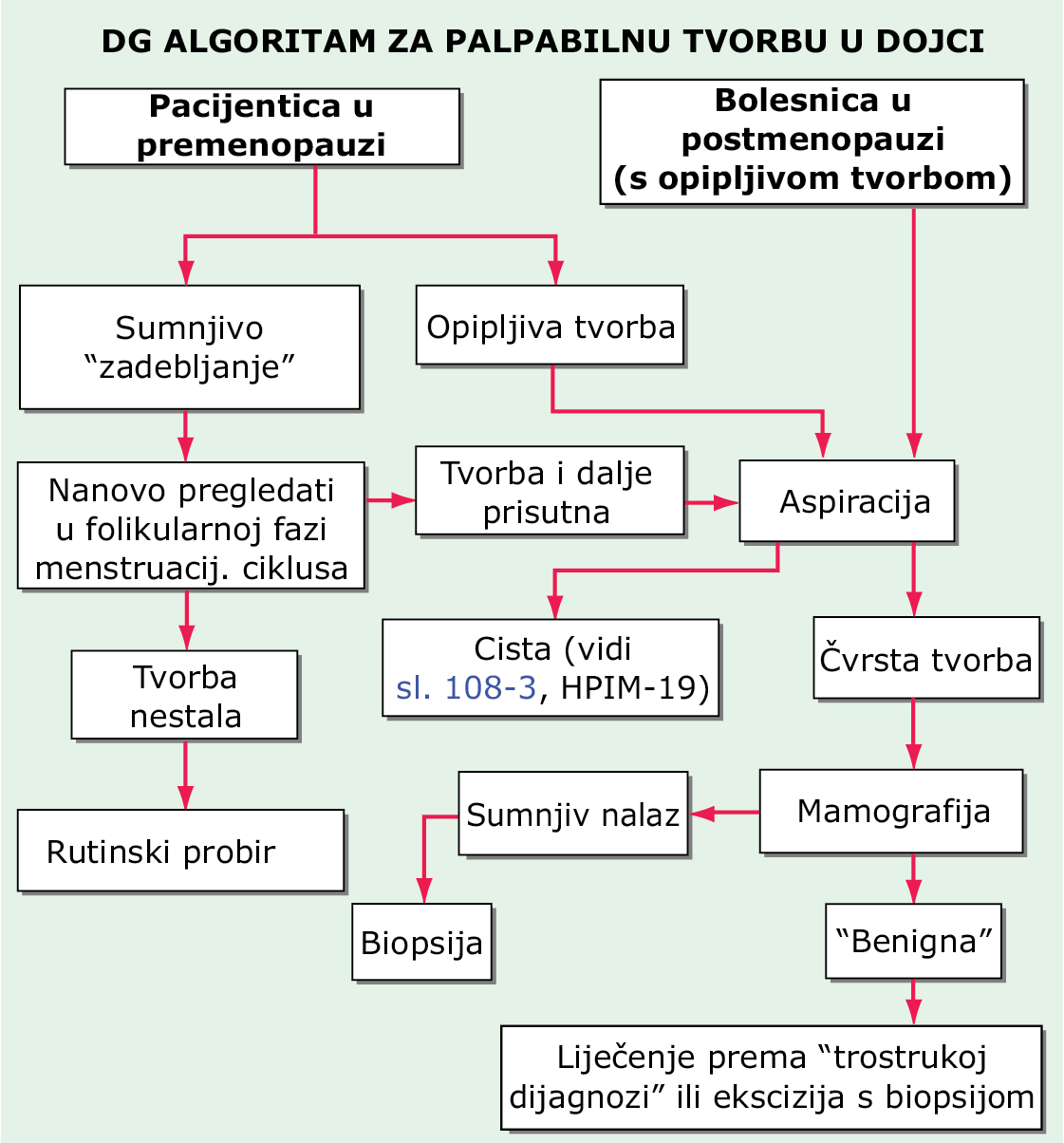
SLIKA 70-1 Dijagnostički pristup palpabilnoj tvorbi u dojci.
KLINIČKO I MOLEKULARNO ODREĐIVANJE STADIJA BOLESTI
Terapija i prognoza ovise o stadiju bolesti (Tbl 70-1). Stupnjevanje ipsilateralne aksile vrši se u vrijeme mastektomije (vidi niže), osim ako tumor dojke nije velik ili fiksiran za torakalni zid. Kod bolesnica unutar određenog stadija na prognozu utječu individualne odlike tumora: ekspresija estrogenih receptora poboljšava prognozu, dok prekomjerna ekspresija HER-2/neu, mutacije u p53, visoka frakcija rasta i aneuploidija pogoršavaju prognozu. Molekularno profiliranje identificiralo je genski različite podskupine uključujući luminalne tumore tipa A i B (pozitivni estrogenski receptor), normalne slične dojki, HER2-pozitivne i bazalne (ili trostruko negativne bez ekspresije hormonskih receptora ili s prekomjernom ekspresijom HER2). Navedene podskupine razlikuju se s obzirom na prognozu. Rak dojke može se proširiti bilo gdje, ali najčešće ide u kosti, pluća, jetru, meka tkiva i mozak.
TABLICA 70-1 ODREĐIVANJE STADIJA RAKA DOJKE
|
|
Primarni tumor (T)
|
|
T0
|
Nema dokaza za primarni tumor
|
|
Tis (DCIS)
|
Karcinom in situ
|
|
Tis (Paget)
|
Pagetova bolest bradavice nepovezana s invazivnim karcinomom i/ili DCIS u podležećem parenhimu
|
|
T1
|
Tumor ≤20 mm u najvećem promjeru
|
|
T1mi
|
Tumor ≤1 mm u najvećem promjeru
|
|
T1a
|
Tumor >1 mm, ali ≤5 mm u najvećem promjeru
|
|
T1b
|
Tumor >5 mm, ali ≤10 mm u najvećem promjeru
|
|
T1c
|
Tumor >10 mm, ali ≤20 mm u najvećem promjeru
|
|
T2
|
Tumor >20 mm, ali ≤50 mm u najvećem promjeru
|
|
T3
|
Tumor >50 mm u najvećem promjeru
|
|
T4
|
Tumor bilo koje veličine s izravnim prodorom u stijenku prsnog koša i/ili kožu (ulceracije ili makroskopski čvorovi na koži)
|
|
T4a
|
Širenje tumora na stijenku prsnog koša; invazija ili adherencija pektoralnog mišića bez prodora u strukture stijenke prsnog koša ne kvalificira se kao T4
|
|
T4b
|
Ulceracija ili ipsilateralni makroskopski satelitski čvor i/ili edem kože (uključujući “kožu poput narančine kore”), koji ne uključuje kriterije inflamiranog karcinoma
|
|
T4c
|
Zadovoljeni kriteriji T4a + T4b
|
|
T4d
|
Inflamirani karcinom
|
|
Regionalni limfni čvorovi (N)
|
|
Nx
|
Ne može se procijeniti (nije uzet uzorak za PHD analizu)
|
|
N0
|
Nema histološki dokazanih metastaza u regionalnim limfnim čvorovima ni izoliranih tumorskih stanica (ITS)
|
|
N0(i+)
|
Samo ITS (nakupine malignih stanica ne veće od 0,2 mm) u regionalnim limfnim čvorovima
|
|
N0(mol+)
|
Pozitivan nalaz RT-PCR-om; nije se detektiralo ITS
|
|
N1mi
|
Mikrometastaze (>0,2 mm, ali ≤2,0 mm)
|
|
N1a
|
Metastaze u 1 do 3 aksilarna limfna čvora, najmanje 1 metastaza >2,0 mm
|
|
N1b
|
Metastaza u ipsilateralne interne mamarne limfne čvorove čuvare, isključujući ITS
|
|
N1c
|
N1a i N1b
|
|
N2a
|
Metastaza u 4–9 aksilarnih limfnih čvorova (najmanje 1 tumorski depozit >2,0 mm)
|
|
N2b
|
Metastaze klinički detektirane u internim mamarnim limfnim čvorovima, sa ili bez mikroskopske potvrde; s patološki negativnim aksilarnim limfnim čvorovima
|
|
N3a
|
Metastaza u 10 ili više aksilarnih limfnih čvorova (najmanje 1 tumorski depozit >2,0 mm) ili metastaza u infraklavikularne limfne čvorove (razina III aksilarnih limfnih čvorova)
|
|
N3b
|
N1a ili N2a u prisutnosti N2b (slikovnim metodama pozitivni interni mamarni limfni čvorovi); ili N2a uz N1b
|
|
N3c
|
Metastaze u ipsilateralne supraklavikularne limfne čvorove
|
|
Udaljene metastaze (M)
|
|
M0(i+)
|
Bez kliničkog ili radiološkog dokaza o postojanju metastaze, uz nalaz depozita tumorskih stanica <0,2 mm dokazanog mikroskopski ili molekularnim metodama
|
|
M1
|
Metastaza dokazana klinički ili slikovnim metodama i/ili histološki dokazana metastaza >0,2 mm
|
|
Stadiji raka dojke
|
|
Stadij 0
|
TIS
|
N0
|
M0
|
|
Stadij IA
|
T1
|
N0
|
M0
|
|
Stadij IB
|
T0
|
N1mi
|
M0
|
| |
T1
|
N1mi
|
M0
|
|
Stadij IIA
|
T0
|
N1
|
M0
|
| |
T1
|
N1
|
M0
|
| |
T2
|
N0
|
M0
|
|
Stadij IIB
|
T2
|
N1
|
M0
|
| |
T3
|
N0
|
M0
|
|
Stadij IIIA
|
T0
|
N2
|
M0
|
| |
T1
|
N2
|
M0
|
| |
T2
|
N2
|
M0
|
| |
T3
|
N1, N2
|
M0
|
|
Stadij IIIB
|
T4
|
N0, N1, N2
|
M0
|
|
Stadij IIIC
|
Bilo koji T
|
N3
|
M0
|
|
Stadij IV
|
Bilo koji T
|
Bilo koji N
|
M1
|
|
aKlinički vidljiv po definiciji je onda kada se otkrije slikovnim pretragama (isključujući limfoscintigrafiju) ili kliničkim pregledom.
Kratice: IHK = imunohistokemija; RT-PCR = test reverzne transkriptaze-lančane reakcije polimeraze (engl. reverse transcriptase/polymerase chain reaction).
Izvor: Koristi se uz dopuštenje American Joint Committee on Cancer (AJCC), Chicago, Illinois. Originalni izvor za ovaj materijal je AJCC Cancer Staging Manual, 7. izd. New York, Springer, 2010; www.springeronline.com.
|
LIJEČENJE RAK DOJKE
Postotak petogodišnjeg preživljenja za pojedine stadije prikazuje Tbl. 70-2. Način liječenja ovisi o stadiju bolesti i ekspresiji hormonskih receptora i HER2.
TABLICA 70-2 PETOGODIŠNJE PREŽIVLJENJE OD RAKA DOJKE PREMA STADIJU BOLESTI
|
|
Stadij
|
5-godišnje preživljenje (% bolesnica)
|
|
0
|
99
|
|
I
|
92
|
|
IIA
|
82
|
|
IIB
|
65
|
|
IIIA
|
47
|
|
IIIB
|
44
|
|
IV
|
14
|
|
Izvor: Iz podataka Nacionalnog instituta za rak—nadzor, epidemiologiju i konačni rezultati (SEER).
|
Duktalni karcinom in situ je neinvazivni tumor koji se nalazi u duktusima dojke. Terapija izbora je opsežna ekscizija s radioterapijom dojke. Jedna je studija pokazala da se dodavanjem tamoksifena još više smanjuje rizik od recidiva.
Invazivni rak dojke može se klasificirati kao operabilan, lokalno uznapredovali i metastatski. Kod operabilnog karcinoma dojke ishod primarne terapije je isti bilo da se primjeni modficirana radikalna mastektomija ili lumpektomija (kvadrantektomija ili segmentoktomija) s radioterapijom. U cilju procjene zahvaćenosti limfnih čvorova prije resekcije aksilarnih limfnih čvorova može se uraditi biopsija stražarskog čvora. Stražarski čvor se identificira prilikom operacije uštrcavanjem boje (kontrasta) u tumor; prvi čvor u kojem se boja pojavi je stražarski čvor. Ženama s tumorima <1 cm i negativnim aksilarnim limfnim čvorovima nije potrebna dodatna terapija nakon primarne lumpektomije i radioterapije dojke. Adjuvantna polikemoterapija u trajanju od 6 mjeseci čini se da pomaže ženama u premenopauzi s pozitivnim limfnim čvorovima, pre- i postmenopauzalnim ženama s negativnim limfnim čvorovima ali s velikim tumorima ili lošim prognostičkim pokazateljima, te ženama u postmenopauzi s pozitivnim limfnim čvorovima čiji tumori nemaju estrogene receptore. Tumori >1 cm koji imaju estrogene receptore sa ili bez zahvaćenosti limfnih čvorova liječe se inhibitorima aromataze. Žene koje su liječenje započele tamoksifenom prije nego što su odobreni inhibitori aromataze treba prebaciti na inhibitor aromataze nakon 5-godišnjeg liječenja tamoksifenom i liječenje nastaviti još 5 godina.
Adjuvantna kemoterapija se dodaje hormonskoj terapiji ženama s pozitivnim estrogenim receptorima i pozitivnim čvorovima, a bez hormonske terapije se daje ženama s negativnim estrogenim receptorima i pozitivnim čvorovima, bilo da su u pre- ili postmenopauzi. Primjenjuju se različiti protokoli. Čini se da je najučinkovitiji protokol četiri ciklusa doksorubicina (60 mg/m2) plus ciklofosfamid (600 mg/m2) IV 1. dana svakog 3-tjednog ciklusa, a zatim četiri ciklusa paklitaksela (175 mg/m2) u 3-satnoj infuziji 1. dana svakog 3-tjednog ciklusa. U žena s tumorima HER2 +, trastuzumab (imunoterapija) povećava sposobnost kemoterapije da spriječi recidiv. Djelotvornost drugih kombinacija se istražuje. Odstranjenje jajnika kod žena u premenopauzi [npr. pomoću goserelina, tj. inhibitora hormona koji oslobađa luteinizirajući hormon (LHRH)] može biti jednako učinkovito kao i adjuvantna kemoterapija.
Adjuvantna terapija tamoksifenom (20 mg/dan tijekom 5 godina) ili inhibitorom aromataze (anastrazol, letrozol, eksemestan) daje se ženama u pre- ili postmenopauzi s tumorima koji imaju estrogene receptore i pozitivne čvorove ili ženama s negativnim čvorovima ali s velikim tumorom ili lošim prognostičkim znakovima. Rak dojke će se ponovno javiti u oko 50% žena s lokaliziranom bolešću. Čini se da visoke doze adjuvantne terapije uz potpornu terapiju za koštanu moždinu ne koristi čak niti ženama s velikim rizikom od recidiva.
Bolesnicama s lokalno uznapredovalim rakom dojke koristi neoadjuvantna polikemoterapija (npr. CAF: ciklofosfamid 500 mg/m2, doksorubicin 50 mg/m2, te 5-fluorouracil 500 mg/m2 sve IV 1. i 8. dana mjesečnog ciklusa od ukupno 6 ciklusa), nakon koje slijede kirurški zahvat i radioterapija dojke.
Liječenje metastatske bolesti ovisi o statusu estrogenih receptora i filozofiji liječenja. Ne postoji terapija kojom se može postići izlječenje metastatske bolesti. Randomizirana istraživnja nisu dokazala da primjena visokih terapijskih doza i hematopoetskih matičnih stanica poboljšava preživljenje. Srednje preživljenje iznosi oko 22 mjeseca kad se primjeni konvencionalno liječenje: inhibitori aromataze za tumore pozitivne na estrogene receptore i polikemoterapija za tumore negativne na estrogene receptore. Bolesnice čiji tumori eksprimiraju HER-2/neu imaju bolji terapijski odgovor kad se kemoterapiji doda trastuzumab (anti-HER-2/neu). Trastuzumab emtansin je konjugirani lijek koji se veže na stanice koje eksprimiraju HER2 i ima antitumorsko djelovanje. Kod metastatske bolesti neki stručnjaci zagovaraju sekvencijsku monoterapiju (davanje jednog po jednog djelotvornog lijeka zasebno). Kad je bolest rezistentna na antraciklin i taksan djelotvorni lijekovi su kapecitabin, vinorelbin, gemcitabin, irinotekan i pripravci platine. Bolesnicama na adjuvantnom tamoksifenu čija bolest progredira može koristiti inhibitor aromataze kao što je letrozol ili anastrazol. Polovica bolesnika koji odgovore na jednu endokrinu terapiju odgovorit će i na drugu. Bisfosfonati smanjuju koštane komplikacije, a mogu pojačati antitumorske učinke druge terapije. Radioterapija ublažava simptome (palijativna RT).
PREVENCIJA
Žene s rakom dojke imaju rizik od 0,5% godišnje za pojavu raka druge dojke. Žene s povećanim rizikom od raka dojke mogu smanjiti rizik za 49% uzimanjem tamoksifena ili inhibitora aromataze tijekom 5 godina. Žene s mutacijama BRCA-1 mogu smanjiti rizik za 90% jednostavnom mastektomijom.
Opširnije vidi u Lippman ME: Breast Cancer, Pogl. 108, str. 523, u HPIM-19.