DEFINICIJA
Neoplazme limfocita obično predstavljaju maligni duplikat stanica u određenom stadiju normalne diferencijacije limfocita. Kada kliničkom slikom dominira zahvaćenost koštane srži i periferne krvi, bolest se klasificira kao limfatična leukemija. Kada bolest pretežito zahvaća limfne čvorove i/ili druge ekstranodalne lokalizacije, tumor se naziva limfom. Razlučivanje limfoma od leukemije ponekad je otežano; npr. limfom malih stanica i kronična limfatična leukemija tumori su porijeklom iz istih stanica a razlikuju se slobodnom procjenom ovisno o apsolutnom broju limfocita u perifernoj krvi (>5 × 109/L upućuje na leukemiju).
KLASIFIKACIJA
Limfatični tumori povijesno imaju zasebnu patološku klasifikaciju koja se zasniva na kliničkom sindromu—limfomi po Rappaportovom, Kielskom ili Working Formulation sustavu; akutne leukemije po Francusko-američko-britanskom (FAB) sustavu; Hodgkinova bolest po Rye (grad u državi New York-po. prev.) klasifikaciji. Mijelomi se obično ne subklasificiraju prema patološkim karakteristikama neoplastičnih stanica. Svjetska zdravstvena organizacija (SZO) predložila je jedinstveni sustav klasifikacije koji objedinjuje sve limfatične neoplazme u jedan okvir. Premda novi sustav standardizira definicije entiteta na osnovu histološke slike, genetskih poremećaja, imunofenotipa i kliničkih karakteristika, organiziran je ovisno o porijeklu stanice (B ili T stanice) i stupnju zrelosti (prekursorske ili zrele stanice) tumora, što je od ograničene vrijednosti za kliničare. U Tbl 66-1 navedeni su entiteti bolesti po klinički korisnijem sustavu zasnovanom na kliničkim manifestacijama i prirodnom tijeku bolesti.
TABLICA 66-1 KLINIČKA SHEMA LIMFATIČNIH NEOPLAZMI
|
|
Kronične limfatične leukemije/limfomi
Kronična limfatična leukemija/limfom malih stanica (99% B stanice, 1% T stanice)
Prolimfatična leukemija (90% B stanice, 10% T stanice)
Leukemija velikih granuliranih limfocita (80% NK stanice, 20% T stanice)
Leukemija vlasastih stanica (99–100% B stanice)
|
|
Indolentni (spororastući) limfomi
Folikularni limfom, stupanj I i II (100% B stanice)
Limfoplazmocitni limfom/Waldenströmova makroglobulinemija (100% B stanice)
Limfom marginalne zone (100% B stanice)
Ekstranodalni (MALT limfom)
Nodalni (monocitoidni B stanični limfom)
Limfom marginalne zone slezene
Kožni T stanični limfom (mycosis fungoides) (100% T stanice)
|
|
Agresivni limfomi
Difuzni velikostanični limfom (85% B stanice, 15% T stanice) uključuje imunoblastični
Folikularni limfom, stupanj III (100% B stanice)
Limfom marginalne zone (100% B stanice)
Primarni medijastinalni (timusni) B velikostanični limfom (100% B stanice)
Limfom sličan Burkittovom (100% B stanice)
Periferni T stanični limfom (100% T stanice)
Angioimunoblastični limfom (100% T stanice)
Angiocentrični limfom (80% T stanice, 20% NK stanice)
Crijevni T stanični limfom (100% T stanice)
Anaplastični velikostanični limfom (70% T stanice, 30% NK stanice)
|
|
Akutne limfatične leukemije/limfomi
Prekursorska limfoblastična leukemija/limfom (80% T stanice, 20% B stanice)
Burkittova leukemija/limfom (100% B stanice)
T stanična leukemija/limfom odraslih (100% T stanice)
|
|
Poremećaji plazmocita (100% B stanice)
Monoklonalna gamapatija neodređenog značaja
Solitarni plazmocitom
Ekstramedularni plazmocitom
Multipli mijelom
Plazmocitna leukemija
|
|
Hodgkinov limfom (uglavnom porijeklom iz B stanica)
Pretežito limfocitni
Nodularna skleroza
Miješana celularnost
Limfocitna deplecija
|
|
Kratice: MALT = sluznično limfatično tkivo (engl. mucosa-associated lymphatic tissue); NK = ubilačke stanice (engl. natural killer).
|
INCIDENCIJA
Incidencija limfatičnih tumora je u porastu. U SAD-u je 2015. dijagnosticirano gotovo 127.000 slučajeva (Sl. 66-1).
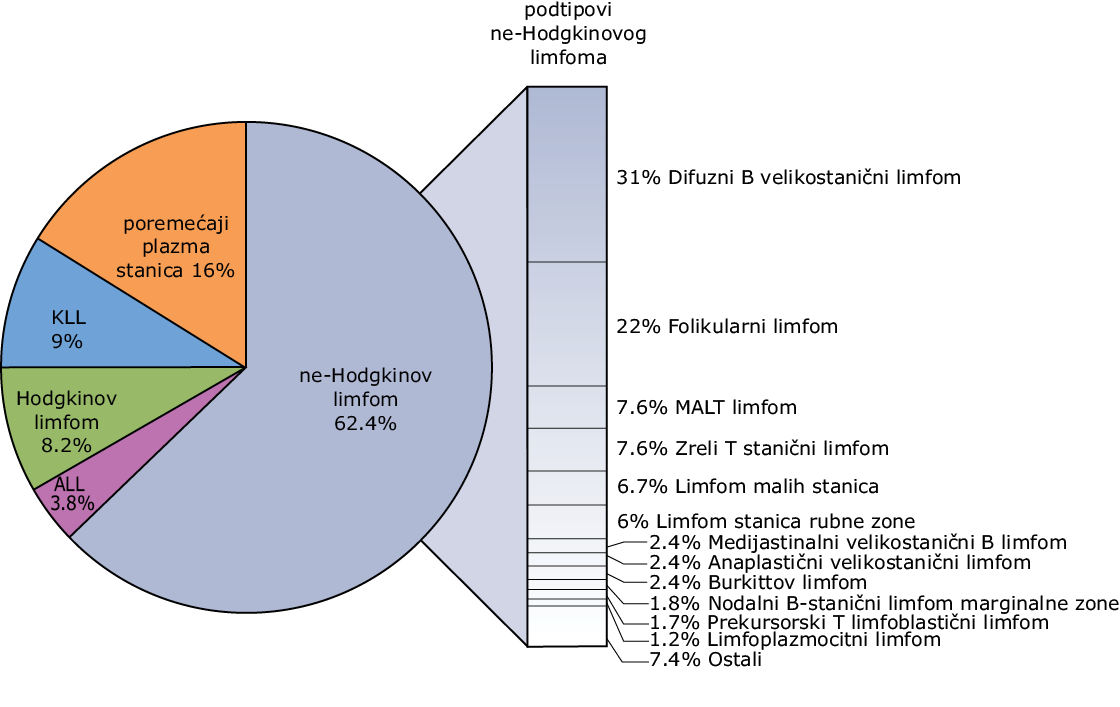
SLIKA 66-1 Relativna učestalost limfatičnih malignoma. ALL = akutna limfatična leukemija; KLL = kronična limfatična leukemija; MALT = sluznično limfatično tkivo.
ETIOLOGIJA
Uzroci velike većine limfatičnih neoplazmi nisu poznati. Maligne stanice su monoklonalne i često sadrže brojne genetske poremećaje. Neke genetske promjene karakteristične su za određene histološke entitete: t(8;14) u Burkittovom limfomu, t(14;18) u folikularnom limfomu, t(11;14) u limfomima plaštenih stanica, t(2;5) u anaplastičnom velikostaničnom limfomu, translokacije ili mutacije koje uključuju bcl-6 na 3q27 u difuznom velikostaničnom limfomu, i druge. U većini slučajeva translokacije uključuju inserciju distalnog segmenta kromosoma u gene za antigene receptora (imunoglobulinskih ili T staničnih receptora) tijekom preraspodjele segmenata gena koji formiraju receptore.
Tri virusa—Epstein-Barrov virus (EBV), humani herpesvirus-8 (HHV-8) (oba iz porodice herpes virusa) i humani T-limfotropni virus tip I (HTLV-I, retrovirus)—mogu uzrokovati neke limfatične tumore. EBV je usko povezan s afričkim Burkittovim limfomom i limfomima koji se razvijaju kao komplikacija imunodeficijencija (jatrogeni ili u sklopu bolesti). Nejasan je odnos EBV-a i Hodgkinove bolesti miješane celularnosti i angiocentričnog limfoma. HHV-8 uzrokuje rijedak entitet, limfom tjelesnih šupljina, prvenstveno u oboljelih od AIDS-a. HTLV-I je povezan s adultnom T staničnom leukemijom/limfomom (ATL). I virus i bolest endemični su za jugozapadni Japan i Karibe.
Infekcija želuca s Helicobacter pylori povezana je s limfomom limfnog tkiva sluznice želuca [engl. mucosa-associated lymphoid tissue (MALT) lymphoma], a moguće i velikostaničnim limfomom želuca. Eradikacija infekcije dovodi do trajne remisije u oko 50% bolesnika s MALT limfomom želuca. MALT limfomi drugih lokalizacija povezani su s infekcijama (očni adneksi, Chlamydia psittaci; tanko crijevo, Campylobacter jejuni; koža, Borrelia) ili autoimunim bolestima (žlijezde slinovnice, Sjögrenov sindrom; štitnjača, Hashimotov tireoiditis).
Nasljedne ili stečene imunodeficijencije i autoimuni poremećaji povećavaju sklonost razvoju limfoma. Limfom je 17 puta češći u ljudi zaraženih HIV-om. Limfomi se češće razvijaju u mesara i poljodjelaca; Hodgkinova bolesti je češća kod šumskih radnika.
DIJAGNOZA I ODREĐIVANJE STADIJA
Ekscizijska biopsija je standardni dijagnostički postupak; treba uzeti odgovarajući uzorak tkiva. Tkivo se zatim analizira na tri načina: (1.) svjetlosnim mikroskopom treba utvrditi obrazac rasta i morfološke karakteristike malignih stanica, (2.) protočnom citometrijom treba odrediti imunofenotip, i (3.) genetskim pretragama (citogenetika, sekvenciranje DNK). Iglena aspiracija čvora ili esktranodalne tvorbe nije primjeren dijagnostički postupak. Dijanosticiranje leukemije i određivanje stadija limfoma zahtijeva bilateralnu biopsiju koštane srži iz ilijačne kriste. Diferencijalna dijagnoza adenopatije opisana je u Pogl. 44.
Određivanje stadija bolesti ovisi o dijagnozi. Kod akutne leukemije za prognozu je najvažniji broj blasta u perifernoj krvi. Kod kronične leukemije za prognozu je najvažniji broj eritrocita i trombocita u perifernoj krvi. Kod ne-Hodgkinovih limfoma razlikujemo pet kliničkih prognostičkih faktora: indolentni (spororastući) i agresivni limfomi imaju tri zajednička, uznapredovali stadij, visoka razina laktat dehidrogenaze (LDH) i dob >60 godina. Kod folikularnog limfoma, zadnja dva faktora su razina Hb <120 g/L (<12 g/dL) i zahvaćenost limfnih čvorova na više od četiri mjesta (>4 nodalna žarišta). Kod agresivnih limfoma prediktori ishoda su postojanje više od jednog ekstranodalnog žarišta i opće stanje (funkcionalni status) bolesnika. Kod mijeloma se preživljenje predviđa na temelju serumske razine paraproteina, kreatinina i β2-mikroglobulina.
KRONIČNE LIMFATIČNE LEUKEMIJE/LIMFOMI
Prirodni tijek većine ovih entiteta mjeri se u godinama. (Prolimfocitna leukemija je vrlo rijetka i može biti vrlo agresivna.) Kronična limfatična leukemija (KLL) je najčešći entitet u ovoj skupini (~15.000 slučajeva godišnje u SAD-u) i najčešća leukemija u zapadnom svijetu.
KRONIČNA LIMFATIČNA LEUKEMIJA (KLL)
Obično se očituje asimptomatskom limfocitozom u pacijenata >60 god. Maligna stanica je CD5+ B stanica koja izgleda kao normalan mali limfocit. Trisomija 12 je najčešća genetska abnormalnost. Prognoza ovisi o stadiju; stadij uglavnom određuje stupanj kojim tumorske stanice potiskuju (suprimiraju) normalne hematopoetske elemente iz koštane srži (Tbl. 66-2). Stanice mogu infiltrirati limfne čvorove i slezeznu kao i koštanu srž. Zahvaćenost limfnih čvorova može biti povezana s ekspresijom adhezijske molekule koja omogućava stanicama da ostanu u limfnom čvoru umjesto da recirkuliraju. Bolesnici često imaju hipogamaglobulinemiju. Do 20% bolesnika ima autoimuna antitijela koja mogu izazvati autoimunu hemolitičku anemiju, trombocitopeniju ili eritrocitnu aplaziju. Smrt nastupa uslijed infekcije, zatajenja koštane srži ili neke interkurentne bolesti. U 5% slučajeva bolest prelazi u agresivni limfom (Richterov sindrom) koji je refraktoran na liječenje.
TABLICA 66-2 ODREĐIVANJE STADIJA B STANIČNE KLL I UTJECAJ NA PREŽIVLJENJE
|
|
Stadij
|
Kliničke karakteristike
|
Prosječno preživljenje, godine
|
|
RAI
|
|
|
|
0
|
Limfocitoza
|
12
|
|
I
|
Limfocitoza + adenopatija
|
9
|
|
II
|
Limfocitoza + splenomegalija
|
7
|
|
III
|
Anemija
|
1–2
|
|
IV
|
Trombocitopenija
|
1–2
|
|
BINET
|
|
|
|
A
|
Bez anemije/trombocitopenije, <3 žarišta
|
>10
|
|
B
|
Bez anemije/trombocitopenije, >3 žarišta
|
5
|
|
C
|
Anemija i/ili trombocitopenija
|
2
|
| |
Podtipovi KLL-a mogu postojati ovisno o tome eksprimiraju li tumori mutirane imunoglobulinske gene (indolentan, tj. sporiji tijek, dobra prognoza) ili nemutirane imunoglobulinske sljedove (agresivniji tijek, slab odgovor na terapiju). Metode za kliničko razlikovanje ova dva podtipa nisu jasno definirane; CD38+ tumori imaju lošiju prognozu. Ekspresija ZAP-70, intracelularne tirozin kinaze koja se normalno nalazi u T stanicama i koja je aberantno eksprimirana u oko 45% slučajeva KLL-a, može biti bolji način za definiranje prognostičkih podtipova. ZAP-70-pozitivni bolesnici obično trebaju liječenje unutar 3–4 godine od postavljanja dijagnoze; ZAP-70-negativni slučajevi obično ne zahtijevaju liječenje 8–11 godina.
LIJEČENJE KRONIČNA LIMFATIČNA LEUKEMIJA
Liječenje je uglavnom potporno sve dok se ne razvije anemija ili trombocitopenija. Tada su indicirane pretrage kako bi se utvrdio uzrok anemije ili trombocitopenije. Smanjen broj eritrocita i/ili trombocita prouzročen razaranjem na periferiji može se u mnogim slučajevima liječiti splenektomijom ili glukokortikoidima bez citotoksične terapije. Ukoliko je uzrok supresija koštane srži, indicirana je citotoksična terapija. Fludarabin, 25 (mg/m2)/dan IV × 5 dana svaka 4 tjedna inducira odgovor u oko 75% bolesnika, a kompletan odgovor u 50%. Rituksimab (375–500 mg/m2, 1. dan), fludarabin (25 mg/m2, 2.–4. dan u 1. ciklusu a 1.–3. dan u sljedećim ciklusima), plus ciklofosfamid (250 mg/m2 uz fludarabin) induciraju kompletan odgovor u gotovo 70% bolesnika, ali ovaj protokol izaziva značajnu mijelotoksičnost. Glukokortikoidi povećavaju rizik od infekcije bez znatnijeg antitumorskog učinka. Mjesečne infuzije imunoglobulina (IVIg) znatno smanjuju rizik od ozbiljnih infekcija ali su skupe i obično rezervirane za bolesnike koji se imali ozbiljnu infekciju. Alkilirajuća sredstva također imaju antitumorski učinak. Ibrutinib, inhibitor Brutonove tirozin kinaze vrlo je djelotvoran u liječenju KLL-a pa se ponekad koristi kao primarna terapija. Terapija je palijativna za većinu bolesnika. Mlađi bolesnici mogu biti kandidati za intenzivnu terapiju (visoke doze) i autolognu ili alogeničnu transplantaciju hematopoetskih matičnih stanica; zabilježeno je dugotrajno preživljenje bez bolesti. Mini transplantacija, za koju je pripremni protokol imunosupresivan, ali ne i mijeloablativan, može biti manje toksičan i imati jednaku ili veću učinkovitost u liječenju nego terapija visokim dozama. Monoklonska protutijela alemtuzumab (anti-CD52) i rituksimab, obinutuzumab i ofatumumab (svi anti-CD20) također se mogu koristiti u monoterapiji ili u kombinaciji s klorambucilom.
Opširnije o rjeđim entitetima vidi u Pogl. 134 i 135e u HPIM-19.
SPORORASTUĆI (INDOLENTNI) LIMFOMI
Prirodni tijek ovih entiteta mjeri se u godinama. Medijan preživljenja je oko 14 godina. Folikularni limfom je najčešći indolentni (spororastući) limfom, a čini oko trećinu svih limfatičnih malignoma.
FOLIKULARNI LIMFOM
Obično se očituje bezbolnom perifernom limfadenopatijom, a često zahvaća nekoliko regija limfnih čvorova. “B simptomi” (vrućica, znojenje, gubitak na težini) javljaju se u 10% oboljelih, rjeđe nego kod Hodgkinova limfoma. U oko 25% slučajeva, čvorovi rastu i smanjuju se prije nego što pacijent potraži medicinsku pomoć. Srednja dob je 55 godina. U trenutku postavljanja dijagnoze bolest je proširena u 85% slučajeva. Jetra i koštana srž često su ekstranodalna žarišta.
Tumor ima folikularni ili nodularni tip rasta jer maligne stanice potječu iz središta folikula. Translokacija t(14;18) nalazi se u 85% slučajeva, što dovodi do prekomjerne ekspresije bcl-2, proteina koji sudjeluje u sprječavanju apoptoze (programirana smrt stanice). U zdravoj folikularnoj B stanici varijabilne regije imunoglobulina mutiraju kako bi se stvorilo antitijelo većeg afiniteta za određeni antigen. Stanice folikularnog limfoma također imaju visok postotak mutacija koje dovode do nakupljanja genetskih oštećenja. S vremenom, u folikularnim limfomima nakupi se dovoljno genetskih oštećenja (npr. mutacija p53) da se njihov rast ubrza i razviju u difuzne velikostanične B limfome koji su često refraktorni na liječenje. U većine bolesnika umrlih od folikularnog limfoma nađena je histološka transformacija. Stopa te transformacije iznosi oko 7% godišnje i posljedica je bolesti, a ne terapije. Stopa histološke progresije se smanjila kako se liječenje poboljšalo.
LIJEČENJE FOLIKULARNI LIMFOMI
Samo 15% bolesnika ima lokaliziranu (ograničenu) bolest, ali se većina može izliječiti radioterapijom. Premda mnogi oblici liječenja dovode do regresije tumora u bolesnika s uznapredovalim stadijem bolesti, izlječenje se teško postiže. Potporna terapija, monoterapija alkilirajućim agensima, nukleozidni analozi (fludarabin, kladribin), polikemoterapija, radioterapija i biološki lijekovi [interferon-α (IFN-α) te monoklonalna antitijela kao što je rituksimab (anti-CD20)] mogu biti prikladni. Više od 90% oboljelih reagira na liječenje; kompletan odgovor postiže se u oko 50–75% bolesnika liječenih agresivnom terapijom. Prosječno trajanje remisije u bolesnika liječenih ciklofosfamidom, doksorubicinom, vinkristinom i prednizonom (CHOP) uz rituksimab prelazi 6 godina. Bendamustin + rituksimab je učinkovita kombinacija. Mlađi bolesnici liječe se eksperimentalno visokim dozama i autolognom transplantacijom hematopoetskih matičnih stanica ili minitransplantacijom. Još uvijek nije jasno je li ovaj pristup kurativan. Radioimunoterapija izotopima navođenim anti-CD20 antitijelom (ibritumomab tiuksetan, In-111; tositumomab, I-131) može izazvati trajan odgovor. Polikemoterapija sa ili bez održavanja interferonom može produljiti preživljenje i odgoditi ili spriječiti histološku progresiju, osobito u bolesnika s lošim prognostičkim pokazateljima. Čini se da remisije traju dulje kada se primjeni kemoterapija zajedno s rituksimabom; neki podaci upućuju na to da dulje remisije dovode do poboljšanog preživljenja.
Opširnije o drugim spororastućim limfomima vidi u Pogl. 134 i135e u HPIM-19.
AGRESIVNI LIMFOMI
Veliki broj patoloških entiteta ima agresivan prirodni tijek bolesti; prosječno preživljenje bez liječenja iznosi 6 mjeseci, a gotovo svi neliječeni bolesnici umiru unutar godine dana. Bolesnici se mogu tužiti na asimptomatsku adenopatiju ili na simptome koji su posljedica zahvaćenosti praktično bilo kojeg limfnog čvora ili ekstranodalnog žarišta. Širenje bolesti u medijastinum može izazvati sindrom gornje šuplje vene ili tamponadu perikarda; retroperitonealni limfni čvorovi mogu izazvati opstrukciju uretera, abdominalne tvorbe mogu uzrokovati bol, ascites, GI opstrukciju ili perforaciju; zahvaćenost CNS-a može izazvati smetenost, znakove sa strane moždanih živaca, glavobolju, konvulzije i/ili pritisak na kralježničnu moždinu; zahvaćanje kostiju može izazvati bol i patološke prijelome. Oko 45% bolesnika ima B simptome.
Difuzni velikostanični B limfom je najčešća histološka dijagnoza među agresivnim limfomima i čini 35–45% svih limfoma. Agresivni limfomi zajedno čine ~60% svih limfatičnih tumora. Oko 85% agresivnih limfoma nastaje iz zrelih B stanica, dok 15% nastaje iz perifernih (posttimusnih) T stanica.
PRISTUP BOLESNIKU:
Agresivni limfomi
Presudna je rana dijagnostička biopsija. Obradu bolesnika usmjeravaju simptomi i poznati oblik bolesti. Bolesnicima kojima je zahvaćen Waldeyerov prsten treba pažljivo pregledati probavni sustav (gastroenterološka obrada). Pacijentima kojima je bolest zahvatila kost(i) ili koštanu srž treba učiniti lumbalnu punkciju kako bi se utvrdilo je li se proces proširio na moždane ovojnice.
LIJEČENJE AGRESIVNI LIMFOMI
Lokalizirani agresivni limfomi obično se liječe s četiri ciklusa polikemoterapije po CHOP protokolu ± radioterapija zahvaćenog područja. Izliječi se oko 85% bolesnika. CHOP + rituksimab još je učinkovitiji od CHOP + radioterapija. Specifična terapija potrebna za uznapredovalu bolest je sporna. Šest ciklusa CHOP + rituksimab je terapija izbora za uznapredovalu bolest. Na ishod utječe veličina tumora (obično se određuje prema razini LDH, stadiju i broju ekstranodalnih žarišta) i fiziološka rezerva (obično se utvrđuje s obzirom na dob i status prema Karnofskom) (Tbl. 66-3). CHOP + rituksimab izliječi oko dvije trećine bolesnika. Primjenom sekvencijske kemoterapije u visokim dozama kod srednjerizičnih i visokorizičnih bolesnika postignuto je dugotrajno preživljenje u oko 75% slučajeva u nekim ustanovama. Druge studije nisu uspjele potvrditi ulogu terapije visokim dozama.
TABLICA 66-3 MEĐUNARODNI PROGNOSTIČKI SUSTAV ZA NHL
|
|
Pet kliničkih faktora rizika:
Dob ≥60 godina
Povišena razina serumske laktat dehidrogenaze (LDH)
Opće stanje bolesnika ≥2 (ECOG) ili ≤70 (Karnofsky)
Ann Arbor stadij III ili IV
>1 ekstranodalno žarište
|
|
Bolesnicima se dodjeljuje broj za svaki faktor rizika koji imaju.
|
|
Bolesnici su razvrstani (grupirani) prema vrsti limfoma.
|
|
Za difuzni B velikostanični limfom:
|
|
|
0, 1 faktor = niski rizik:
|
35% slučajeva; 5-godišnje preživljenje, 73%
|
|
2 faktora = nisko srednjerizični:
|
27% slučajeva; 5-godišnje preživljenje, 51%
|
|
3 faktora = visoko srednjerizični:
|
22% slučajeva; 5-godišnje preživljenje, 43%
|
|
4, 5 faktora = visoki rizik:
|
16% slučajeva; 5-godišnje preživljenje, 26%
|
|
Za difuzne B velikostanične limfome liječene R-CHOP-om:
|
|
0 faktor = vrlo dobro:
|
10% slučajeva; 5-godišnje preživljenje, 94%
|
|
1, 2 faktora = dobro:
|
45% slučajeva; 5-godišnje preživljenje, 79%
|
|
3, 4, 5 faktora = loše:
|
45% slučajeva; 5-godišnje preživljenje, 55%
|
|
Kratice: ECOG = Eastern Cooperative Oncology Group; NHL = ne-Hodgkinov limfom; R-CHOP = rituksimab, ciklofosfamid, doksorubicin, vinkristin, prednizon.
|
Oko 30–45% bolesnika neizliječenih početnom standardnom poli-kemoterapijom može se spasiti visokim dozama citostatika i transplantacijom autolognih hematopoetskih matičnih stanica.
Limfomi koji zahvaćaju određena mjesta (npr. CNS, želudac) ili u određenim složenim kliničkim situacijama (npr. istodobno postojanje druge bolesti, AIDS) zahtijevaju specijalni pristup. Limfomi koji se javljaju u jatrogeno imunosuprimiranih bolesnika mogu se povući nakon obustave imunosupresivne terapije. Limfomi koji nastaju poslije alogenične transplatancije koštane srži mogu se povući nakon infuzije leukocita davatelja.
Bolesnici s brzo rastućim, velikim agresivnim limfomom mogu prilikom liječenja razviti sindrom lize tumora (Pogl. 25). Profilaktičke mjere [hidracija, alkalizacija urina, alopurinol, rasburikaza (op.prev. lijek za ↓ urične kiseline koja nastaje lizom tumora; pretvara uričnu kiselinu u alantoin koji se lako izlučuje bubrezima)] mogu spasiti život.
AKUTNE LIMFATIČNE LEUKEMIJE/LIMFOMI
AKUTNA LIMFOBLASTIČNA LEUKEMIJA I LIMFOBLASTIČNI LIMFOM
Češći su u djece nego u odraslih (~6000 slučajeva godišnje). U većini slučajeva radi se o tumorskim stanicama koje potječu iz timusa, a bolesnici mogu imati medijastinalne tvorbe. Bolesnici obično imaju već na početku znakove zatajenja koštane srži (bljedilo, umor, krvarenje, vrućicu, infekciju). Hepatomegalija i adenopatija su uobičajene. Muškarci mogu imati uvećane testise što je posljedica leukemijske zahvaćenosti. Zahvaćenost moždanih ovojnica može biti prisutna pri postavljanju dijagnoze ili se razvija kasnije. Mogu se naći povišene vrijednosti LDH, hiponatrijemija i hipokalijemija, te popratna anemija, trombocitopenija i visoki broj blasta u perifernoj krvi. Leukemijske stanice su češće FAB tipa L2 u odraslih, dok u djece prevladava tip L1. Leukemija se dijagnosticira kada je u koštanoj srži najmanje 20% limfoblasta. Prognozu znatno pogoršava izrazita leukocitoza u vrijeme postavljanja dijagnoze, dob >35 godina i nalaz translokacija t(9;22), t(1;19) i t(4;11). Ekspresija HOX11 identificira povoljniju podskupinu T staničnih akutnih limfoblastičnih leukemija (T-ALL).
LIJEČENJE AKUTNE LIMFOBLASTIČNE LEUKEMIJE I LIMFOBLASTIČNI LIMFOMI
Za uspješno liječenje potrebna je intenzivna indukcijska faza, profilaksa CNS-a i kemoterapija održavanja koja traje oko 2 godine. Vinkristin, L-asparaginaza, citarabin, daunorubicin i prednizon su osobito učinkoviti lijekovi. Učinkovita profilaksa CNS-a provodi se visokim dozama metotreksata koje se daju intratekalno ili sistemski. Dugotrajno preživljenje postiže se u 60–65% bolesnika. Može se postići dugoročno preživljenje u otprilike 60-65% pacijenata. Uloga i vrijeme transplantacije koštane srži u primarnoj terapiji još su predmet rasprave, ali se ipak do 30% bolesnika s relapsom izliječi spasonosnom transplantacijom.
BURKITTOV LIMFOM/LEUKEMIJA
Ova je bolest također češća u djece. Povezana je s translokacijama koje zahvaćaju c-myc gen na kromosomu 8 i reorganizacijom gena za imunoglobulinske teške ili lake lance. Bolesnici često imaju diseminiranu bolest s velikim abdominalnim masama, hepatomegaliju i adenopatiju. Ako prevladava slika leukemije, klasificira se kao FAB L3.
LIJEČENJE BURKITTOV LIMFOM/LEUKEMIJA
Resekcija velikih abdominalnih masa poboljšava ishod liječenja. Koriste se agresivni leukemijski protokoli koji uključuju vinkristin, ciklofosfamid, 6-merkaptopurin, doksorubicin i prednizon. Najučinkovitiji protokoli su CODOX-M i BFM. Izlječenje se može postići u 50–60% slučajeva. Potreba za terapijom održavanja nije razjašnjena. Važna je profilaksa protiv sindroma lize tumorskih stanica (Pogl. 25).
LEUKEMIJA/LIMFOM T-STANICA U ODRASLIH (ATL)
Vrlo je rijetka. Oboli samo mali broj ljudi (~2%) zaraženih s HTLV-I. U nekih se bolesnika zaraženih s HTLV-I razvije spastična paraplegija zbog zahvaćanja kralježnične moždine bez pojave karcinoma. Karakteristični klinički sindrom ATL-a uključuje leukocitozu bez teške anemije ili trombocitopenije, infiltraciju kože, hepatomegaliju, infiltrate na plućima, zahvaćenost moždanih ovojnica i oportunističke infekcije. Tumorske stanice su CD4+ T-stanice s jezgrama poput papka ili cvijeta. Hiperkalcijemiju nalazimo u gotovo svih bolesnika, a nastaje zbog lučenja citokina iz tumorskih stanica.
LIJEČENJE LEUKEMIJE/LIMFOMI T-STANICA U ODRASLIH
Agresivna terapija izaziva ozbiljnu toksičnost zbog postojeće imunodeficijencije. Glukokortikoidi ublažuju hiperkalcijemiju. Tumor reagira na terapiju, ali odgovor je uglavnom kratkotrajan. Za neke bolesnike zidovudin i IFN mogu biti palijativna terapija.
BOLESTI PLAZMA STANICA
Znak bolesti plazma stanica je proizvodnja imunoglobulinskih molekula ili fragmenata iz abnormalnih plazma stanica. Cjelovita molekula imunoglobulina, ili teški ili laki lanci koje proizvodi abnormalni klon plazma stanica može se otkriti u serumu i/ili urinu i naziva se M (monoklonska) komponenta. Količina M komponente u svakog bolesnika odraz je tumorske mase kod tog bolesnika. U nekim je slučajevima prisutnost lakih lanaca u mokraći (Bence-Jonesovi proteini) jedini tumorski produkt koji se može otkriti. M komponente se mogu naći i u bolesnika s drugim limfatičnim tumorima, nelimfatičnim karcinomima i drugim nekanceroznim bolestima kao što su ciroza, sarkoidoza, infestacije parazitima i autoimune bolesti.
MULTIPLI MIJELOM
Maligna proliferacija plazma stanica u koštanoj srži (ne u limfnim čvorovima). Svake godine dijagnosticira se gotovo 27.000 novih slučajeva. Pojava bolesti rezultat je rasta i širenja tumora, lokalnih i sistemskih učinaka tumorskih produkata i odgovora domaćina na tumor. Oko 70% bolesnika ima bolove u kostima, obično u kralježnici i rebrima, a pogoršavaju ih kretnje. Lezije u kostima su višestruke i litičke, a rijetko ih prati odgovor osteoblasta. Zato su rendgenske snimke kostiju korisnije od scintigrafije. Tumorske stanice stvaraju citokine koji aktiviraju osteoklaste što dovode do značajne mobilzacije kalcija, hiperkalcijemije i simptoma vezanih uz to. Smanjena sinteza i pojačan katabolizam normalnih imunoglobulina dovodi do hipogamaglobulinemije, a slabo definirani tumorski produkt inhibira migraciju granulocita. Ove promjene stvaraju podložnost bakterijskim infekcijama, osobito za pneumokok, Klebsiella pneumoniae i Staphylococcusaureus koji napadaju pluća te Escherichia coli i druge gram-negativne patogene u mokraćnom sustavu. Infekcije pogađaju najmanje 75% oboljelih od multiplog mijeloma u nekom trenutku bolesti. Bubrežno zatajenje se razvija u 25% bolesnika; patogeneza je multifaktorijalna—hiperkalcijemija, infekcija, toksični učinak lakih lanaca, uratna nefropatija i dehidracija. Neurološki simptomi mogu biti posljedica hiperviskoznosti, krioglobulinemije, i u rijetkim slučajevima odlaganja amiloida u živcima. Anemija se razvija u 80% slučajeva radi mijeloftize i inhibicije eritropoeze tumorskim produktima. Poremećaji zgrušavanja mogu dovesti do krvarenja.
Dijagnoza
Klasični mijelomski trijas čini plazmacitoza koštane srži >10%, litičke lezije kosti(ju) i M komponenta u serumu i/ili urinu. Monoklonalna gamapatija neodređenog značenja (MGUS) mnogo je češća od mijeloma, a pogađa oko 6% ljudi starijih od 70 godina. Kod MGUS-a u pravilu nalazimo M komponentu <20 g/L, nizak serumski β2-mikroglobulin, <10% plazma stanica u koštanoj srži i nema litičnih lezija u kostima. Opasnost od progresije MGUS-a u mijelom je ~25%.
Određivanje stadija bolesti
Stadij bolesti utječe na preživljenje (Tbl. 66-4).
TABLICA 66-4 SUSTAV ZA ODREĐIVANJE STADIJA MIJELOMA
|
|
Durie-Salmonov sustav za određivanje stadija mijeloma
|
|
Stadij
|
Kriterij
|
Procijenjena tumorska masa × 1012 stanica/m2
|
|
I
|
Sve navedeno:
|
<0,6 (niski)
|
|
|
1. Hemoglobin >100 g/L (>10 g/dl)
|
|
|
|
2. Serumski kalcij <3 mmol/L (<12 mg/dl)
|
|
|
|
3. Normalna RTG snimka kostiju ili solitarna lezija
|
|
|
|
4. Niska razina M-komponente
|
|
|
|
a. IgG <50 g/L (<5 g/dl)
|
|
|
|
b. IgA <30 g/L (<3 g/dl)
|
|
|
|
c. Laki lanci u urinu <4 g/24 h
|
|
|
II
|
Ne zadovoljavaju I niti III
|
0,6–1,20 (srednja)
|
|
III
|
Jedan ili više od sljedećih:
|
>1,20 (velika)
|
|
|
1. Hemoglobin <85 g/L (<8.5 g/dl)
|
|
|
|
2. Serumski kalcij >3 mmol/L (>12 mg/dl)
|
|
|
|
3. Uznapredovale litičke koštane lezije
|
|
|
|
4. Visoka razina M-komponente
|
|
|
|
a. IgG >70 g/L (>7 g/dl)
|
|
|
|
b. IgA >50 g/L (>5 g/dl)
|
|
|
|
c. Laki lanci u urinu>12 g/24 h
|
|
|
Razina
|
Stadij
|
Prosječno preživljenje, mjeseci
|
|
Subklasifikacija prema razini kreatinina u serumu
|
|
A <177 μmol/L (<2 mg/dl)
|
IA
|
61
|
|
B >177 μmol/L (>2 mg/dl)
|
IIA, B
|
55
|
| |
IIIA
|
30
|
| |
IIIB
|
15
|
|
Međunarodni sustav za određivanje stadija bolesti
|
|
β2M <3.5, alb ≥3.5
|
I (28%)
|
62
|
|
β2M <3.5, alb <3.5 ili β2M = 3.5–5.5
|
II (39%)
|
44
|
|
β2M >5.5
|
III (33%)
|
29
|
|
Tumač: β2M= serumski β2-mikroglobulin u mg/L; alb = serumski albumin u g/dl; (#) = % bolesnika u određenom stadiju.
|
LIJEČENJE MULTIPLI MIJELOM
Oko 10% oboljelih ima bolest koja napreduje veoma polako (tzv. “tinjajući” mijelom) pa ne zahtijeva liječenje sve do porasta paraproteina iznad 50 g/L ili do pojave progresivne bolesti kostiju. Bolesnici sa solitarnim i ekstramedularnim plazmocitomom obično se izliječe lokaliziranom radioterapijom. Potporna terapija uključuje vrlo rano liječenje infekcija, kontrolu hiperkalcijemije glukokortikoidima, hidraciju i natriurezu, kroničnu primjenu bisfosfonata koji sprječavaju razaranje kosti, te profilaksu uratne nefropatije i dehidracije. Terapija usmjerena na tumor obično je palijativna. Inicijalnu terapiju obično čini jedan od nekoliko pristupa, ovisno o tome je li bolesnik kandidat za kemoterapiju visokim dozama i transplantaciju autolognih matičnih stanica. Prikladni za transplantaciju (izbjegavati alkilirajuće agense): talidomid, 400 mg/d PO ili 200 mg svaku večer, plus deksametazon, 40 mg/d 1.–4. dana svakog mjeseca, sa ili bez bortezomiba, ili kemoterapija, npr. liposomalni doksorubicin. Transplantacija nije prihvatljiva: melfalan, 8 mg/m2 PO 4–7 dana svakih 4–6 tjedana, plus prednizon. Oko 60% bolesnika ima značajno simptomatsko poboljšanje te smanjenje M komponente od 75%. Bortezomib također poboljšava terapijski odgovor na melfalan. Eksperimentalnim pristupima (sekvencijska pulsna terapija visokim dozama melfalana plus dvije uzastopne transplantacije autolognih matičnih stanica) postiže se potpuni terapijski odgovor u ~50% bolesnika <65 god. Dugotrajno praćenje će pokazati je li se preživljenje poboljšalo. Kod palijativno liječenih bolesnika obično slijedi kronični tijek koji traje 2–5 god., a zatim dolazi do ubrzanja bolesti koje se očituje infiltracijom organa mijelomskim stanicama i zatajenjem koštane srži. Agresivnijim liječenjem može se postići prosječno preživljenje od 6 godina. Novi pristupi spasonosnoj terapiji uključuju bortezomib, 1.3 mg/m2 1., 4., 8. i 11. dana svaka 3 tjedna, često s deksametazonom, vinkristinom i/ili liposomalnim doksorubicinom. Lenalidomid je također djelotvoran pa se sve više koristi kao terapija održavanja.
HODGKINOV LIMFOM (HL)
Svake godine dijagnosticira se oko 9000 novih slučajeva. HL je tumor Reed-Sternbergovih stanica, aneuploidnih stanica koje obično eksprimiraju CD30 i CD15, ali mogu iskazivati i druge B- ili T-stanične biljege. Većina tumora nastaje iz B stanica u kojima su imunoglobulinski geni promijenjeni, ali nisu eksprimirani. Većina stanica u povećanom lifmnom čvoru su normalni limfociti, plazmociti, monociti i eozinofili. Etiologija je nepoznata, ali je incidencija u identičnih blizanaca 99 puta veća od očekivane konkordancije, što upućuje na genetsku predispoziciju. Histološki razlikujemo slijedeće podvrste: 75% nodularna skleroza, 20% miješana celularnost, a za oko 5% karakteristično je prevladavanje limfocita i limfocitna deplecija.
Klinička slika
Obično se manifestira asimptomatskim uvećanjem limfnih čvorova ili adenopatijom s vrućicom, noćnim znojenjem, mršavljenjem i ponekad svrbežom. Medijastinalna adenopatija (česta kod HL s nodularnom sklerozom) može izazvati kašalj. Bolest se obično širi u susjedne skupine limfnih čvorova. Prva manifestacija bolesti može biti opstrukcija gornje šuplje vene ili kompresija kralježnične moždine. Rijetko infiltrira koštanu srž i jetru.
Diferencijalna dijagnoza
- Infekcije: mononukleoza, virusni sindromi, toksoplazmoza, histoplazmoza, primarna tuberkuloza
- Druge maligne bolesti: osobito tumori glave i vrata
- Sarkoidoza: medijastinalna i hilarna adenopatija
Imunološki i hematološki poremećaji
- Poremećaji stanične imunosti (zaostaje čak i nakon uspješnog liječenja limfoma), kutana anergija, smanjena proizvodnja antitijela na kapsularne antigene Haemophilusa i pneumokoka
- Anemija; ubrzana sedimentacija (SE), leukemoidna reakcija, eozinofilija, limfocitopenija, fibroza i granulomi koštane srži
Određivanje stadija
Ann Arborsku klasifikaciju stadija bolesti prikazuje Tbl. 66-5. Stadij bolesti se određuje na temelju fizikalnog pregleda, RTG-a prsnog koša, CT-a toraksa i abdomena, biopsijom koštane srži, ultrazvučnim pregledom i limfangiogramom. Ako je prema kliničkom pregledu bolest u ranom stadiju i predviđa se radioterapija, treba uraditi eksploracijsku laparotomiju i odrediti stadij bolesti, osobito zbog evaluacije slezene. Određivanje patohistološkog stadija bolesti je nepotrebno ako se bolesnik liječi kemoterapijom.
TABLICA 66-5 ANN ARBORSKI SUSTAV ZA ODREĐIVANJE STADIJA HODGKINOVOG LIMFOMA
|
|
Stadij
|
Definicija
|
|
I
|
Zahvaćenost jedne regije limfnih čvorova ili jedne limfatične strukture (npr. slezena, timus, Waldeyerov prsten)
|
|
II
|
Zahvaćenost dvije ili više regija limfnih čvorova na istoj strani ošita (medijastinum je samo jedno mjesto; hilarni limfni čvorovi smatraju se “lateralizacijom” i, kada su zahvaćeni na obje strane, prestavljaju stadij II bolesti)
|
|
III
|
Zahvaćenost regija limfnih čvorova ili limfatičnih struktura na obje strane ošita
|
|
III1
|
Subdijafragmalna zahvaćenost ograničena na slezenu, spleničke hilarne, celijačne ili portalne limfne čvorove
|
|
III2
|
Subdijafragmalna zahvaćenost koja uključuje paraaortalne, ilijačne ili mezenteričke limfne čvorove plus strukture navedene u III1
|
|
IV
|
Zahvaćenost ekstranodalnih mjesta osim onih označenih s “E”
|
|
|
Više od jednog ekstranodalnog depozita bilo koje lokalizacije
|
|
|
Bilo koja zahvaćenost jetre ili koštane srži
|
|
A
|
Bez simptoma
|
|
B
|
Neobjašnjivi gubitak >10% tjelesne težine unutar 6 mjeseci prije određivanja stadija bolesti
|
|
|
Neobjašnjiva, perzistentna (trajna) ili rekurentna (povremena) vrućica >38°C tijekom prethodnog mjeseca
|
|
|
Rekurentno noćno znojenje tijekom prethodnog mjeseca
|
|
E
|
Lokalizirana, solitarna zahvaćenost ekstalimfatičnog tkiva, isključujući jetru i koštanu srž
|
LIJEČENJE HODGKINOV LIMFOM
Oko 85% bolesnika je izlječivo. Terapiju trebaju provoditi iskusni kliničari u odgovarajuće opremljenim ustanovama. Većini bolesnika stadij bolesti određen je klinički, a liječeni su samo kemoterapijom ili kombiniranom terapijom. Bolesnici u stadiju II često primaju dva ili četiri ciklusa doksorubicina, bleomicina, vinblastina, dakarbazina (ABVD) sa ili bez radioterapije ili Stanford V, kombinirani način liječenja s nižim dozama kemoterapije. Oni u stadiju III ili IV primaju šest ciklusa polikemoterapije, obično ABVD. Bolesnike u bilo kojem stadiju bolesti s velikim medijastinalnim masama (>1/3 najvećeg promjera prsnog koša) trebalo bi liječiti kombiniranom terapijom MOPP/ABVD ili mekloretaminom, vinkristinom, prokarbazinom, prednizonom (MOPP)-ABV hibrid, a zatim treba provesti radioterapiju uz zaštitno polje. (Zračenje plus ABVD su pretoksični za pluća.) Trajno pozitivan nalaz PET-a tijekom liječenja može biti pokazatelj rizika od recidiva i potrebe za dodatnom terapijom. Oko polovicu bolesnika (ili više) koji nisu izliječeni inicijalnom kemoterapijom mogu spasiti visoke doze kemoterapije i transplantacija autolognih matičnih stanica. Brentuksimab vedotin, anti-CD30 konjugat lijekova djelotvoran je kod bolesnika u kojih dođe do recidiva nakon transplantacije.
Zahvaljujući dugotrajnom praćenju postalo je jasno da više bolesnika umire od kasnih fatalnih toksičnih učinaka radioterapije (infarkt miokarda, moždani udar, drugi karcinom) nego od HL. Zračenje je moguće izbjeći primjenom polikemoterapije u ranom stadiju bolesti kao i u uznapredovalom stadiju bolesti.
Opširnije vidi u Longo DL: Malignancies of Lymphoid Cells, Pogl. 134, str. 695; Tefferi A, Longo DL: Less Common Hematologic Malignancies, Pogl. 135e; Munshi NC, Longo DL, Anderson KC: Plasma Cell Disorders, Pogl. 136, str. 710, u HPIM-19.