INTENZIVNO LIJEČENJE INTERNISTIČKIH BOLESNIKA
Organizacija i specifičnosti jedinice intenzivnoga liječenja
Klinički pristup bolesniku u jedinici intenzivnoga liječenja
Farmakoterapija u jedinici intenzivnoga liječenja
Osiguranje krvožilnoga i dišnog puta
Nadzor bolesnika u jedinici intenzivnoga liječenja
Osnove mehaničke ventilacije
Kardiorespiratorni arest
Akutni respiratorni distres sindrom
Masivno krvarenje i hemoragijski šok
Sepsa i septički šok
Kardiogeni i opstruktivni šok
Poremećaji srčanoga ritma u jedinici intenzivnoga liječenja
Akutno jetreno zatajenje i akutni pankreatitis
Anemija, trombocitopenija i koagulopatija kod kritično oboljeloga bolesnika
Adrenalna i tireoidna disfunkcija u jedinici intenzivnoga liječenja
Poremećaj acidobazne ravnoteže
Najznačajniji elektrolitski poremećaji
Sindrom višeorganskoga zatajenja
Akutno otrovanje (intoksikacije)
Rabdomioliza
Poremećaji tjelesne temperature
Sindrom stečene slabosti i načela prehrane u jedinici intenzivnoga liječenja
Literatura
ORGANIZACIJA I SPECIFIČNOSTI JEDINICE INTENZIVNOGA LIJEČENJA
Uvod. Jedinica intenzivnoga liječenja predstavlja specijaliziranu ustrojstvenu jedinicu koja je sa svojim medicinskim osobljem i medicinskom opremom namijenjena zbrinjavanju i liječenju životno ugroženih bolesnika ili bolesnika kod kojih je rizik da će postati životno ugroženi visok. Ona u svojoj osnovi može biti polivalentna ili monovalentna. Polivalentne jedinice intenzivnoga liječenja zbrinjavaju sve životno ugrožene bolesnika bez obzira na njihovu dob ili medicinsko stanje, dok su monovalentne jedinice intenzivnoga liječenja namijenjene liječenju i zbrinjavanju točno određene skupine bolesnika (jedinica intenzivnoga liječenja internističkih, kirurških, neuroloških ili infektoloških bolesnika, pedijatrijska jedinica intenzivnoga liječenja i sl.). Polivalentne jedinice intenzivnoga liječenja nalaze se u manjim (općim) bolnicama, dok se u bolnicama višega ranga ustrojavaju monovalentne jedinice intenzivnoga liječenja. Polivalentne jedinice intenzivnoga liječenja, kao i kirurške jedinice intenzivnoga liječenja, vode anesteziolozi uz suradnji s drugim specijalistima (internist, kirurg, neurolog i sl.), dok u specijaliziranim jedinicama intenzivnoga liječenja liječenje vode odgovarajući specijalisti s užom specijalizacijom iz intenzivne medicine (internist intenzivist, neurolog intenzivist i sl.).
Jedinica intenzivnoga liječenja internističkih bolesnika predstavlja monovalentnu jedinicu intenzivnoga liječenja koja je namijenjena liječenju i zbrinjavanju životno ugroženih internističkih bolesnika, odnosno bolesnika s akutnim zatajenjem unutarnjih organa. Ovisno o ustroju i potrebama, one mogu biti općega karaktera (zbrinjavanje svih internističkih bolesnika) ili mogu biti specijaliziranoga karaktera – usmjerene na jednu grupu bolesnika (pulmološka, koronarna, gastroenterološka i sl.).
Intenzivno liječenje predstavlja multidisciplinarno i multiprofesionalno liječenje koje obuhvaća nadzor, liječenje i održavanje života teško oboljelih bolesnika te čini najvišu razinu zdravstvene i medicinske skrbi (Tablica 3.1.). Takav oblik liječenja zahtijeva poseban angažman i posebno osposobljeno medicinsko osoblje (liječnici, medicinske sestre, perfuzionisti i sl.) te zahtijeva posebne uvjete rada (prostor, oprema), što čini iznimno kompleksan i skup proces kojemu se treba strogo racionalno pristupati. Troškovi liječenja u jedinicama intenzivnog liječenja čine 20 do 30 % ukupnih bolničkih troškova. Korist od intenzivnoga liječenja imaju samo bolesnici kod kojih se očekuje da će poduzete mjere intenzivnoga liječenja pomoći u prevladavanju nastaloga stanja i da će im to produljiti život uz zadovoljavajuću kvalitetu življenja. Primjena intenzivnoga liječenja kod terminalnih (palijativnih) bolesnika kada se zna da mjere intenzivnoga liječenja neće dovesti do izlječenja označava samo produljenje agonije i umiranja te nije opravdano i nije u skladu s kliničkom praksom.
|
Tablica 3.1. Koncept intenzivnoga liječenja
|
- Prepoznavanje ugroženoga bolesnika;
- Stalni nadzor potencijalno ugroženoga bolesnika;
- Prepoznavanje ranih znakova nastupa životne ugroženosti;
- Liječenje i zbrinjavanje stanja koja uvjetuju životnu ugroženost;
- Održavanje životnih funkcija;
- Bolesnik je cijelo vrijeme u središtu pozornosti.
|
Indikacije za intenzivno liječenje. Odluku o prijemu bolesnika u jedinicu intenzivnoga liječenja i primjeni intenzivnoga liječenja donosi liječnik intenzivist na temelju dogovora s liječnikom koji je zatražio prijem i postavio racionalnu indikaciju, s ciljem donošenja najbolje odluke za bolesnika koji je u središtu interesa. Najčešće su indikacije potreba za trajnim nadzorom zbog visokoga rizika od razvoja životno ugrožavajućega stanja (prijeteća respiratorna insuficijencija ili hemodinamski urušaj) ili nastalo stanje životne ugroženosti koje zahtijeva određeni oblik potpore životnim funkcijama (mehanička ventilacija, mehanička cirkulacijska potpora, vazoaktivno liječenje, kontinuirane metode hemodijalize i sl.). Popis najčešćih indikacija za prijem u jedinicu intenzivnoga liječenja internističkoga tipa naveden je u Tablici 3.2.. Neopravdano primanje terminalnih i palijativnih bolesnika koji zahtijevaju intenzivnu njegu u jedinice intenzivnoga liječenja poskupljuje troškove liječenja, povećava stopu unutarbolničkih infekcija i pridonosi razvoju rezistencije na antibiotike, smanjuje krevetni kapacitet za prijem drugih (potrebitijih) bolesnika, a u konačnici dovodi do produljenja umiranja i faze agonije i stoga se treba izbjegavati.
|
Tablica 3.2. Indikacije za prijem u jedinicu intenzivnoga liječenja
|
- Životno ugroženi bolesnici bez obzira na uzrok;
- Bolesnici koji zahtijevaju mehaničku ventilacijsku potporu;
- Bolesnici koji zahtijevaju mehaničku cirkulacijsku potporu;
- Bolesnici u stanju šoka, bez obzira na vrstu šoka;
- Bolesnici u stanju akutne kome;
- Bolesnici nakon uspješne reanimacije;
- Praćenje bolesnika nakon velikih i/ili rizičnih zahvata.
|
Prostor i oprema jedinice intenzivnoga liječenja pripisani su zakonskim odredbama. Prostori u kojima borave bolesnici moraju u skladu s brojem kreveta veličinom udovoljavati normi, a ne bi smjeli sadržavati više od dvanaest kreveta (obično ih je četiri do dvanaest). Svaka jedinica intenzivnoga liječenja trebala bi imati i osiguranu izolaciju, a na šest običnih kreveta dolazi jedan u izolaciji. Koncept intenzivne jedinice mora biti takav da se s jednoga mjesta (centralni pult) mogu promatrati svi bolesnici. Osim prostora u kojemu borave bolesnici, u sastav jedinice intenzivnoga liječenja ulaze i druge prostorije, kao što su prijemna prostorija, prostorija za administraciju, prostorija za odmor osoblja, prostorija za skladištenje pribora i lijekova i sl. Preporuča se da jedinice intenzivnoga liječenja imaju odvojene prostorije za izvođenje malih kirurških zahvata i endoskopskih pretraga, kao i posebnu prostoriju za reanimaciju. Prostori, osobito oni gdje borave bolesnici, trebali bi imati osigurano dnevno svjetlo (pojavnost psihoorganske izmijenjenosti manja je kada je bolesnicima osigurano dnevno svjetlo). Oprema u jedinici intenzivnoga liječenja uključuje centralni dovod plinova i vakuuma, bolesničke krevete za posebne namjene, uređaje za strojnu ventilaciju pluća, odvojene monitore spojene s centralnim monitorom, aparate za sukciju, defibrilatore, opremu za održavanje dišnoga puta, prijenosni ultrazvuk, prijenosni rendgen-aparat i sl.
Medicinsko osoblje. U jedinicama intenzivnoga liječenja naglasak je na timskom radu liječnika intenzivista, medicinskih sestara, perfuzionista, fizioterapeuta te ostaloga osoblja koje dolazi u doticaj s bolesnicima. U zbrinjavanju bolesnika u jedinici intenzivnoga liječenja osim intenzivista sudjeluju i drugi liječnici ovisno o potrebama i stanju bolesnika (konzilijarna služba). Konačnu odluku o smjeru liječenja, primjenjivosti preporučenih postupaka i zahvata donosi liječnik intenzivist izbjegavajući nepotrebne pretrage i postupke te produljenje života pod svaku cijenu. Prema važećemu pravilniku, u jedinici intenzivnoga liječenja potrebno je osigurati jednoga liječnika na 2,5 kreveta te 2,5 sestre na jedan krevet tijekom 24 sata.
S obzirom na sve navedeno, prijem bolesnika u jedinicu intenzivnoga liječenja te započinjanje s mjerama intenzivnoga liječenja trebaju biti strogo i racionalno indicirani, i to za bolesnike kod kojih se očekuje da će navedene mjere liječenja rezultirati poboljšanjem i oporavkom njihovoga kliničkog stanja.
KLINIČKI PRISTUP BOLESNIKU U JEDINICI INTENZIVNOGA LIJEČENJA
Uvod. Intenzivno liječenje podrazumijeva zbrinjavanje i liječenje životno ugroženih bolesnika, odnosno bolesnika koji imaju razvijene bolesti i stanja koja neposredno mogu dovesti do prestanaka rada srca i disanja, odnosno razvoja kardiorespiratornoga aresta. Pristup takvim bolesnicima nosi svoje specifičnosti, bilo u pogledu dobivanja podataka o bolesniku i bolesti (primljeni bolesnici često su bez svijesti i bez pratnje), bilo u pogledu kliničkoga pregleda. Anamneze bolesnika moraju biti kratke, jasne i koncizne, a klinički pregled brz i sveobuhvatan, osobito ako se radi o životno ugroženome bolesniku u postupku stabilizacije. Inicijalni pregled bolesnika (ABCDE pristup) kasnije se nadopunjava redovnim kontrolnim pregledima koji omogućuju praćenje i uočavanje novih kliničkih pojavnosti.
INICIJALNI PREGLED ŽIVOTNO UGROŽENE OSOBE: ABCDE PRISTUP
Uvod. Pristup životno ugroženome bolesniku zahtijeva cjelovit, brz i uniformiran pristup kojime se otkrivaju najznačajnija stanja koja neposredno ugrožavaju život i zahtijevaju trenutno rješavanje, odnosno zbrinjavanje. Navedeni pristup naziva se ABCDE pristup (engl. airway, breathing, circulation, disability, exposition), a primjenjuje se pri inicijalnom kontaktu s osobom bez svijesti, kao i nakon svake promjene kliničkoga stanja životno ugrožene osobe.
Osnovni princip ABCDE pristupa. ABCDE pregled služi u prvom redu za inicijalnu kliničku procjenu bolesnika bez svijesti, pri čemu se procjenjuje prisutnost ugroženosti osnovnih životnih funkcija (disanje, rad srca) uz istodobnu primjenu postupaka kojima se oni zbrinjavaju. Provođenje ABCDE pregleda koristi se i pri daljnjemu postupanju s bolesnikom, osobito ako je došlo do promjena u njegovom kliničkom stanju. Kako se radi o stupnjevitom pristupu, potrebno je zbrinuti svaki poremećaj prije prelaska na sljedeći korak uz procjenu učinkovitosti provedenih postupaka.
A (engl. airway) – dišni put. Prvi korak u ABCDE pristupu podrazumijeva zbrinjavanje dišnoga puta. Znakovi koji ukazuju na ugroženost dišnoga puta su fenomen klackalice, upotreba pomoćne respiratorne muskulature pri disanju te prisutnost centralne cijanoze. Kod potpune opstrukcije dišnoga puta disanje je u potpunosti odsutno, dok je kod djelomične opstrukcije prisutno bučno (glasno) disanje. Ako se uoče znakovi koji ukazuju na ugroženost dišnoga puta, primjenjuju se neki od sljedećih postupaka: jednostavne mjere otvaranja dišnoga puta (zabacivanje glave, podizanje donje čeljusti), sukcija dišnoga puta, primjena pomagala kao što su orofaringelani ili nazofaringelani tubus, supraglotična pomagala ili, u krajnjoj liniji, endotrahealna intubacija. Tek nakon što se zbrine dišni put prelazi se na sljedeći korak.
B (engl. breathing) – disanje. Nakon što je zbrinut dišni put potrebno je potražiti znakove neodgovarajućega disanja koji mogu uključivati sljedeće: 1) inspekcija (cijanoza, upotreba pomoćne muskulature, oznojenost, trbušno disanje, deformacije prsnoga koša koje ugrožavaju disanje); 2) slušanje zvučnih fenomena (hropci koji upućuju na sekret u dišnim putevima, inspiratorni stridor kod opstrukcija gornjih dišnih puteva te wheezing kod opstrukcija donjih puteva); 3) auskultacija pluća (oslabljeni disajni šum, odsutno disanje, bronhalni zvižduci, krepitacije, vlažni hropci); 4) perkusija prsnoga koša (hipersonoran zvuk kod pneumotoraksa i hiperinflacije, muklina iznad izljeva ili konsolidacije); 5) palpacija prsnoga koša (procjena stabilnosti prsnoga koša i respiratorne pomičnosti, subkutani emfizem i krepitacije kože prsnoga koša), 6) procjena frekvencije disanja (normalno 12 - 20/min) te pulsna oksimetrija (bilježiti koncentraciju kisika). Postupci koji se primjenjuju kod bolesnika s prisutnim znakovima neodgovarajućega disanja su oksigenoterapija (primjena kisika kroz masku ili nazalni kateter) za bolesnike koji imaju respiracije dovoljne dubine i uredne frekvencije, dok se kod ostalih (težih) bolesnika mora primijeniti neki oblik asistiranoga disanja (ventilacija samoširećim balonom, mehanička ventilacija).
C (engl. circulation) – cirkulacija. Nakon zbrinjavanja dišnoga puta i disanja procjenjuje se stanje cirkulacije, odnosno bolesnika se pregleda s ciljem pronalaska znakova neodgovarajuće cirkulacije: 1) inspekcija (blijeda, cijanotična ili marmorizirana koža, distenzija ili kolaps vratnih vena, prisutnost vanjskoga krvarenja); 2) procjena kapilarnoga punjenja (pritisak na kožu u/ili neposredno iznad razine srca kroz pet sekundi te procjena vraćanja boje – normalno vrijeme iznosi dvije do tri sekunde, produljeno vrijeme ukazuje na neodgovarajuću perfuziju); 3) palpacija perifernoga i centralnog pulsa (prisutni/odsutni, ocjena punjenosti pulsa, procjena frekvencije pulsa); 4) auskultacija srca (prisutnost srčane akcije, ritmičnost, šumovi, jačina tonova, perikardijalno trenje); 5) mjerenje krvnoga tlaka (sniženi dijastolički ukazuje na vazodilataciju, npr. kod anafilaksije i sepse, dok suženi raspon između vrijednosti sistoličkoga i dijastoličkog tlaka ukazuje na vazokonstrikciju, npr. kod hipovolemije, kardiogenoga šoka ili tahiaritmije). Srčanu frekvenciju i krvni tlak kod ovih je bolesnika potrebno provjeravati svakih pet minuta. Osnovni postupci kod bolesnika s neodgovarajućom cirkulacijom su postavljanje jednoga ili više venskih puteva te primjena intravenske infuzije (500 ml fiziološke otopine u brzom intravenskom bolusu, uz ponavljanje prema potrebi). Što prije treba snimiti i 12-kanalni elektrokardiogram.
D (engl. disability) – brza neurološka procjena. Nakon osnovnih postupaka zbrinjavanja dišnoga puta, disanja i cirkulacije potrebno je procijeniti neurološko stanje bolesnika. Brza procjena neuroloških poremećaja uključuje sljedeće komponente: 1) provjera stanja svijesti AVPU metodom (od engl. alert – budan, vocal – budi se na poziv, painful – odgovara na bolni podražaj, unresponsive – bez odgovora); 2) pregled zjenica (položaj, oblik, veličina, simetričnost, reakcija zjenica na svjetlosne podražaje); 3) prepoznavanje neurološkoga deficita (provjera motorike i tonusa ekstremiteta, Babinski refleks, spontani pokreti); 4) određivanje koncentracije glukoze (hipoglikemija može imati sliku akutnoga neurološkog zbivanja) te 5) provjera lijekova koje je bolesnik uzimao (zbog mogućnosti poremećaja svijesti uzrokovanoga lijekovima). Primjena ranije opisanih postupaka pri zbrinjavanju dišnoga puta, disanja i cirkulacije također djeluje i poboljšava perfuziju mozga. Ukoliko nema kontraindikacija, komatoznoga je bolesnika potrebno staviti u bočni položaj i liječiti hipoglikemiju ako je prisutna.
E (engl. exposure) – izloženost. U konačnici, nakon prethodno opisanoga pregleda i zbrinjavanja, potrebno je razodjenuti bolesnika zbog boljega pregleda i uočavanja drugih patoloških promjena.
ANAMNEZA I KLINIČKI PREGLED BOLESNIKA U JEDINICI INTENZIVNOGA LIJEČENJA
Anamneza. Anamneze bolesnika u jedinici intenzivnoga liječenja moraju biti napisane tako da budu obuhvaćene sve glavne informacije o bolesniku s naglaskom na trenutnoj bolesti te simptomima i znakovima koji su prethodili sadašnjem stanju. Moraju biti jednostavno strukturirane, jasne, koncizne i ne preduge, kako bi osigurale brzo dobivanje potrebnih informacija o bolesniku i njegovom stanju, što je ponekad od presudnoga značaja u hitnom zbrinjavanju. Izvor anamnestičkih podataka u jedinici intenzivnoga liječenja može biti sam bolesnik, ako je pri svijesti i u kontaktu, dok se kod bolesnika bez svijesti i kontakta potrebno pouzdati u podatke dobivene od medicinskoga osoblja koje bolesnika dovodi u jedinicu intenzivnoga liječenja te u postojeću medicinsku dokumentaciju, kao i podatke naknadno dobivene od obitelji ili skrbnika. Anamnezom moraju biti obuhvaćeni osnovni podaci: 1) prijašnje bolesti, zahvati i hospitalizacije; 2) kronična terapija koju bolesnik uzima; 3) postojanje alergija (osobito na lijekove); 4) bolesnikove navike (alkoholizam, ovisnost); 5) detaljna klinička slika koja je prethodila trenutnome stanju (trenutna bolest) te 6) tijek bolesti, dijagnostičkih postupaka i liječenja neposredno prije prijema u jedinicu intenzivnoga liječenja. Posebna pitanja koja se nameću kod bolesnika primljenih u jedinicu intenzivnoga liječenja su i bolesnikovi osobni stavovi o mjerama održavanja života na aparatima i reanimacijskom postupku, darivanju organa, primanju krvi, odnosno krvnih pripravaka i sl., kao i pitanje o davanju informacija drugim osobama.
Klinički pregled bolesnika u jedinici intenzivnoga liječenja obavlja se najmanje tri puta tijekom dana, a prema potrebi i češće. Svaki pregled treba upisati na temperaturnu listu, odnosno reanimacijski list. Pregledom bi trebali biti obuhvaćeni svi organski sustavi, a sastoji se od klasičnih metoda: inspekcija, auskultacija, palpacija te perkusija.
Koža i sluznice. Pregled kože i sluznice uključuje procjenu boje i prokrvljenosti kože (normalna, cijanotična, blijeda, ikterična) i turgora kože (oslabljeni turgor kože prisutan je kod starih i dehidriranih bolesnika) te uočavanje znakova hemoragijske dijateze (petehije, ekhimoze, hematomi).
Središnji živčani sustav. Neurološka procjena bolesnika u jedinici intenzivnoga liječenja sastoji se od procjene stanja svijesti (pozivanje i reakcija bolesnika, GCS skala), pregleda zjenica (veličina, simetričnost, fotoreaktibilnost), ispitivanja znakova funkcije moždanoga debla (trahealni refleks, reakcija na bolni podražaj, kornealni refleks, vestibulo-okularni refleks) te uočavanja žarišnih neuroloških deficita (najčešće se uočavaju na udovima, teže se izvodi kod komatoznih bolesnika, ispitivanje refleksa).
Srčano-žilni sustav. Procjenu srčano-žilnoga sustava obavlja se klasičnim metodama fizikalnoga pregleda: 1) inspekcija (prokrvljenost kože i sluznica, punoća vratnih vena, periferni edemi, ascites); 2) palpacija (frekvencija i kvaliteta pulsa, palpacija iktusa, hepato-jugularni refluks); 3) auskultacija (ritmičnost frekvencije, srčani šumovi, jačina tonova, perikardijalno trenje) te 4) praćenje diureze (dostatni minutni volumen osigurava zadovoljavajuću perfuziju bubrega i diurezu).
Dišni sustav. Metode pregleda dišnoga sustava uključuju inspekciju (pomičnost prsnoga koša, boja kože, položaj tubusa kod intubiranih), auskultaciju (provjera šuma disanja obiju strana, patološki šumovi i fenomeni) te perkusiju (hipersonoran zvuk, muklina). Kod strojno ventiliranih bolesnika potrebna je provjera parametara respiratora te procjena bolesnikove tolerancije na strojnu ventilaciju i tubus (procjena potrebe za sedacijom).
Bubrežna funkcija. Fizikalne metode praćenja bubrežne funkcije uključuju procjenu diureze (satna diureza mora biti veća od 30 ml), praćenje boje urina (smeđa kod mioglobinurije, tamnocrvena kod hematurije, pojava ugrušaka ili svježe krvi) te usporedba unesene tekućine s diurezom (bilanca).
Probavni sustav. Pri pregledu organa probavnoga sustava koriste se inspekcija (obloženost jezika, ulceracije od tubusa i nazogastrične sonde, distenzija trbuha, inkarceracija hernije, ikterus), palpacija (palpatorna osjetljivost abdomena, peritonealni podražaj), perkusija (procjena ascitesa ili meteorizma kod distendiranoga trbuha) te auskultacija (procjena peristaltike).
Ultrazvučni pregled kao nadopuna kliničkome pregledu. Danas se pri pregledu bolesnika sve češće koristi ultrazvuk, čemu pridonosi tehnološki napredak kojime ultrazvučni aparati i sonde postaju sve manji i dostupniji. Dodatne su prednosti to što se pregled izvodi brzo, uz krevet bolesnika i može se višekratno ponavljati. On nam omogućuje brzu procjenu srčane funkcije i utvrđivanje postojanja perikardijalnoga izljeva, prisutnosti plućnoga edema ili plueralnoga izljeva, dilatacije kanalnoga sustava bubrega, prisutnosti slobodne tekućine u trbuhu i sl.
FARMAKOTERAPIJA U JEDINICI INTENZIVNOGA LIJEČENJA
U ovome će poglavlju biti opisane specifičnosti primjene lijekova u jedinici intenzivnoga liječenja koje se odnose na analgeziju, sedaciju, neuromuskularnu relaksaciju, vazoaktivno i antimikrobno liječenje te primjenu inzulina i regulaciju glikemije.
ANALGEZIJA
Uvod. Bol je prisutan kod gotovo svih bolesnika smještenih u jedinicu intenzivnoga liječenja. Osim naravi same bolesti, taj bol može biti uvjetovan i drugim čimbenicima, kao što su potpuno mirovanje, često izvođenje različitih invazivnih i neinvazivnih dijagnostičko-terapijskih postupaka, stalna prisutnost stranih različitih stranih tijela (kateteri, endotrahealni tubus, kanile, drenovi) i sl.
Procjena boli. Bolesnici koji su pri svijesti i u kontaktu mogu verbalizirati i upozoravati na prisutnost osjeta bola, no bolesnici koji su suženoga stanja svijesti ili je kontakt s njima onemogućen ili nezadovoljavajuć ne mogu upozoriti na bolnost te se kod njih potrebno osloniti na druge metode procjene bola. Danas se u tu svrhu najčešće koristi tzv. bihevioralna ljestvica bola kojom se prisutnost i ocjena težine bola procjenjuje na temelju promatranja ponašanja bolesnika (Tablica 3.3.), dok se promjene u vitalnim znacima (tahikardija, hipertenzija) ne mogu smatrati odgovarajućim pokazateljem bolnosti kod takvih bolesnika.
|
Tablica 3.3. Bihevioralna ljestvica bola kod bolesnika na mehaničkoj ventilaciji
|
|
Promatranje izraza lica
|
Promatranje pokreta gornjih udova
|
Usuglašenost s ventilacijom
|
|
Relaksirani izgled
Djelomično u grču
U potpunosti u grču
Bolne grimase
|
1
2
3
4
|
Bez pokreta
Nepotpuno savijanje ruku
Savijanje ruku u potpunosti
Stalno savijene ruke
|
1
2
3
4
|
Potpuna tolerancija ventilacije
Povremeno nakašljavanje
Borba s ventilacijom
Nemogućnost ventilacije
|
1
2
3
4
|
|
Interpretacija: 3 (bez bolova), 4 - 5 (umjeren, prihvatljiv bol), 6 - 12 (izražen bol)
|
| |
|
|
|
|
|
Analgezija predstavlja neizostavan dio liječenja bolesnika u jedinici intenzivnoga liječenja bez obzira na stanje svijesti i ona treba predstavljati sastavni dio terapijskoga protokola, osobito prije i nakon izvođenja invazivnih postupaka (punkcije, endoskopije i sl.). Na raspolaganju su neopioidni i opidioni analgetici.
Neopioidni anagletici, iako ih se često koristi u jedinicama intenzivnoga liječenja, uspijevaju kupirati samo blag do umjeren bol, zbog čega bi se njihova primjena trebala ograničiti samo na bolesnike s umjerenim bolom. Dodatan je ograničavajući čimbenik njihova dostupnost u oblicima za intravensku primjenu. Neopioidni analgetici mogu se dodavati opioidnim analgeticima za kupiranje najjačih bolova. Najčešće korišten neopioidni analgetik u jedinici intenzivnoga liječenja je paracetamol.
Paracetamol osim analgetskoga posjeduje i antipiretski učinak, zbog čega se često koristi u kliničkoj praksi. Intravenska primjena preporuča se samo za bolesnike koji lijek ne mogu uzeti enteralnim putem (peroralno, rektalno). Za razliku od nesteroidnih protuupalnih lijekova, paracetamol ne posjeduje protuupalno djelovanje, pa je manje učinkovit u kupiranju bolova koji nastaju kao rezultat sistemske ili lokalizirane upale. Maksimalna dnevna doza ograničena je na 4 grama zbog potencijalnoga hepatotoksičnog učinka.
Opioidni analgetici redstavljaju prvi izbor za kupiranje bolova kod kritično oboljelih bolesnika. Opioidi predstavljaju prirodne derivate opijuma koji svoj analgetski učinak ostvaruju stimulacijom opioidnih receptora u središnjem živčanom sustavu. Osim analgezije, oni posjeduju i sedativni te anksiolitički učinak, što dodatno povoljno djeluje na ove bolesnike. Najčešće korišteni opioidni analgetici u intenzivnom liječenju su morfin, fentanil, remifentanil i tramadol.
Morfin je najstariji opioidni analgetik koji ostvaruje analgetski učinak bilo izravnom stimulacijom opioidnih receptora, bilo neizravnom stimulacijom putem aktivnih metabolita na koje se razgrađuje, koji se izlučuju iz organizma putem bubrega. Zbog toga je potreban oprez prilikom primjene morfina kod bolesnika s oštećenom funkcijom bubrega, zbog mogućnosti akumulacije i intoksikacije (u takvim se slučajevima primjenjuje polovična doza lijeka). Morfin dovodi i do otpuštanja histamina zbog čega dolazi do sistemske vazodilatacije i posljedične hipotenzije. Nakon parenteralne primjene učinak lijeka vidi se kroz pet do deset minuta, a preporučena doza je 2 do 4 mg i može ju se ponavljati svakih sat do dva sata. Hidromorfon predstavlja derivat morfina koji se ne metabolizira u aktivne metabolite te se može davati i bolesnicima s oštećenom bubrežnom funkcijom bez bojazni od akumulacije.
Fentanil je najčešće korišten opioidni analgetik u jedinici intenzivnoga liječenja zbog svojih superiornijih karakteristika u odnosu na morfin: brži početak djelovanja (1 - 2 minute), manji rizik od nastanka hipotenzije (ne izaziva histaminsko oslobađanje) te odsutnost razgradnje na aktivne metabolite. Glavni nedostatak toga lijeka njegova je tendencija nakupljanja u mozgu i masnom tkivu, što se događa kod bolesnika koji ga primaju kroz dulji vremenski period, a to može postati uzrokom produljenoga sedativnog učinka. Fentanil se primjenjuje intravenski u obliku bolusa (0,035 - 0,5 mcg/kg svakih pola sata do sat) ili u obliku kontinuirane infuzije (0,5 - 2 mcg/sat).
Remifentanil je po svojim farmakodinamskim karakteristikama sličan fentanilu, ali imaju značajno različitu farmakokinetiku. Remifentanil karakterizira kratak period terapijskoga učinka zbog brze razgradnje od strane plazmatskih esteraza, zbog čega se mora primjenjivati u obliku kontinuirane intravenske infuzije: najprije se primjenjuje bolus od 1,5 mcg/kg nakon čega slijedi kontinuirana primjena u dozi od 0,5 do 15 mcg/kg/sat. Nakon obustave primjene lijeka učinak remifentanila gubi se kroz osam do deset minuta. Zbog toga je remifentanil izuzetno koristan kod bolesnika s patologijom središnjega živčanog sustava jer omogućava odgovarajuću procjenu neurološkoga stanja. Osim remifentanila, sličan učinak imaju i sufentanil i alfentanil.
Glavne nuspojave prethodno navedenih opioidnih analgetika su depresija centra za disanje, značajna hipotenzija i bradikardija, retencija urina i hipomotilitet crijeva te mučnina i povraćanje. Navedene nuspojave rijetko su prisutne ako se lijekovi primjenjuju u preporučenim dozama.
Tramadol predstavlja često korišten opioidni analgetik koji ima slabije izražen analgetski učinak, ali nosi manji rizik od nastanka depresije centra za disanje te izražene hipotenzije zbog čega je poželjniji za primjenu kod ove skupine bolesnika. Poboljšanje analgetskoga učinka postiže se kombinacijom tramadola s nekim od neopioidnih analgetika, kao što je paracetamol. Preporučena dnevna doza tramadola je 600 mg, a najčešće su nuspojave mučnina i povraćanje zbog čega se često daje zajedno s antiemetikom (metoklopramid).
SEDACIJA
Uvod. Anksioznost, agitiranost i delirij prisutni su kod velikoga broja bolesnika liječenih u jedinici intenzivnoga liječenja, što je dijelom posljedica unutarnjega psihičkog nemira i zabrinutosti uz često zanemaren osjećaj boli, a dijelom je posljedica same bolesti (hipoksija, apstinencija). Bolesnici su pri tome često motorički agitirani što dodatno otežava njihov boravak i liječenje u intenzivnoj jedinici (čupanje intravenskih kanila, urinarnoga katetera, ekstubacija i sl.). Iz tih razloga sedacija predstavlja, uz analgeziju, jedan od bitnijih terapijskih postupaka koji bolesnicima olakšavaju boravak u jedinici intenzivnog liječenja, a osigurava i lakše provođenje određenih terapijskih postupaka (npr. mehaničke ventilacije). Procjena sedacije i agitacije vrši se na temelju različitih skala, a jedna od najčešće korištenih je SAS-ljestvica (engl. sedation-agitation scale) prikazana u Tablici 3.4.
|
Tablica 3.4. SAS-ljestvica za procjenu sedacije i agitiranosti u kritično oboljelih osoba
|
|
Stupanj
|
Stanje bolesnika
|
Ponašanje bolesnika
|
|
1. stupanj
|
Nije u kontaktu
|
Minimalan odgovor na mehanički (bolni) podražaj
|
|
2. stupanj
|
Izrazito sediran
|
Budi se na bolni podražaj, ne izvršava naloge
|
|
3. stupanj
|
Sediran
|
Teško surađuje, izvodi jednostavne naloge, budi se na grublji poziv
|
|
4. stupanj
|
Miran
|
Lako se budi, surađuje
|
|
5. stupanj
|
Nemiran
|
Agitiran, smiruje se na naređenje
|
|
6. stupanj
|
Izrazito nemiran
|
Agitiran, ne smiruje se na naređenje, grize tubus
|
|
7. stupanj
|
Nemiran, opasan za sebe i okolinu
|
Povlači katetere i cijevi, udara osoblje
|
Najčešće korišteni sedativi u jedinici intenzivnoga liječenja su haloperidol, benzodiazepini, hipnotici (propofol, tiopenton, ketamin, etomidat) te deksmedetomin.
Haloperidol predstavlja antipsihotik prve generacije koji postiže psihomotornu sedaciju blokiranjem dopaminskih (D2) receptora u središnjem živčanom sustavu, a posjeduje i nisku α-1 antiadrenergičku aktivnost. Lijek se primjenjuje u obliku intravenskoga bolusa, a doza ovisi o težini psihomotorne agitacije: kod blage se daje 0,5 do 2 mg, kod srednje teške 5 do 10 mg, a kod teške 10 do 20 mg. Učinak se očekuje kroz 10 do 20 minuta. Za održavanje postignute sedacije nastavlja se njegova intravenska primjena u dozi koja iznosi jednu četvrtinu inicijalne doze, a ponavlja se svakih šest sati. Prednost haloperidola naspram drugih sedativa njegov je slab učinak na respiracijski centar, zbog čega je koristan u procesu odvikavanja bolesnika od mehaničke ventilacije. Glavne nuspojave primjene haloperidola su ekstrapiramidni sindrom (rigidnost, spastički pokreti), maligni neuroleptički sindrom te prolongacija QT-intervala koja može dovesti do pojave malignih ventrikularnih aritmija.
Benzodiazepini su najčešće korišteni lijekovi za postizanje sedacije u jedinici intenzivnoga liječenja, iako se njihova primjena postupno napušta zbog sklonosti akumulaciji i produljenoga učinka. Sedacijski učinak postižu vezanjem za γ-aminomaslačne receptore (GABAA) smještene u središnjem živčanom sustavu. Benzodiazepini najčešće korišteni u te svrhe su midazolam i lorazepam, dok se primjena diazepama ne preporuča zbog prolongiranoga učinka.
Midazolam je benzodiazepin brzoga i kratkog djelovanja koji svoj učinak ostvaruje već nakon jedne do dvije minute od intravenske primjene, a traje jedan do dva sata zbog čega se pri potrebi dulje sedacije mora primjenjivati u obliku kontinuirane intravenske infuzije. Zbog svoje izražene liposolubilnosti kod duže kontinuirane intravenske primjene može dovesti do akumulacije u masnom i drugim tkivima, stoga se njegova intravenska primjena preporuča tijekom perioda od najviše 48 sati. Lijekovi koji se metaboliziraju putem sustava citokroma P450 (diltiazem, eritromicin), kojime se metabolizira i midazolam, pri istodobnoj primjeni s midazolamom mogu dovesti do njegova pojačana učinka. Također, oštećena funkcija bubrega može rezultirati pojačanim i produljenim učinkom midazolama s obzirom na to da se određeni aktivni metaboliti midazolama luče putem bubrega. Preporučena inicijalna bolusna doza midazolama iznosi 0,01 do 0,05 mg/kg nakon čega slijedi kontinuirana intravenska primjena u dozi od 0,02 do 0,1 mg/kg/sat (intermitentna bolusna sedacija midazolamom se ne preporuča).
Lorazepam je benzodiazepin dužega djelovanja od midazolama koji se može primjenjivati u obliku opetovanih intravenskih bolusa ili kontinuiranom infuzijom. Nakon intravenske primjene učinak ostvaruje kroz 5 do 20 minuta, a traje oko šest sati što mu omogućava propilen glikol koji služi kao otapalo koje povećava topljivost lijeka u plazmi. Lorazepam nema aktivnih metabolita koji se luče putem bubrega pa se može primjenjivati kod bolesnika s oštećenom funkcijom bubrega bez posebnih mjera opreza. Početna bolusna doza lorazepama iznosi 0,02 do 0,04 mg/kg (maksimalno 2 mg) nakon čega slijedi intravenska infuzija u dozi od 0,01 do 0,1 mg/kg/sat (maksimalno 10 mg/sat). Navedene maksimalne doze lijeka navedene su zbog sprečavanja toksičnoga učinka propilen glikola, a ne samoga lorazepama. U slučaju intermitentne sedacije lorazepam se primjenjuje u dozi od 0,02 do 0,06 mg/kg svakih dva do šest sati.
Osim sedativnoga, benzodiazepini mogu imati i druge učinke, kao što su anterogradna amnezija (ovisna o dozi), antikonvulzivan učinak te djeluju dobro u liječenju apstinencijskih sindroma (alkohol, opijati). Glavni su nedostaci benzodiazepina akumulacija u tkivima pri dužoj intravenskoj primjeni što dovodi do produljenoga sedacijskog učinka, a osobito je to izraženo kod primjene diazepama i midazolama. Primjena visokih doza lorazepama može biti uzrokom pojave toksičnoga učinka propilen glikola koji se u jetri pretvara u laktate te može uzrokovati laktacidozu. Nagao prekid primjene benzodiazepina može dovesti do nagloga pogoršanja i ponovne pojave psihomotornih simptoma. Respiratorna depresija pri primjeni benzodiazepina viđa se samo kod njihove primjene u većim dozama. Benzodiazepinski antidot je flumazenil koji se primjenjuje u dozi od 0,2 do 1 mg. Učinak mu traje do sat vremena zbog čega se ponekad mora opetovano primjenjivati.
Propofol je opći anestetik kratkoga djelovanja koji se često koristi za sedaciju u jedinici intenzivnoga liječenja, osobito pri izvođenju kraćih postupaka (npr. endotrahealna intubacija), a može se koristiti i za dulju sedaciju, od nekoliko dana. Učinak ostvaruje modulacijom inhibitorne funkcije inhibitornoga neurotransmitera GABA-e. Propofol osim sedacijskoga posjeduje i amnestički učinak, ali nema analgetsko djelovanje. Karakterizira ga brz početak djelovanja (kroz jedne minute) i učinak trajanja od 10 do 15 minuta, zbog čega se kod potrebe za dužom sedacijom primjenjuje kao kontinuirana intravenska infuzija. Dodatan povoljni učinak propofola sniženje je intrakranijskoga tlaka zbog čega se preporuča za sedaciju bolesnika s edemom mozga i povišenim intrakranijskim tlakom. Propofol dolazi u lipidnoj emulziji koja povećava njegovu topljivost u plazmi, a doziranje se određuje prema tjelesnoj težini i to prema idealnoj, a ne stvarnoj. Inicijalna intravenska doza propofola u svrhu sedacije iznosi 25 mcg/kg kroz 5 minuta, a zatim se nastavlja dozom od 5 do 50 mcg/kg/min. Glavne su nuspojave depresija centra za disanje (primjena kod bolesnika na mehaničkoj ventilaciji), kardiocirkulatorna depresija uslijed sistemske vazodilatacije (izbjegavati primjenu u hipovolemiji i srčanom zatajenju), hipertrigliceridemija (zbog lipida iz emulzije), anafilaktička reakcija te rijetko, propofolski sindrom koji je povezan s dugotrajnom primjenom propofola. Propofolski sindrom karakteriziraju bradikardija, hipotenzija, laktacidoza i akutno bubrežno oštećenje, a stopa smrtnosti iznosi i do 30 %. Kako bi se izbjegla njegova pojava, ne preporuča se primjena propofola u infuziji bržoj od 5 mg/kg/sat duže od 24 do 48 sati.
Deksmedetomidin predstavlja selektivni α2 adrenergički agonist koji posjeduje sedativan, amnestički i umjeren analgetski učinak bez depresijskoga učinka na centar za disanje. Glavna i osnovna prednost toga lijeka postizanje je budnoga stanja vrlo brzo po ukidanju njegove primjene. Početna intravenska doza deksmedetomidina iznosi 1 mcg/kg kroz deset minuta, a zatim se nastavlja kontinuiranom primjenom u dozi od 0,2 do 0,7 mcg/kg/sat. Nakon obustave primjene potpuno buđenje bolesnika očekuje se kroz pet do deset minuta. Najčešće nuspojave primjene toga lijeka su hipotenzija i bradikardija (simpatolitički učinci), što je naglašeno kod bolesnika sa srčanim popuštanjem ili hipovolemijom.
NEUROMIŠIĆNA RELAKSACIJA
Uvod. Neuromišićna relaksacija podrazumijeva primjenu neuromuskulatornih blokatora koji onemogućavaju depolarizaciju mišićnih stanica dovodeći ih u stanje relaksacije. Ovisno o načinu blokade neuromišićne transmisije, razlikuju se depolarizirajuće i nepolarizirajuće neuromišićne relaksanse. Osnovni preduvjet mišićne relaksacije osiguravanje je odgovarajuće sedacije bolesnika jer mišićni relaksansi dovode do paralize, ali ne i anestezije te relaksacija ne označava stanje bez svijesti.
Indikacije. Rutinska primjena neuromišićne relaksacije kod bolesnika u jedinici intenzivnoga liječenja nije opravdana te se ograničava na nekoliko indikacija: 1) olakšavanje postupka endotrahealne intubacije; 2) olakšavanje mehaničke ventilacije bolesnika s akutnim respiratornim distres sindromom; 3) snižavanje intrakranijskoga tlaka kod bolesnika s intrakranijskom hipertenzijom te 4) kontrola mišićnih grčeva kod bolesnika s tetanusom.
Depolarizirajući neuromuskularni blok. Sukcinil-kolin predstavlja glavni depolarizirajući neuromuskularni relaksans. Fizički nalikuje na molekulu acetilkolina te se veže za acetilkolinske receptore dovodeći do depolarizacije i kontrakcije skeletnih mišića, ali za razliku od acetilkolina, ostaje vezan za acetilkolinski receptor kroz dulji period uzrokujući prolongiranu depolarizaciju pri čemu se javlja mišićna paraliza. Zbog svoga se brzoga (1 minuta) i kratkog djelovanja (4 do 5 minuta) sukcinil-kolin najčešće koristi pri endotrahealnoj intubaciji. Primjenjuje se u dozi od 1 do 2 mg/kg nakon čega nastupaju mišićne fascikluacije (asinkrone kontrakcije mišićinih vlakana) nakon čega mišići postaju paralizirani. Najznačajnija nuspojava primjene sukcinil-kolina razvoj je hiperkalijemije, a mehanizam kojime to izaziva nije poznat. Učestalost hiperkalijemije nakon primjene sukcinil-kolina veća je kod bolesnika s opeklinama, opsežnim kontuzijama i teškim abdominalnim infekcijama i to ako se primjenjuje tri do pet dana nakon nastupa bolesti, pa je potreban pojačan oprez. Druge nuspojave uključuju povišenje intraokularnoga i intrakranijalnog tlaka, prolongiranu paralizu (bolesnici s deficitom plazmatske kolinesteraze koja razgrađuje lijek) te malignu hipertermiju.
Nedepolarizirajući neuromuskularni blok. Lijekovi koji dovode do nedepolarizirajućega neuromuskularnog bloka djeluju kao kompetitivni antagonisti acetilkolinskih receptora što znači da se vežu za njih, ali ih ne aktiviraju, odnosno izostaje depolarizacija. Ove lijekove prema kemijskoj strukturi dijelimo u dvije osnovne skupine: steroidi (pankuronij, pipekuronij, vekuronij, rokuronij) te benzilizokinoloni (metokurin, atrakurij, cisatrakurij, mivakurij). Osnovne doze i trajanje relaksacije tim lijekovima prikazane su u Tablici 3.5.
|
Tablica 3.5. Najčešći nedepolarizirajući relaksansi u kliničkoj praksi
|
|
Lijek
|
Inicijalna doza
|
Trajanje djelovanja
|
Doza održavanja
|
Potpuni oporavak
|
|
Pankuronij
|
0,06 - 0,1 mg/kg
|
90 - 100 min
|
1 - 2 mcg/kg/min
|
120 - 180 min
|
|
Vekuronij
|
0,08 - 0,1 mg/kg
|
35 - 45 min
|
0,8 - 1,2 mcg/kg/min
|
45 - 60 min
|
|
Rokuronij
|
0,6 - 1 mg/kg
|
30 min
|
10 - 12 mcg/kg/min
|
20 - 30 min
|
|
Atrakurij
|
0,4 - 0,5 mg/kg
|
25 - 35 min
|
4 - 12 mcg/kg/min
|
40 - 60 min
|
|
Cistarkurij
|
0,1 - 0,2 mg/kg
|
45 - 60 min
|
2,5 - 3 mcg/kg/min
|
90 min
|
|
Mivakurij
|
0,15 - 0,25 mg/kg
|
10 - 20 min
|
9 - 10 mcg/kg/min
|
10 - 20 min
|
|
Doksakurij
|
0,025 - 0,05 mg/kg
|
120 - 150 min
|
0,3 - 0,5 mcg/kg/min
|
120 - 180 min
|
Reverzija bloka. Kako se učinak nedepolarizirajućih neuromišićnih blokatora ostvaruje kroz duži vremenski period, ponekad je potrebna farmakološka reverzija njihova učinka. Ona se ostvaruje primjenom inhibitora acetilkolin esteraze, kao što je neostigmin, u dozi od 0.04 - 0.08 mg/kg, čime se povećava koncentracija acetilkolina u sinaptičkoj pukotini. Kako je primjena neostigmina povezana s razvojem muskarinskih učinaka (bradikardija, hipersalivacija, bronhospazam, mioza), istodobno se primjenjuje i atropin (u jednu se špricu pomiješa 1 mg atropina s 2,5 mg neostigmina što iznosi prosječnu dozu za osobu od 70 kg). Noviji lijek koji se može koristiti u reverziji neuromuskularne blokade je sugamadeks koji ima jači učinak od neostigmina, ali bez popratnih muskarinskih nuspojava.
Komplikacije mišićne relaksacije. Dvije tipične komplikacije mišićne relaksacije su produljena relaksacija nakon prekida primjene lijeka te sindrom akutne kvadriplegične miopatije. Produljena relaksacija definira se kao mišićna slabost u trajanju 50 do 100 % dulje od predviđenoga vremena oporavka, a tumači se nakupljanjem lijeka u neuromišićnoj spojnici zbog čega ostvaruje dulji učinak. Ta komplikacija zahtijeva dulji nadzor bolesnika do potpunoga prekida učinka blokade. Sindrom akutne kvadriplegične miopatije ili postrelaksacijska kvadripareza predstavlja najtežu komplikaciju karakteriziranu mionekrozom uz povišenje kreatin kinaze u serumu. Glavna klinička manifestacija te komplikacije uključuje difuznu mišićnu slabost te otežano odvajanje bolesnika od mehaničke ventilacije. Dijagnoza se postavlja na osnovi anamnestičkih podataka, patološkoga nalaza EMNG-a te u nejasnih oblika biopsije mišića. Liječenje je simptomatsko.
ANTIMIKROBNA TERAPIJA
U ovome će dijelu udžbenika biti prikazani najčešće primjenjivani antimikrobni lijekovi u jedinici intenzivnoga liječenja: penicilini, cefalosporini, fluorokinoloni, karbapenemi, aminoglikozidi, vankomicin i njegovi alternativni lijekovi te parenteralni antifugici.
Penicilini. Primjena penicilina u jedinici intenzivnoga liječenja ograničena je na tzv. antipseudomonasne peniciline (karbenicilin, tikarcilin mezlocilin, piperacilin) od kojih se najčešće primjenjuje piperacilin.
Piperacilin je penicilinski antibiotik širokoga spektra koji pokriva mnoge bolničke patogene, a intravenski pripravak dolazi zajedno s tazobakatomom, beta-laktamazom koja pojačava djelotvornost lijeka (piperacilin-tazobaktam). Piperacilin djeluje na streptokoke, enterokoke, Staphylococcus epidermidis te aerobne gram-negativne bacile, uključujući i Pseudomonas aeruginosa, iako osjetljivost te bakterije na piperacilin polako opada. S obzirom na taj širok spektar djelovanja, piperacilin-tazobaktam se preferira kao antibiotik izbora u liječenju kritično oboljelih osoba s neutropenijom uz napomenu da se ne smije koristiti kao monoterapija pri sumnji na infekciju MRSA-om (ne djeluje na MRSA-u). Uobičajena doza piperacilin-tazobaktama je 3 x 4,5 g/dan (4 g piperacilina i 0,5 g tazobaktama). Kod oštećene funkcije bubrega (CrCL < 40 ml/min) potrebna je odgovarajuća redukcija doze lijeka.
Cefalosporini dolaze kao lijekovi u pet generacija, obuhvaćaju više od 25 vrsta, a u jedinici intenzivnoga liječenja najčešće se primjenjuju ceftriakson, ceftazidim te cefepim.
Ceftriakson je cefalosporin treće generacije koji djeluje na gram-negativne bacile, izuzev Pseudomonas spp, gram-pozitivne koke, osim MRSA-e i Staphylococcus epidermidis, te na Haemophilus influenzae. Ceftriakson se najčešće primjenjuje u liječenju domicilnih pneumonija koje zahtijevaju bolničko liječenje i koje su po svom tijeku teške, a tada se preporučuje njihova primjena zajedno s makrolidima (azitromicin). Osim toga, s obzirom na to da ceftriakson prelazi krvno-moždanu barijeru, preporučuje se i za liječenje pneumokoknoga i meningokoknoga meningitisa. Uobičajena je doza 1 x 1 g iv/dan za pneumoniju, odnosno 2 x 2 gr iv/dan za meningitis. Nije potrebna korekcija doze za bolesnike s oštećenom bubrežnom funkcijom.
Ceftazidim je cefalosporin treće generacije koji djeluje na gram-negativne bacile, uključujući Pseudomonas aeruginosa, ali ima ograničen učinak na gram-pozitivne bakterije. Ceftazidim se danas primjenjuje kao jedan od rezervnih lijekova u liječenju pseudomonasnih infekcija kao alternativa aminoglikozidima. Ceftazidim se primjenjuje u uobičajenoj dozi od 3 x 2 g iv/dan, a kod bolesnika s oštećenom bubrežnom funkcijom (CrCL < 80 ml/min) potrebna je redukcija doze lijeka.
Cefepim je cefalosporin treće generacije s dobrim učinkom na gram-negativne bacile, uključujući i Pseudomonas aeruginosa, a pokazuje i učinak na gram-pozitivne koke, izuzev MRSA-e. Danas je cefepim jedan od najčešće korištenih lijekova prve linije u liječenju septičkih bolesnika u jedinici intenzivnoga liječenja i jedan je od najčešće korištenih antibiotika širokoga spektra kod bolesnika s febrilnom neutropenijom. Uobičajena doza lijeka je 2 x 1 - 2 g iv/dan, odnosno 3 x 2 g iv/dan za bolesnike s febrilnom neutropenijom. Kod bolesnika s oštećenom bubrežnom funkcijom (CrCL < 60 ml/min) potrebna je redukcija doze lijeka.
Nuspojave na cefalosporinske antibiotike su rijetke i nespecifične (osip, proljev, povraćanje). Zbog moguće križne antigenske reaktivnosti između cefalosporina i penicilina, preporuča se izbjegavati njihovu primjenu kod bolesnika koji su imali ozbiljnu alergijsku reakciju na penicilin (angioedem, anafilaktički šok).
Fluorokinoloni (ciprofloksacin, levofloksacin, moksifloksacin) su antibiotici koji pokrivaju antimikrobni spektar na aerobne gram-negativne bacile, uključujući Pseudomonas aeruginosa, a novije generacije (levofloksacin, moksifloksacin) pokrivaju i velik dio respiratornih patogena, kao što su Streptococcus pneumoniae, Mycoplasma pneumoniae, Haemophylus influnzae te Legionella spp. U jedinici intenzivnoga liječenja fluorokinoloni se primarno koriste u liječenju domicilnih pneumonija.
Ciprofloksacin se najčešće koristi u dozi od 2 x 200 - 400 mg iv/dan, levofloksacin 1 x 500 mg iv/dan, a moksifloksacin 1 x 400 mg iv/dan. Ciprofloksacin i levofloksacin zahtijevaju prilagodbu doze ovisno o bubrežnoj funkciji, dok primjena moksifloksacina to ne zahtijeva.
Glavne nuspojave fluorokinolona su neurotoksičnost (konfuzija, halucinacije) te produljenje QT-intervala. Zbog interferiranja s metabolizmom teofilina i varfarina, može doći do potenciranja učinaka navedenih lijekova. Osobe koje uzimaju fluorokinolone mogu imati lažno pozitivan nalaz opijata u urinu.
Karbapenemi (imipenem, meropenem, doripenem, ertapenem) imaju najširi spektar djelovanja od svih antibiotika u kliničkoj primjeni. Djeluju na sljedeće bakterije: 1) gram-negativni bacili, uključujući Pseudomonas aeruginosa, 2) većina gram-pozitivnih koka, uključujući Streptococcus pneumoniae, Staphylococcus aureus osjetljiv na meticilin te Staphylococcus epidermidis; 3) gram-pozitivne i gram-negativne anaerobne bakterije, uključujući Enterococcus faecalis te Bacteroides fragilis. Karbapenemi ne djeluju na meticilin-rezistentan Stapylococcus aureus (MRSA) te vankomicin-rezistentne enterokoke (VRE), a dokazana je i smanjena djelotvornost na Pseudomonas aeruginosa. Karabapenemi se zbog svoga širokog spektra djelovanja često koriste kao antibiotik izbora u jedinici intenzivnoga liječenja kod bolesnika sa sepsom, kao i kod bolesnika s febrilnom neutropenijom. Karbapenemi pokazuju dobru kliničku učinkovitost kao monoterapija, ali kod bolesnika s rizikom od razvoja infekcije MRSA-om uz karbapenem je indicirana i primjena vankomicina ili njegove alternative. Uobičajena doza imipenema iznosi 4 x 500 mg iv/dan ili 4 x 1 g iv/dan ako se radi o pseudomonasnoj infekciji, a prilagodba doze bubrežnom oštećenju indicirana je kod bolesnika s CrCL < 70 ml/min. Meropenem se daje u dozi od 3 x 1 - 2 g iv/dan, a prilagodba doze bubrežnom oštećenju indicirana je kod bolesnika s CrCL < 50 ml/min. Kod manjega broja bolesnika koji pokazuju osjetljivost na penicilin može se javiti i osjetljivost na karbapeneme, ali ona je rijetka i obično blago izražena (osip, proljev) te ne predstavlja kontraindikaciju ako se radi o životno ugroženome bolesniku.
Aminoglikozidi su u prošlosti često bili korišteni u jedinici intenzivnoga liječenja, ali zbog izražene nefrotoksičnosti danas se primjenjuju u ograničenome broju indikacija. Aminoglikozidi imaju spektar djelovanja na većinu stafilokoka i gram-negativnih bacila, uključujući i Pseudomonas aeruginosa. Najčešće korišten aminoglikozid je amikacin, a njegova je glavna indikacija teška pseudomonasna infekcija, dok se drugi aminoglikozidi rijetko primjenjuju (gentamicin, tobramicin). Uobičajena doza amikacina iznosi 20 mg/kg TT/dan, a primjenjuje se u jednoj dozi. Bolesnicima čiji je CrCL < 80 ml/min potrebna je korekcija doze lijeka, a preporuča im se i laboratorijsko praćenje koncentracije lijeka u serumu (koncentraciju održavati između 56 - 64 mcg/ml). Aminoglikozidi pokazuju veliku sklonost oštećenju bubrežne funkcije (nefrotoksičnost), a mogu dovesti i do oštećenja sluha (ototoksičnost). Rijetko aminoglikozidi dovode do mišićne slabosti inhibirajući otpuštanje acetilkolina u sinapsama.
Vankomicin je baktericidni antibiotik koji inhibira sintezu stanične stijenke sa snažnim učinkom na sve gram-pozitivne koke, uključujući sve spojeve Staphylococcus aureus, kao i na aerobne i anaerobne streptokoke. Ipak, zbog razvoja rezistencije on se danas primjenjuje isključivo u liječenju infekcija rezistentnih na meticilin uzrokovanih sojevima Staphylococcus aureus (MRSA), Staphylococcus epidermidis, Enterococcus faecalis te pneumokokom otpornim na penicilin. Uobičajena doza vankomicina je 2 x 1 g iv/dan, a kod osoba s oštećenom bubrežnom funkcijom i CrCL < 80 potrebna je prilagodba doze lijeka. Moguće nuspojave primjene vankomicina su sindrom crvenoga čovjeka (sistemska vazodilatacija, crvenilo, hipotenzija), ototoksičnost, nefrotoksičnost te trombocitopenija i neutropenija. Lijekovi alternativni vankomicinu su oni koji se koriste u liječenju infekcije enterokokom otpornim na vankomicin te infekcije MRSA-om kod bolesnika koji ne toleriraju vankomicin. Najčešći alternativni lijekovi su linezolid, daptomicin i tigeciklin.
Linezolid je sintetski antibiotik s istim spektrom djelovanja kao i vankomicin, a djelotvoran je i u liječenju infekcija uzrokovanih enterokokom otpornim na vankomicin (VRE). Daje se u uobičajenoj dozi od 2 x 600 mg iv/dan te se doza ne mora prilagođavati bubrežnoj funkciji. Dokazano je da linezolid znatno bolje penetrira u plućne sekrete što mu daje prednost u liječenju plućnih infekcija.
Daptomicin je prirodni antibiotik sa spektrom djelovanja kao i linezolid, daje se u dozi od 4 - 6 mg/kg iv u jednoj dnevnoj dozi, a doza se mora prilagođavati bubrežnoj funkciji ako je CrCL < 30 ml/min. Lijek se daje kod infekcija mekih tkiva i kože, a ne djeluje na plućne infekcije s obzirom na to da plućni surfaktant inaktivira molekulu daptomicina.
Tigeciklin je derivat tetraciklina koji se koristi u liječenju tvrdokornih infekcija MRSA-om, VRE-om te Acinetobacter baumannii. Lijek se daje u dozi od 2 x 50 mg iv bez potrebe za prilagodbom u slučaju smanjene bubrežne funkcije. Neke su studije pokazale veći mortalitet bolesnika liječenih ovim lijekom tako da je njegova primjena opravdana samo u krajnjim slučajevima.
Parenteralni antifugici. Parenteralni antifugici koji se primjenjuju u jedinici intenzivnoga liječenja su flukonazol, amfotericin i ehinokandini.
Flukonazol je azolni antifugik koji djeluje na najčešće sojeve kandide, a to su C. albicans, C. tropicalis te C. parapsilosis. Lijek se koristi kao rezervni lijek ili lijek drugoga izbora u liječenju invazivne kandidijaze. Primjenjuje se u inicijalnoj dozi od 800 mg iv te se nastavlja 1 x 400 mg iv. Kod bolesnika s CrCL < 50 ml/min potrebna je 50 %-tna redukcija doze lijeka. S obzirom na to da se lijek metabolizira u jetri putem enzima citokrom P450, prilikom primjene lijeka potrebno je provjeriti njegove interakcije s drugim lijekovima koji se metaboliziraju na isti način.
Amfotericin je antifugik koji se primjenjuje u liječenju kandidijaze rezistentne na ostale antifugalne lijekove. Amfotericin B djeluje na sve vrste kandide osim Candida lusitaniae. Lijek se primjenjuje u dozi od 0,5 - 1 mg/lg iv kroz 3 do 4 sata jednom na dan. Lijek se preporuča primjenjivati putem centralne vene kako bi se izbjegla pojava flebitisa. Glavna nuspojava uključuje sistemski upalni odgovor karakteriziran vrućicom, tresavicom i zimicom te zakočenošću. Ta je nuspojava najčešće izražena pri prvom infundiranju lijeka, a sa svakom je sljedećom primjenom sve slabije izražena. Zbog toga se prije primjene amfotericina preporučuje premedikacija koja uključuje paracetamol (10 - 15 mg/kg), difenhidramin (25 mg) te hidrokortizon (100 mg). Amfotericin djeluje i nefrotoksično te se kod više od 30 % bolesnika pojavljuje porast kreatinina tijekom i nakon završetka liječenja. Danas su na raspolaganju i lipidni pripravci amfotericina (liposmalni amfotericin) koji imaju manju stopu navedenih nuspojava, a daju se u dnevnoj dozi od 3 - 5 mg/kg.
Ehinokandini su antifugalni lijekovi čiji je spektar djelovanja jednak kao flukonazola. U tu se skupinu lijekova ubrajaju i kaspofungin, mikafungin te anidulafungin. Obično se primjenjuju kod bolesnika s invazivnom kandididijazom (osim one uzrokovane sojem C. parapsilosis) i razvijenim septičkim šokom. Lijekovi se primjenjuju u svojim standardnim dozama: kaspofungin 70 mg iv inicijalno, a potom 50 mg iv/dan, mikafungin 100 mg iv/dan te andulafungin 200 mg iv bolusno, a potom 100 mg iv/dan. Najčešće su nuspojave blaga jetrena lezija te reverzibilna trombocitopenija.
VAZOAKTIVNO LIJEČENJE
Uvod. Vazoaktivni lijekovi među najčešće su korištenim lijekovima u jedinici intenzivnoga liječenja, a mogu se koristiti za liječenje hipotenzivnih i hipertenzivnih stanja. Vazoaktivne lijekove korištene za liječenje hipotenzivnih stanja dijelimo u dvije skupine: lijekove koji djeluju primarno na miokard pojačavajući njegovu kontraktilnost (inotropi) te na lijekove koji primarno djeluju na periferne krvne žile dovodeći do njihove vazokonstrikcije (vazopresori). Najznačajniji su inotropi dopamin, dobutamin, milrinon i levosimendan, dok su najznačajniji vazopresori noradrenalin, vazopresin i efedrin. Drugu skupinu vazoaktivnih lijekova čine oni koji se koriste u liječenju hipertenzivnih kriza, a to su u prvom redu nitroglicerin i natrijev nitroprusid.
Dopamin predstavlja endogeni katekolamin koji ima dvojaku ulogu u organizmu: djeluje kao neurotransmiter u središnjem živčanom sustavu te služi kao prekusor za sintezu noradrenalina. Oko 25 % primijenjene doze dopamina dospijeva u živčane završetke adrenergičkih vlakana te se metabolizira u noradrenalin koji potom stimulira adrenergičke receptore i djeluje kao simpatomimetik (oponaša učinak simpatikusa). Učinak dopamina ponajprije ovisi o dozi koja se primjenjuje: 1) u niskim dozama (1 - 3 mcg/kg/min) djeluje primarno na D-1 receptore te dovodi do dilatacije renalnih i mezenteričkih krvnih žila; 2) u srednjim dozama (1 - 10 mcg/kg/min) djeluje poglavito na β-1 receptore čime pojačava kontraktilnost miokarda s varijabilnim učinkom na srčanu frekvenciju (često izaziva tahiaritmije); 3) u visokim dozama (> 10 mcg/kg/min) djeluje na α-1 receptore zbog čega dovodi do sistemske vazokonstrikcije (djeluje kao vazopresor). Klinička primjena dopamina danas je sve rjeđa zbog čestoga nastanka tahiaritmija. Također, primjena dopamina u niskim dozama s ciljem poboljšanja perfuzije bubrega i poticanja diureze kod bolesnika s akutnim bubrežnim oštećenjem danas se ne preporuča. Glavnu indikaciju za primjenu dopamina čini kardiogeni šok praćen bradikardnim poremećajem srčanoga ritma. Dopamin se primjenjuje u obliku kontinuirane intravenske infuzije, obično u dozi od 3 do 10 mcg/kg/min, kada primarno djeluje kao inotrop, dok u većim dozama može djelovati na povišenje krvnoga tlaka zbog svoga vazokonstriktornog učinka. Maksimalna doza dopamina iznosi 20 mcg/kg/min. Najčešće nuspojave primjene dopamina su tahiaritmije (sinusna tahikardija i fibrilacija atrija pojavljuju se kod više od 25 % bolesnika), a mogu se pojaviti i splanhična i periferna hipoperfuzija, povišenje intraokularnoga tlaka te smanjeni gastrični motilitet.
Dobutamin je sintetski katekolamin koji svoj učinak ostvaruje vezajući se na β-1 i β-2 adrenergičke receptore u omjeru 3:1 ostvarujući tako dvojaki učinak: pozitivni inotropni učinak (β-1 receptori u srcu) te sistemsku vazodilataciju (β-2 receptori u krvnim žilama). Glavnu indikaciju za primjenu dobutamina predstavlja kardiogeni šok s obzirom na njegov primarno inotropni učinak, s time da se često mora kombinirati s nekim od vazopresora zbog podizanja vrijednosti krvnoga tlaka. Primjena dobutamina pri septičkom šoku indicirana je samo ako se ne mogu postići zadovoljavajuće vrijednosti krvnog tlaka unatoč volumnoj nadoknadi i primjeni vazopresora. Dobutamin se primjenjuje u obliku kontinuirane intravenske infuzije s početnom dozom od 3 do 5 mcg/kg/min uz postupno povećanje do maksimalno 20 mcg/kg/min. Pojava tahiaritmija znatno je rjeđa u odnosu na primjenu dopamina, a glavno ograničenje predstavlja povećanje potrošnje kisika u miokardu zbog čega se ne preporuča primjena duža od 72 sata.
Milrinon je inotropni lijek koji djeluje kao inhibitor fosfodiesteraze III, enzima koji dovodi do inhibicije razgradnje molekule cAMP-a u kardiomiocitima, čime se pojačava aktivnost fosfokinaze A i fosforilacija kalcijevih kanala s posljedičnim povećanjem intracitoplazmatskih vrijednosti kalcija što stvara preduvjet jačoj kontraktilnosti, ali posreduje i poboljšanje relaksacije kardiomiocita, zbog čega je pogodan za primjenu i pri dijastoličkoj srčanoj disfunkciji. Inhibicijom fosfodiesteraze III u glatkim mišićima krvnih žila povećava se koncentracija molekule cGMP-a koja posreduje vazodilatacijski učinak. Milrinon se stoga koristi u liječenju akutnoga srčanog popuštanja (kao i egzacerbacije kroničnoga), bez obzira na njegov oblik (i kod sistoličkoga i kod dijastoličkog), te u liječenju plućne hipertenzije. Primjenjuje se u obliku intravenske infuzije u dozi od 0,375 do 0,75 mcg/kg/min nakon inicijalne doze od 25 do 50 mcg/kg kroz deset minuta. Glavne su mu nuspojave ventrikularne aritmije i ishemija miokarda.
Levosimendan je inotropni lijek koji svoj učinak ostvaruje povećanjem osjetljivosti kardijalnih miofibrila za kalcij bez povećanja intracelularne koncentracije kalcija. Zbog relaksacijskoga učinka na glatku muskulaturu (vazodilatacija) dovodi i do smanjenja volumnoga i tlačnoga srčanog opterećenja. U prvome je redu indiciran za kratkotrajno liječenje akutno dekompenziranoga teškoga kroničnoga srčanog popuštanja kada se usprkos konvencionalnom liječenju i primjeni drugih inotropa ne postiže klinički oporavak. Levosimendan se primjenjuje u obliku intravenskoga bolusa u dozi od 6 do 12 mcg/kg nakon čega slijedi kontinuirana primjena u dozi od 0,05 do 0,1 mcg/kg/min tijekom 24 sata. Primjena levosimendana ne preporuča se u stanjima teške nekorigirane hipotenzije, niti u prisutnosti aortalne stenoze ili opstrukcije izlaznoga trakta lijevoga ventrikula. Najčešće nuspojave su hipotenzija, ventrikularni poremećaji srčanoga ritma te glavobolja.
Noradrenalin je najčešće korišten vazopresor koji svoj učinak primarno ostvaruje stimulacijom α-1 adrenergičkih receptora u stijenci krvnih žila dovodeći do sustavne vazokonstrikcije (osim u mozgu gdje dovodi do vazodilatacije). Noradrenalin je lijek izbora kod bolesnika sa septičkim i drugim oblicima distributivnoga šoka, a primjenjuje se u obliku kontinuirane infuzije u dozi od 2 do 20 mcg/kg/min. Glavne su mu nuspojave sistemska i periferna vazokonstrikcija i posljedična hipoperfuzija.
Vazopresin i njegovi analozi (argipresin) su vazopresori koji se dodaju terapiji bolesnika kod kojih se ne postižu zadovoljavajuće vrijednosti krvnoga tlaka unatoč primjeni noradrenalina. Ti lijekovi svoj učinak ostvaruju stimulacijom vazopresinskih V1 receptora koji posreduju vazokonstrikciju u stijenkama krvnih žila. Argipresin je najčešće korišten analog vazopresina u kliničkoj praksi, a primjenjuje se u obliku kontinuirane infuzije u dozi od 0,01 do 0,03 IU/min. Očekivane nuspojave uz primjenu vazopresina su splanhična ishemija (ishemija mezenterija, ishemija miokarda) te pojava malignih oblika poremećaja srčanoga ritma.
Adrenalin je endogeni katekolamin koji se u fiziološkim uvjetima luči iz srži nadbubrežne žlijezde kao odgovor na stres. Adrenalin posjeduje snažan učinak i na α i na β adrenergičke receptore dovodeći tako do pojačanja kontraktilnosti miokarda, ubrzanja srčane frekvencije te snažne vazokonstrikcije koja je najizraženija u potkožnim, bubrežnim i splanihičkim krvnim žilama. Osim toga, adrenalin posjeduje i metaboličke učinke kao što su pojačana lipoliza i glikoliza s posljedičnim stvaranjem laktata te inhibicija izlučivanja inzulina, što vodi u hiperglikemiju. Adrenalin je lijek izbora u liječenju srčanoga aresta te anafilaktičkoga šoka. Primjena adrenalina pri drugim indikacijama (kardiogeni šok, septički šok) ograničena je zbog visokoga rizika od štetnih nuspojava, prvenstveno tahiaritmija, splanhične ishemije i metaboličke laktacidoze. Adrenalin se pri kardiopulmonalnoj reanimaciji primjenjuje intravenski u dozi od 1 mg svakih 3 do 5 minuta, dok se kod anafilaktičkoga šoka najčešće primjenjuje intramuskularno u dozi od 0,5 mg. Kada se adrenalin primjenjuje u obliku intravenske infuzije, uobičajena doza iznosi 1 do 10 mcg/min.
Nitroglicerin je jedan od najčešće korištenih intravenskih vazodilatatora. Svoj učinak osigurava konverzijom u dušični oksid koji dovodi do relaksacije glatkomišićnih stanica. Taj je učinak ovisan o dozi te se kod primjene lijeka u nižim dozama (< 50 mcg/min) pojavljuje dilatacija vena, dok se dilatacija arterija ostvaruje tek pri većim dozama lijeka. Osim sniženja vrijednosti krvnoga tlaka, vazodilatacija dovodi i do smanjenja volumnoga i tlačnoga srčanog opterećenja zbog čega se on koristi u liječenju bolesnika s akutnim srčanim popuštanjem i održanim krvnim tlakom. Također, konverzija nitroglicerina u dušični oksid praćena je inhibicijom agregacije trombocita, što ima povoljan učinak pri akutnom koronarnom sindromu. Prema tome, glavne su indikacije za intravensku primjenu nitroglicerina u jedinici intenzivnoga liječenja: 1) liječenje akutne srčane dekompenzacije, 2) liječenje hipertenzivne krize te 3) simptomatsko olakšanje kod bolesnika s akutnim koronarnim sindromom. Primjena nitroglicerina započinje dozom od 5 do 10 mcg/min, a postupno se, prema potrebi, može povećavati i do 100 mcg/min. Glavne su mu nuspojave nepredvidiva hipotenzija koja se obično razvije kod bolesnika s hipovolemijom i desnostranim srčanim zatajenje te glavobolja kao posljedica pojačane moždane prokrvljenosti i povećanja intrakranijskoga tlaka. Rijetka je nuspojava razvoj methemoglobinemije kao posljedice metabolizma nitroglicerina pri čemu nastaju anorganski nitriti koji mogu oksidirati željezo u hemoglobinu, pri čemu nastaje methemoglobin. Intravensku primjenu nitroglicerina obilježava i razvoj tolerancije na nitrate, što se može javiti već nakon 24 sata njegove primjene. Mehanizam nastanka je nepoznat, ali vjeruje se da se radi o posljedici endotelne disfunkcije uzrokovane oksidacijom. Prevencija tolerancije na nitrate osigurava se svakodnevnim prekidom infuzije nitroglicerina u trajanju od šest sati.
Nitroprusid je također snažan intravenski vazodilatator koji se danas rjeđe koristi zbog mogućnosti nastanka otrovanja cijanidima. U dodiru s eritrocitima molekula nitroprusida se raspada pri čemu se oslobađa dušični oksid, koji posreduje vazodilataciju, te cijanidi koji mogu dovesti do neželjenih pojava. Za razliku od nitroglicerina, nitroprusid se pokazao kao jači arterijski nego venski dilatator. Nastali cijanidi se uz pomoć tiosulfata luče putem bubrega iz organizma. Glavna indikacija za primjenu nitroprusida je potreba za naglim snižavanjem vrijednosti krvnoga tlaka (hipertenzivna kriza, disekcija aorte), rjeđe kod bolesnika s akutnim srčanim popuštanjem. U slučaju primjene nitroprusida preporuča se dodavanje tiosulfata (na svakih 50 mg nitroprusida potrebno je dodati 500 mg tiosulfata), a preporučena doza iznosi 0,2 do 0,3 mcg/kg/min uz postupnu titraciju do maksimalno 3 mcg/kg/min, odnosno 1 mcg/kg/min kod oštećene bubrežne funkcije. Otrovanje cijanidima manifestira se metaboličkom acidozom, poremećajem srčanoga ritma te hipotenzijom.
PRIMJENA INZULINA I REGULACIJA GLIKEMIJE
Uvod. Hiperglikemija je česta kod bolesnika hospitaliziranih u jedinicama intenzivnoga liječenja, osobito kod bolesnika ranije oboljelih od šećerne bolesti, a smatra se da gotovo svaki četvrti hospitalizirani bolesnik ima potvrđenu šećernu bolest. Povišene vrijednosti glukoze u plazmi jasno su povezane s lošijim kliničkim ishodima.
Mjerenje glikemije. Preporuča se svim bolesnicima pri prijemu u jedinicu intenzivnoga liječenja odrediti vrijednost glukoze te sukladno dobivenim nalazima odrediti daljnji ritam mjerenja. Kod bolesnika s povišenim vrijednostima glukoze (> 7,8 mmol/L), kao i kod bolesnika sa šećernom bolesti preporuča se mjerenje bar četiri do šest puta tijekom dana, a prema potrebi i češće. Također, češće se mjerenje glukoze preporuča i kod bolesnika sklonih razvoju hipoglikemije, čak i u odsutnosti kliničkih manifestacija. Kod bolesnika sa stabilnim vrijednostima glukoze nisu potrebna česta mjerenja (jednom do dva puta na dan).
Ciljna vrijednosti glikemije bolesnika koja se liječe u jedinicama intenzivnog liječenja iznosi manje od 10 mmol/L pri čemu se za donju preporučenu vrijednost uzima donja referentna vrijednost prema važećim laboratorijskim preporukama.
Početno zbrinjavanje hiperglikemije. Bez obzira na način liječenja, svim bolesnicima sa šećernom bolesti prekida se terapija koju su ranije uzimali (antidijabetici, inzulin), a daljnje zbrinjavanje glikemije zasniva se na kontinuiranoj intravenskoj primjeni inzulina, kao i kod bolesnika s hiperglikemijom koji nemaju od ranije dijagnosticiranu šećernu bolest. Najčešće se primjenjuju inzulini kratkoga djelovanja kao što je inzulin aspart u početnoj dozi od 2 - 5 jedinica na sat, koja se dalje korigira prema nalazu glikemije. Takva kontrola glikemije osigurava najlakšu regulaciju i titraciju inzulinske terapije, osobito kod kritično oboljelih bolesnika koji imaju nepredvidivu apsorpciju subkutano primijenjenoga inzulina. Ako su bolesnici u trenu prijema klinički stabilni, regulacija glikemije odvija se kao i na drugim odjelima, intenziviranom inzulinskom terapijom (bazal-bolus shema) kako je to i opisano u tekstu u nastavku.
Nastavak zbrinjavanja hiperglikemije. Nakon postignute stabilizacije bolesnika, postignute regulacije glikemije te uvođenja enteralne ili parenteralne prehrane, preporuča se sve bolesnike sa šećernom bolesti, kao i one koji nemaju šećernu bolest, a primaju kontinuirani inzulin u dozi većoj od 2 jedinice na sat, prebaciti na intenziviranu inzulinsku terapiju koja se temelji na bazal-bolus shemi. Ona se sastoji od primjene dugodjelujućega inzulinskog analoga u jednoj ili dvije dnevne doze (ovisno o vrsti i trajanju učinka) uz primjenu inzulina kratkoga djelovanja uoči glavnih obroka. Pri određivanju doze inzulina može se voditi načelom ukupnog broja jedinica koje je bolesnik primao tijekom 24 sata dok je bio na kontinuiranoj inzulinskoj terapiji ili po načelu primjene doze inzulina od 0,3 do 0,5 jedinice po kilogramu tjelesne mase, pri čemu se polovica daje u obliku dugodjelujućega inzulinskog analoga, a druga polovica podijeljena u tri doze uoči glavnih obroka. Prvu dozu subkutanoga dugodjelujućega inzulinskog analoga potrebno je dati minimalno jedan do dva sata prije obustave kontinuirane primjene inzulina. Daljnja korekcija inzulinske terapije provodi se prema nalazu glikemije: prije davanja prandijalnih inzulina prije samoga jela i aplikacije inzulina potrebno je odrediti glikemiju, a ako se dugodjelujući inzulinski analog primjenjuje u jednoj večernjoj dozi (najčešća opcija), njegova se doza prilagođava prema jutarnjem nalazu glikemije natašte.
OSIGURANJE KRVOŽILNOGA I DIŠNOGA PUTA
Osiguravanje krvožilnoga pristupa, kao i prohodnosti dišnoga puta među najčešćim su postupcima u zbrinjavanju kritičnih bolesnika. Krvožilni put osigurava se postavljanjem perifernih i/ili središnjih venskih puteva, dok se osiguranje dišnoga puta postiže različitim postupcima i pomagalima.
OSIGURANJE KRVOŽILNOGA PUTA
Uvod. Uspostava krvožilnoga pristupa podrazumijeva plasiranje intravenskih kanila ili katetera putem kojih se omogućava primjena infuzijskih otopina, krvi i krvnih derivata, lijekova ili pripravaka za parenteralnu prehranu direktno u venski sustav. Osiguravanje zadovoljavajućih venskih puteva ključan je korak kod bolesnika koji borave u jedinici intenzivnoga liječenja s obzirom na to da se kod njih vrlo često istodobno primjenjuje više vrsta infuzijskih otopina i lijekova koji se moraju dati u određenom volumenu/dozi, predviđenom brzinom i u točno određeno vrijeme. Osiguranje krvožilnoga pristupa ostvaruje se postavljanjem perifernih ili središnjega venskog puta.
Periferni venski put put označava plasiranje plastične intravenske kanile u neku od površinskih vena gornjih ili donjih ekstremiteta, rjeđe vrata (vanjska jugularna vena) ili nekih drugih anatomskih lokalizacija. Periferni venski put predviđen je za kraći period liječenja za primjenu otopina i lijekova koji neće dovesti do značajnije iritacije i oštećenja venske stijenke (putem perifernih vena ne smiju se primjenjivati hipertonične otopine, lijekovi koji dovode do značajne vazokonstrikcije i sl.). Najpogodnija mjesta za postavljanje perifernih venskih kanila su površinske vene zapešća, podlaktice ili stopala (samo bolesnicima koji leže), dok se postavljanje u kubitalne vene izbjegava zbog pregibanja i mogućnosti zatvaranja venskoga puta. Danas su dostupne intravenske kanile različitih veličina te se za odgovarajuće zbrinjavanje kritično oboljelih osoba preporuča postavljanje minimalno dva periferna venska puta većega promjera (u Tablici 3.6. su prikazane standardizirane veličine, promjeri i protoci koji se njima ostvaruju, a dogovorno su označeni bojama). Postavljanje perifernoga venskog puta jednostavan je postupak koji izvode liječnik ili medicinska sestara, a sastoji se od postavljanja okluzivne poveske kako bi se postigla venska staza i bolje uočile vene, radi dezinfekcije ubodnoga mjesta, plasiranja kanile s metalnim mandrenom ubodom kroz kožu pod kutem od 30 do 45 stupnjeva dok se ne pojavi krv u komorici kanile, nakon čega se istodobnim pokretom plastični dio kanile plasira u venu, a metalni mandren vadi van. Funkcionalnost tako postavljenoga perifernoga venskog puta provjerava se primjenom fiziološke otopine (prati se eventualni nastanak paravenskoga otoka) te se cijela kanila pričvršćuje za kožu leukoplastom. Periferni venski put ne treba držati dulje od pet do sedam dana zbog mogućnosti iritacije i upale vene (površinski tromboflebitis).
|
Tablica 3.6. Veličine intravenskih kanila za periferni venski put
|
|
Boja kanile
|
Veličina (guage)
|
Promjer (mm)
|
Maksimalni protok
|
|
Narančasta
|
14
|
2,0
|
265 ml/min
|
|
Siva
|
16
|
1,7
|
170 ml/min
|
|
Zelena
|
18
|
1,2
|
90 ml/min
|
|
Ljubičasta
|
20
|
1,0
|
55 ml/min
|
|
Plava
|
22
|
0,8
|
25 ml/min
|
Središnji venski put označava plasiranje venskih katetera u neku od velikih vena (unutarnja jugularna vena, potključna vena, femoralna vena). Današnji središnji venski kateteri sastoje se od dva ili više međusobno povezanih lumena građenih od različitih materijala (poliuretan, silikon), koji se na vanjskoj strani dijele u dva ili više krakova što omogućava istodobnu primjenu više lijekova ili infuzijskih otopina. Također, središnji venski kateteri mogu biti impregnirani antibakterijskim sredstvom ili heparinom kako bi se smanjila učestalost infekcija i tromboza vaskularnih katetera. Postoje i drugi specifični oblici središnjih venskih katetera kao što su dijalizatni kateteri namijenjeni za izvođenje hemodijalize ili periferno postavljen središnji venski kateter (PICC).
Indikacije za postavljanje središnjega venskog puta bolesniku u jedinici intenzivnoga liječenja su: 1) nemogućnost postavljanja perifernoga venskog puta ili su postavljeni periferni venski putevi nedostatni za primjenu predviđenih lijekova i otopina; 2) potreba za osiguranjem venskoga puta kroz dulji vremenski period; 3) primjena vazopresora (noradrenalin, dopamin) i hipertoničnih otopina (parenteralna prehrana) koji dovode do oštećenja perifernih vena te 4) postavljanje središnjega venskog puta zbog izvođenja posebnih postupaka (mjerenje centralnoga venskog tlaka, hemodijaliza, hemodinamsko praćenje i sl.).
Kontraindikacije za postavljanje središnjega venskog puta su relativne, a uključuju teže poremećaje koagulacije te otežan anatomski pristup standardnim mjestima plasmana središnjih venskih katetera (kontrakture, pretilost).
Tehnika postavljanja središnjega venskog puta jednaka je bez obzira na mjesto plasiranja katetera (Seldingerova tehnika). Nekadašnje postavljanje središnjih venskih katetera orijentacijski, „naslijepo“, zamijenjeno je ultrazvučno navođenim postupkom punkcije vene. Zahvat se izvodi uz primjenu lokalnoga anestetika (lidokain). Cijeli se postupak izvodi pod strogim aseptičkim uvjetima što uključuje prikladno sterilno odijevanje operatera te pranje i pokrivanje mjesta punkcije. Postupak se sastoji od punkcije središnje vene putem igle i šprice koja se kroz kožu uvodi do vene uz stalnu laganu aspiraciju kako bi u špricu prilikom ulaska u venu ušla krv. Kada se pojavi krv u šprici, potrebno je dobro procijeniti njezin izgled, potom odvojiti špricu od igle zadržavajući isti položaj igle. Ako se igla nalazi u arteriji, a ne veni, dobivena krv u šprici svijetlo je crvene boje, a povrat krvi iz igle nakon odvajanja od šprice je u mlazu, pulsatilnoga karaktera. Kada i dalje postoje dvojbe radi li se o punkciji vene ili arterije (loše saturirani bolesnici imaju tamnu arterijsku krv, a povrat krvi u mlazu iz arterije može izostati kod duboko hipotenzivnih bolesnika), moguće je napraviti plinsku analizu dobivene krvi ili spojiti iglu sa sustavom za infuziju (kada je punktirana vena - infuzija teče u mlazu, a kada je punktirana arterija -infuzija teče u ritmu pulsa, odnosno isprekidano, a nekada se može vidjeti i retrogradni povrat krvi u sustav infuzije). Kada je isključena mogućnost da je punktirana arterija, preko igle se plasira žica vodilica do označenoga mjesta, a potom se preko nje izvadi igla tako da u veni ostaje samo žica vodilica. Žica vodilica se ni u jednom trenu ne smije ispuštati iz ruku. Preko žice vodilice potom se plasira plastični dilatator kojime se dilatira put kroz kožu i potkožu do vene, a kada se on odstrani preko vodilice se konačno uvodi kateter. Kako se kateter polagano plasira u venu, istodobno se povlači žica vodilica prema van, tako da na kraju u veni ostaje samo kateter koji se s dva ili više šavova fiksira za kožu. Prije fiksacije se svi krakovi moraju proprati te se mora provjeriti njihova prohodnost i protok, a ako se ne koriste, mora ih se ispuniti predviđenom količinom heparina kako bi se spriječilo zgrušavanje krvi unutar karaka (lumena) katetera. Dodatne posebnosti oko uvođenja središnjega venskog katetera povezane su s mjestom njegova plasmana. Oprema za postavljanje središnjeg venskog katetera prikazana je na Slici 3.1.
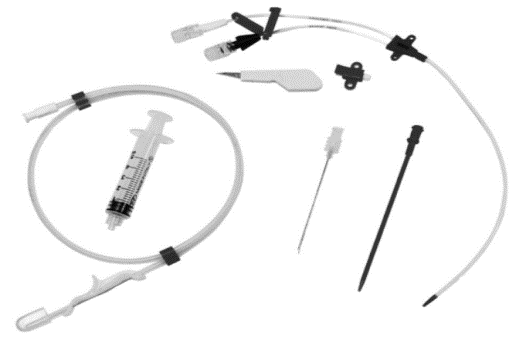
Slika 3.1. Operma za postavljanje središnjeg venskog katetera
Punkcija unutarnje jugularne vene jedno je od najčešćih mjesta plasiranja središnjega venskog katetera. Iako je neugodnija za bolesnike (fiksacija katetera za regiju vrata otežava pokrete glave), često se izvodi zbog manje mogućnosti nastanka postpunkcijskoga pneumotoraksa. Unutarnja jugularna vena nalazi se ispod dugoga mišića vrata neposredno uz lateralni zid karotidne arterije. Prilikom njezine punkcije bolesnikova se glava okreće na stranu suprotnu od mjesta punkcije, jagodicama prstiju nedominantne ruke palpira se karotidna arterija koja se malo potisne prema medijalno, a punkcija se vrši tik uz lateralni zid karotidne arterije pri čemu se igla ubada pod kutem od 30 do 45 stupnjeva, a njezin pravac usmjeren je prema mamili iste strane. Primjena ultrazvuka značajno olakšava punkciju unutranje jugularne vene koja se jasno prikazuje i razlikuje od karotidne arterije (karotidna arterija pulsira, a prilikom kompresije se ne da stlačiti, za razliku od vene koja ne pulsira i može se komprimirati). Najčešća komplikacija punktiranja ove vene punkcija je karotidne arterije koja nalaže brzo izvlačenje igle te digitalnu, umjerenu kompresiju mjesta uboda kroz 5 do 10 minuta. Ostale komplikacije su postpunkcijski hematom, pneumotoraks te lezije okolnih anatomskih struktura.
Punkcija potključne vene također predstavlja često izvođen postupak postavljanja središnjega venskog katetera. Njezino prikazivanje ultrazvučnom sondom otežano je zbog ključne kosti kroz koju ne prolazi ultrazvučni val, a vena se nalazi neposredno ispod nje, zbog čega se punkcija obično vrši orijentacijskom metodom. Potključna vena nastavlja se na pazušnu venu, prelazi preko prvoga rebra te se gotovo cijelim svojim tokom nalazi s unutarnje strane ispod ključne kosti. Mjesto punkcije određuje se palpacijskom metodom: igla se uvodi ispod hvatišta dugoga mišića vrata za ključnu kost, na spoju medijalne i srednje trećine ključne kosti, neposredno pored ključne kosti pod kutem od 30 do 45 stupnjeva, a kada prođe, izravna se tako da dođe ispod ključne kosti i dalje se uvodi zamišljenim pravcem koji završava u jugulumu. Kada se iz više pokušaja ne uspije punktirati potključna vena nikako se ne smije nastaviti s punkcijom potključne vene na suprotnoj strani, kako bi se izbjegla mogućnost nastanka obostranoga pneumotoraksa. Najčešće komplikacije ovoga postupka su pneumotoraks i postpunkcijski hematom, a mogući su i hematotoraks, lezije frenikusa i sl.
Punkcija femoralne vene najrjeđi je postupak postavljanja središnjega venskog puta zbog higijenskih uvjeta i mogućnosti nastanka infekcije, iako je ona tehnički najlakša, a izbjegava se i mogućnost nastanka pneumotoraksa. Femoralna vena prati femoralnu arteriju i nalazi se medijalno od nje. Prilikom punkcije noga se malo ukosi prema van, oslobodi se područje prepone te se jagodicama nedominantne ruke ispipa položaj i put femoralne vene. Igla se uvodi 1 do 2 cm medijalno od femoralne arterije, pod kutem od 35 do 45 stupnjeva zamišljenim pravcem u smjeru umbilikulusa. Glavne komplikacije vezane su uz krvarenje i punkciju femoralne arterije. Kao i kod punkcije jugularne vene, primjena ultrazvuka uvelike olakšava postupak venepunkcije.
Infekcije centralnih katetera zauzimaju bitno mjesto u liječenju bolesnika u jedinici intenzivnog liječenja, a mogu biti i jasni izvori septičkoga zbivanja. Infekcija najčešće nastaje migracijom mikroorganizama s površine kože (širenje per continuitatem), rjeđe se radi o endogenoj kontaminaciji. Najčešći su uzročnici koagulaza negativan stafilokok, S. aureus, Enterococcus spp., Candida spp., Pseudomonas aeruginosa, Enterobacter spp. te Serratia spp. Glavni rizični čimbenici za nastanak infekcije središnjega venskog katetera su dob (> 60 godina), neutropenija, imunosupresivna terapija, oštećenje integriteta kože te kronični komorbiditeti. Pri sumnji na infekciju središnjega venskog katetera (febrilno stanje, porast upalnih parametara, gnojenje oko izlazišta katetera) indicirana je njegova ekstrakcija uz obveznu mikrobiološku analizu vrha katetera.
OSIGURANJE DIŠNOGA PUTA
Uvod. Osiguranje prohodnosti dišnoga puta prvi je preduvjet zadovoljavajuće respiracije jer se time osigurava nesmetan protok zraka u/iz pluća. Osim kod poremećaja stanja svijesti i drugih specifičnih oboljenja (edem mekih tkiva glave i vrata), osiguranje dišnog puta nužno je i za primjenu mehaničke ventilacije. Metode osiguranja dišnoga puta ugrubo možemo podijeliti na osnovne i napredne.
Osnovni postupci održavanja dišnoga puta podrazumijevaju primjenu odgovarajućega položaja tijela čime se osigurava prohodnost dišnoga puta (stabilni bočni položaj, zabacivanje glave s ili bez podizanja čeljusti) i/ili osnovnih pomagala koje koristimo za održavanje dišnoga puta (orofaringealni i nazofaringealni tubus).
Stabilni bočni položaj (tzv. koma položaj) preporuča se za bolesnike bez svijesti koji spontano dišu. Kod takvih je bolesnika česta pojava zapadanja jezika prema orofarinksu dok se nalaze u ležećem položaju na leđima, zbog čega se javlja otežani protok zraka i gušenje (glasni hropci poput hrkanja). Stavljanjem bolesnika u bočni položaj sprječava se zapadanje jezika i tako osigurava nesmetani protok zraka, a osim toga se omogućava i nesmetano istjecanje tekućega sadržaja iz usne šupljine (slina, povraćani sadržaj) čime se smanjuje mogućnost nastanka aspiracije i aspiracijske pneumonije. Bolesnik se postavlja u položaj tako da su noga i ruka uz krevet ispružene, dok su suprotna noga i ruka savijeni u koljenu, odnosno laktu i osiguravaju stabilnost (dodatno osiguranje položaja postiže se primjenom jastuka).
Zabacivanje glave s podizanjem brade čini najčešći i osnovni postupak kojim se podiže baza jezika od orofarinksa i tako osigura prohodnost dišnoga puta. Postupak se izvodi tako da se glava zabacuje prema nazad rukom postavljenom na čelo bolesnika, dok se prstima druge ruke podiže brada prema gore. Zabacivanje glave kontraindicirano je kod bolesnika s ozljedom vratne kralješnice (ili sumnjom na nju).
Potiskivanje donje čeljusti prema naprijed također predstavlja manevar kojim se oslobađa dišni put, a učinkovitost mu se povećava ako se primjenjuje istodobno sa zabacivanjem glave. Postiže se tzv. trostrukim hvatom po Safaru pri čemu se zauzima položaj iza glave bolesnika: kažiprstom i ostalim prstima obuhvaća se donja čeljust iza njezinog kuta te se tako osigurava pomak donje čeljusti prema gore i naprijed, dok se palčevi postavljaju s prednje strane donje čeljusti te se njihovim potiskivanjem osigurava otvaranje usta. Tubus se postavlja tako da se u usnu šupljinu uvodi u obrnutom položaju do spoja tvrdoga i mekog nepca, a potom se okrene za 180⁰ te se gura dalje dok ne legne u ždrijelo.
Primjena orofaringealnoga tubusa. Orofaringealni tubus (engl. airway) predstavlja zakrivljenu plastičnu cijev koja prati zakrivljenost jezika, sprječava njegovo zapadanje te se kroz nju osigurava protok zraka (Slika 3.2.). Sa strane ima plosnati dodatak koji mu osigurava i stabilizira položaj na ulazu u usnu šupljinu. Orofaringealni tubus dolazi u više veličina, a odabir veličine ovisi o vertikalnoj udaljenosti između prednjih sjekutića i kuta donje čeljusti. Primjena orofaringealnoga tubusa moguća je samo kod osoba s dubokim poremećajem stanja svijesti jer kod budnih može izazvati nadražaj glosofaringealnoga (povraćanje) ili laringealnoga živca (laringospazam).
Primjena nazofaringealnog tubusa. Nazofaringealni tubus predstavlja savitljivu, gumenu ili plastičnu, lako savitljivu cijev koja se plasira kroz nosnicu do ždrijela, a bolesnici ju znatno lakše podnose uz manji stupanj poremećaja svijesti (Slika 3.2.). Posebno je koristan kod osoba s čvrsto stisnutom čeljusti, trizmusom ili traumom lica i čeljusti, a ne smije se postavljati kod sumnje na prijelom baze lubanje. Postoje različite veličine, a za odrasle osobe obično je dostatna veličina tubusa od 6 do 7 mm. Tubus se unosi kroz desnu (ili lijevu) nosnicu laganim rotirajućim pokretima sve dok ne prođe nosne školjke i ne pozicionira se u ždrijelu.
Slika 3.2. Orofaringealni tubusi (lijevo) i nazofaringealni tubusu (desno)
Napredni postupci održavanja dišnog puta podrazumijevaju primjenu supraglotičkih pomagala (laringealna maska, laringealni tubus, I-gel maska), endotrahealnoga tubusa kao metode održavanja dišnoga puta ili, u određenim okolnostima, primjenu traheotomije.
Laringealna maska predstavlja najčešće korišteno supraglotično pomagalo. Sastoji se od širokoga tubusa na čijem je jednom kraju eliptoidni balon koji se može napuhati i tako zatvoriti perilaringealni prostor, što omogućava da se većina upuhanoga zraka provede do pluća uz minimalno napuhavanje želuca. Iako je aspiracija želučanoga sadržaja moguća, uz laringealnu je masku rizik od toga nizak, zbog čega se taj način osiguravanja dišnoga puta smatra prihvatljivim u uvjetima hitne službe, osobito uz tim koji nema dostatnoga iskustva s endotrahealnim intubacijama. Također, laringealna maska smatra se i prihvatljivim rješenjem u slučaju hitnoća praćenih neuspjelim endotrahealnim intubacijama. Laringealna maska udovoljava uvjetima održavanja dišnoga puta kroz kraći vremenski period (do sat vremena), no za dulji period neophodna je endotrahealna intubacija ili traheotomija. Primjena larinegalne maske moguća je samo kod duboko nesvjesnih ili sediranih bolesnika. Iako dolazi u različitim veličinama, laringealna maska broj 4 odgovara većini žena, dok broj 5 odgovara većini muškaraca. Tehnika primjene laringealne maske podrazumijeva laganu fleksiju vrata i ekstenziju glave te lagano uvođenje laringealne maske tako da ju se drži poput olovke za tubus iznad balona, a kada se pozicionira u supraglotični prostor, potrebno je napuhati balon zrakom koristeći špricu (30 - 40 mL). Treba imati na umu da se pri visokom otporu u dišnom putu (plućni edem, bronhospazam) povećava opasnost od propuštanja zraka oko balona što može uzrokovati hipoventilaciju i želučanu distenziju.
Ostala supraglotična pomagala. Uz laringealnu masku postoje i brojne poboljšane inačice kao što su Proseal laringealna maska, Supreme laringealna maska, I-gel i laringealni tubus (slika 3.3.). Osnovni princip isti je kao i kod laringealne maske, a glavne razlike leže u materijalima i dizajnu. Proseal laringealna maska pored tubusa sadrži još i balon i cjevčicu za drenažu želuca, dok Supreme laringealna maska ima balon koji podnosi veće tlakove, ima drenažnu cijev za želudac te ugrađenu blokadu ugriza. I-gel postaje sve popularnije supraglotično pomagalo zbog bržega i jednostavnijeg postavljanja, što je posljedica termoplastičnoga elastomera koji se nalazi na kraju tubusa umjesto balona, a ne zahtijeva napuhivanje, nego se nakon postavljanja uslijed djelovanja temperature tijela širi i na odgovarajući način popunjava perilaringealni prostor. Osim toga, I-gel ima i dodatnu cjevčicu za drenažu želuca.
Endotrahealni tubus predstavlja plastičnu cijev koja na svome distalnom kraju ima balon koji se napuni zrakom kada se tubus uvede u traheju, kako bi učvrstio položaj tubusa i spriječio prolaz zraka ili drugoga sadržaja pored tubusa (Slika 3.3.). Postupak uvođenja enotrahealnoga tubusa u traheju naziva se endotrahealna intubacija. Ona zahtijeva posebnu opremu i vještine, što je posebno opisano. Endotrahealni tubusi mogu biti plastični ili armirani (savitljivi), a dolaze u različitim veličinama (veličine 6, 7 i 8 pokrivaju neposredne potrebe svih odraslih bolesnika). Endotrahealni tubus omogućava optimalnu zaštitu dišnoga puta koja se može provoditi kroz dulji vremenski period.

Slika 3.3. Laringealna maska (lijevo), I-gel (sredina) i endotrahealni tubus (desno)
Traheotomija označava kirurški postupak kojime se formira otvor na traheji i prednjoj strani vrata i kroz njega se postavlja endotrahealna kanila koja ima slična svojstva kao i endotrahealni tubus (tzv. traheofleks). U jedinici intenzivnoga liječenja preferira se izvođenje perkutane dilatativne traheotomije u slučaju potrebe osiguravanja dišnoga puta kroz dulji vremenski period (prolongirana mehanička ventilacija i sl.). Detaljnije je postupak perkutane dilatativne traheotomije opisan u nastavku.
ENDOTRAHEALNA INTUBACIJA
Definicija. Endotrahealna intubacija označava postupak uvođenja endotrahealnoga tubusa u traheju kroz usnu (orofaringealna intubacija) ili nosnu šupljinu (nazofaringealna intubacija) uz pomoć direktne laringoskopije, rjeđe postupkom naslijepo ili nekim drugim endoskopskim pomagalom (fiberbronhoskop).
Indikacije za endotrahealnu intubaciju mogu se podijeliti u dvije osnovne skupine: 1) osiguranje prohodnosti dišnoga puta kako bi bolesnik spontano disao kada se radi o bolesniku s poremećenim stanjem svijesti (Glasgow coma scale < 8) te 2) omogućavanje primjene invazivne mehaničke ventilacije (akutna ili kronična respiratorna insuficijencija, primjena mehaničke ventilacije anesteziranih bolesnika).
Oprema za endotrahealnu intubaciju uključuje laringoskop koji se sastoji od drška s lopaticom (špatulom) s izvorom svjetlosti na svome vrhu, endotrahealni tubus u koji se prethodno postavlja žica vodilica (stilet) koja onemogućava savijanje tubusa te šprica kojom se napuhuje zrak u balon tubusa (engl. cuff). Pored toga, na raspolaganju moraju biti sukcijski aparat i sukcijski kateteri za eventualno čišćenje usne šupljine i sadržaja iz farinksa i larinksa (kako bi se omogućila zadovoljavajuća vizualizacija) te Magillova hvataljka kojom je moguće odstraniti strana tijela iz gornjih dišnih puteva (Slika 3.4.).

Slika 3.4. Laringoskop (lijevo), endotrahealni tubus s vodilicom (sredina), Magillova hvataljka (desno)
Tehnika endotrahealne intubacije. Orotrahealna intubacija izvodi se na bolesniku u ležećem položaju s lagano deflektiranom glavom kako bi se olakšala vizualizacija glasnica i razmaka između njih (lat. rima glotidis). Laringoskop se drži u nedominantnoj ruci te se njegova špatula uvodi u usnu šupljinu uz desni usni kut i usmjerava se ulijevo potiskujući jezik u stranu i gore uz istodobno podizanje donje čeljusti prema naprijed i gore pokretom iz lakta i ramena, a ne ručnoga zgloba. Vrh lopatice laringoskopa pozicionira se u prostor valekule smještene iznad epiglotisa te se njezinim podizanjem otkrivaju glasnice, odnosno prostor između njih kroz koji se uvodi tubus s vodilicom dominantnom rukom. Kada se tubusom prođe između glasnica, asistent vadi vodilicu iz tubusa, a tubus se potiskuje dalje u traheju do određene razine nakon čega se napuše balon te provjeri položaj tubusa. Nazotrahealna intubacija izvodi se na bolesniku u sjedećem položaju, tako da se kroz nos postavlja tubus (obično manjega promjera) koji se potom uz pomoć laringoskopije i Magillove hvataljke potiskuje dolje prema larinksu i traheji.
Provjera položaja tubusa. Zbog velike mogućnosti intubacije jednjaka, potrebno je prije započinjanja mehaničke ventilacije provjeriti položaj tubusa i potvrditi njegov položaj u traheji. Klinički znakovi dobre pozicije endotrahealnoga tubusa su kondenzacija (zamagljivanje) unutrašnjosti tubusa, odizanje prsnoga koša te prisutan auskultacijski šum disanja nad plućima. Najsigurniji znak dobre pozicije tubusa mjerenje je koncentracije izdahnutoga ugljičnog dioksida (etCO2) pomoću posebnoga detektora jer je prisutnost krivulje etCO2 znak sigurne endotrahealne pozicije tubusa.
Lijekovima potpomognuta intubacija. Postupak endotrahealne intubacije kod osoba koje su budne ili imaju blaži poremećaj stanja svijesti često nije moguće izvesti nativno, nego je bolesnike potrebno prethodno sedirati, a prema potrebi i relaksirati. Pri tome se koriste sedativi i hipnotici (etomidat, propofol, tiopental, ketamin) te neuromišićni relaksansi (sukcinil-kolin, verkuronij, rokuronij), a najčešće korišteni lijekovi navedeni su u Tablici 3.7.
|
Tablica 3.7. Lijekovi pri endotrahealnoj intubaciji
|
|
Lijek, pakiranje
|
Doziranje
|
Početak i trajanje
|
Napomene
|
|
Sedativi (hipnotici)
|
|
Etomidat
(2 mg/mL)
|
0,2 - 0,4 mg/kg iv
|
Početak: < 1 min
Trajanje: 4 - 5 min
|
Minimalni hemodinamski učinci
Smanjuje intrakranijski tlak
|
|
Propofol
(20 mg/mL)
|
1 - 3 mg/kg iv
|
Početak: < 1 min
Trajanje: 10 - 15 min
|
Hipotenzija
Smanjuje intrakranijski tlak
|
|
Tiopental
(1000 gr prašak)
|
1 - 5 mg/kg iv
|
Početak: 10 - 20 sek
Trajanje: 10 - 30 min
|
Hipotenzija, bronhospazam
Smanjuje intrakranijski tlak
|
|
Ketamin
(25 mg/mL)
|
1 - 4 mg/kg iv
|
Početak: < 1 min
Trajanje: 10 - 20 min
|
Tahikardija, hipertenzija, bronhodilatacija
Povisuje intrakranijski tlak
|
|
Neuromuskularni blokatori
|
|
Sukcinil-kolin
0,1 g/5 mL
|
1 mg/kg iv
|
Početak: 15 - 30 sek
Trajanje: 5 - 10 min
|
Hiperkalijemija
Produljena paraliza
Maligna hipertenzija
|
|
Vekurnonij
10 mg/mL
|
0,1 - 0,2 mg/kg iv
|
Početak: 1 - 4 min
Trajanje: 20 - 60 min
|
|
Rokuronij
10 mg/mL
|
1 mg/kg iv
|
Početak: 30 - 60 sek
Trajanje: 30 - 60 min
|
Pomoć pri endotrahealnoj intubaciji. Sam postupak endotrahealne intubacije izvodi se uz asistenciju druge osobe, a mogu se primjenjivati i različiti manevri kojima se poboljšava vizualizacija perilaringealnoga područja. Širenje vidnoga polja pri izvođenju direktne laringoskopije može se postići istodobnim povlačenjem desnoga usnog kuta i obraza u stranu, a vizualizaciju u nekim slučajevima olakšava i Sellickov manevar koji podrazumijeva lagani pritisak na krikoidnu hrskavicu izvana u području središnjega dijela vrata, čime se larinks potiskuje prema dolje i jasnije dolazi u vidno polje prilikom izvođenja laringoskopije. Pomoć u vizualizaciji omogućavaju i različite lopatice laringoskopa (manje ili veće, zakrivljene ili ravne), kao i različiti laringoskopi (videolaringoskop – laringoskop s kamericom i ekranom koji olakšava pregled, McIntosh laringoskop - laringoskop koji omogućava odizanje distalnoga kraja lopatice čime se bolje odižu valekula i epiglotis). Pri iznimno teškim intubacijama (predviđena teška intubacija ili opetovano neuspješne intubacije) preporuča se i primjena fiberbronhoskopa preko kojega se navuče tubus, a kada se endoskopom prođe rima glotidis, on se lagano spusti uz aparat u traheju.
Komplikacije endotrahealne intubacije su laringospazam, poremećaji srčanoga ritma, hipoksija, povišenje intrakranijalnoga tlaka, dislokacija donje čeljusti, prijelomi i ekstrakcije zuba, perforacija jednjaka ili traheje, ozljede vratne kralješnice, aspiracija želučanoga sadržaja, intubacija i ventilacija jednoga plućnog krila (atelektaza), ozljede usana, jezika i ždrijela i sl.
Otežana intubacija predstavlja situaciju u kojoj anatomska ili neka druga okolnost otežava plasiranje tubusa u traheju. Pretpostavka otežane intubacije postoji kod bolesnika s dugim gornjim sjekutićima, prednjim zagrizom, nemogućnošću protruzije donje čeljusti, ograničenim otvaranjem usta, visokim nepcem, kratkim i debelim vratom, ograničenošću kretnji u vratu (uključujući i sumnju na ozljedu vratne kralješnice) i sl. U slučaju otežane intubacije upotrebljava se metoda indirektne laringoskopije uz pomoć videolaringoskopa, fiberoptičkoga bronhoskopa te fiberoskopa i optičke vodilice.
PERKUTANA DILATATIVNA TRAHEOTOMIJA
Definicija. Perkutana dilatativna traheotomija (PDT) označava postupak nekirurškoga uspostavljanja otvora na prednjem zidu traheje koji se zasniva na principu pristupa traheji uz pomoć igle i fleksibilne žice vodilice (Seldingerova tehnika) – Slika 3.5. PDT se najčešće izvodi u slučajevima potrebe za prolongiranom ventilacijom (Tablica 3.8.).
|
Tablica 3.8. Nedostaci dugotrajne endotrahealne intubacije i prednosti ranog PDT-a
|
|
Nedostaci dugotrajne endotrahealne intubacije
|
Prednosti ranog PDT-a
|
|
Potreba za sedacijom i analgezijom;
Nemogućnost gutanja;
Nemogućnost govora;
Česta akcidentalna ekstubacija;
Traume pri reintubacijama;
Lezija larinksa i glasnica;
Imobilnost.
|
Ugodnije za bolesnika;
Manja potreba za analgosedacijom;
Lakša toaleta dišnoga puta;
Mogućnost gutanja i govora;
Lakša i brža mobilizacija bolesnika;
↓ mrtvi prostor, olakšan dišni rad;
Brže odvajanje od strojne ventilacije.
|
Indikacije. Glavne indikacije za izvođenje toga zahvata su: prolongirana strojna ventilacija (> 2 tjedna), toaleta dišnoga puta, visok rizik od aspiracije, netolerancija endotrahealnoga tubusa i potreba za sedacijom te ranije odvajanje od strojne ventilacije. U kliničkoj je praksi najčešća indikacija za PDT potreba za dugotrajnom strojnom ventilacijom.
Kontraindikacije. Apsolutne kontraindikacije za PDT su dob ispod 12 godina, infekcija insercijskoga mjesta (vrat), ozljede vratne kralješnice, nekontrolirana koagulopatija, kardiovaskularna nestabilnost, neiskustvo operatera te terminalna faza bolesti. Relativne kontraindikacije za PDT su anatomske abnormalnosti, uvećana štitna žlijezda, pulsirajuća vaskulatura vrata, koagulopatija, zračenje područja vrata, prethodna traheotomija te prethodna ozljeda vratne kralješnice.
Komplikacije. Najčešće komplikacije koje prate PDT su krvarenje (ozljede krvnih žila ili štitne žlijezde), infekcija insercijskoga mjesta, paratrahealna pozicija kanile, poremećaj ventilacije i oksigenacije, pneumotoraks, pneumomedijastinum, subkutani emfizem, oštećenje stražnjega zida traheje i jednjaka (fistula), kolaps traheje pri ranoj ili akscidentalnoj ekskanilaciji te stenoza traheje.

Slika 3.5. Endotrahealna kanila (traheofleks) ostavljena postupkom PDT-a.
NADZOR BOLESNIKA U JEDINICI INTENZIVNOGA LIJEČENJA
Uvod. Kontinuiran nadzor vitalnih funkcija (engl. monitoring) životno ugroženih bolesnika jedan je od temeljnih zadataka u jedinici intenzivnoga liječenja. Takav pristup podrazumijeva stalno praćenje i trenutno uočavanje, odnosno prepoznavanje nastalih poremećaja koji nalažu trenutnu reakciju. Korist od kontinuiranoga praćenja imaju i bolesnici koji trenutno nisu u životnoj opasnosti, ali posjeduju visok rizik za razvoj takvoga stanja (npr. praćenje bolesnika neposredno nakon endoskopske hemostaze krvarećega ulkusa i sl.). Nadzor bolesnika u jedinici intenzivnoga liječenja sastoji se od kliničkoga praćenja bolesnika (pregled), specifičnih invazivnih i neinvazivnih metoda te laboratorijskih pretraga. Osnovni nadzor bolesnika uključuje kontinuiranu elektrokardiografiju, pulsnu oksimetriju, učestalo mjerenje krvnoga tlaka i tjelesne temperature te praćenje satne diureze i stanja svijesti. Detaljnije je o metodama nadzora kardiocirkulatorne i respiratorne funkcije, kao i drugim, specifičnim oblicima nadzora pisano u nastavku teksta.
Metode nadzora kardiocirkulatorne funkcije obuhvaćaju kontinuiranu elektrokardiografiju, mjerenje krvnoga tlaka, mjerenje središnjega venskog tlaka, bedside ehokardiografiju, kateterizaciju plućne arterije te metode praćenja tkivne perfuzije.
Kontinuirana elektrokardiografija omogućava kontinuirano praćenje srčane električne aktivnosti koje se provodi s ciljem praćenja srčanoga ritma, detekcije novonastalih aritmija ili drugih poremećaja (npr. ishemija), iako je za detaljnu analizu potrebno snimanje 12-kanalnoga elektrokardiograma. Praćenje kontinuirane elektrokardiografije ostvaruje se preko periferno postavljenih elektroda koje se postavljaju na desno i lijevo rame te u područje lijeve prednje aksilarne linije u visini vrška srca, koje omogućavaju analizu u tri osnovna odvoda (I., II. i III.). Analiza srčanoga ritma obično se provodi u II. odvodu, s obzirom na to da on najvjernije slijedi fiziološku osovinu srca, a u tome je odvodu i najveća voltaža P-vala što je bitno za analizu i procjenu vrste srčanoga ritma. Kontinuirana elektrokardiografija dio je osnovnoga nadziranja životno ugroženih bolesnika i provodi se kod svih bolesnika u jedinici intenzivnoga liječenja.
Mjerenje krvnoga tlaka također je sastavni dio nadzora bolesnika u jedinici intenzivnoga liječenja, osobito ako se radi o hemodinamski nestabilnim bolesnicima, a predstavlja jedan od najkorisnijih i najdostupnijih parametara za ocjenu hemodinamike. Invazivnim ili neinvazivnim metodama mjere se vrijednosti sistoličkoga, dijastoličkoga i srednjega arterijskog tlaka. Srednji arterijski tlak dobiva se matematičkim izračunom (SKT + 2 x DKT / 3), a vrijednost srednjega arterijskog tlaka od 60 mmHg uzima se kao minimalna vrijednost koja je potrebna da bi se osigurala zadovoljavajuća tkivna perfuzija.
Neinvazivno mjerenje krvnoga tlaka sastoji se od različitih metoda, a najčešće su palpacijska, auskultacijska i oscilometrijska metoda. Oscilometrijska je metoda danas najčešće korištena u jedinici intenzivnoga liječenja. Ona predstavlja automatizirano mjerenje krvnoga tlaka, a temelji se na automatskom mjerenju promjena intenziteta pulsacija, odnosno oscilacija koje one uzrokuju u području postavljenje obujmice (manžete).
Invazivno mjerenje krvnoga tlaka podrazumijeva kanulaciju neke od perifernih arterija (brahijalna, radijalna ili femoralna arterija) uz postavljanje tzv. arterijske linije što nam omogućava izravno i precizno mjerenje krvnoga tlaka unutar same arterije. Sustav za mjerenje invazivnoga arterijskog tlaka (arterijska linija) sastoji se od intraarterijske kanile koja se spaja s posebnim sustavom čiji je ključni dio komorica (engl. tranducer). Ona pretvara tlak u električni signal koji se odašilje na monitor te se ispisuje brojčanom vrijednošću i grafički - krivuljom tlaka pulsa. Takav način mjerenja krvnoga tlaka indiciran je kod visokorizičnih bolesnika i bolesnika na kontinuiranoj vazoaktivnoj potpori.
Mjerenje središnjega venskog tlaka označava mjerenje tlaka u desnom atriju jer on ukazuje na volumni status bolesnika. Mjerenje se izvodi preko centralnoga venskog katetera uvedenoga preko potključne ili unutarnje jugularne vene. Slično kao i kod invazivnoga mjerenja arterijskog tlaka, spaja se s tlačnom komoricom koja pretvara tlak u električni impuls, a on se potom ispisuje kao brojčana vrijednost ili grafička krivulja na monitoru spojenom s tlačnom komoricom. Uredne vrijednosti središnjega venskog tlaka su od 3 do 8 mmHg, a povišene vrijednosti mogu ukazivati na hipervolemiju ili druga stanja koja dovode do desnostranoga srčanog popuštanja (uznapredovalo popuštanje lijevoga srca, bolesti pluća i plućne cirkulacije, srčana tamponada i sl.), dok snižene vrijednosti nalazimo u slučaju hipovolemije i distributivnoga šoka.
„Bedside“ ehokardiografija (ehokardiografija uz krevet bolesnika) danas se sve više preferira kada se radi o praćenju srčane funkcije i predstavlja nezaobilazan dio nadzora bolesnika sa sumnjom ili potvrđenom srčanom patologijom. Omogućuje trenutni uvid u strukturu i funkciju desnoga i lijevog srca, prisutnost perikardijalnoga izljeva ili indirektnih znakova plućne hipertenzije (plućna embolija). Neškodljivost i jednostavnost izvođenja te metode čine je prihvatljivom za opetovano provođenje i praćenje stanja bolesnika.
Kateterizacija plućne arterije (Swan-Ganzov kateter) predstavlja oblik hemodinamskoga praćenja indiciran u posebnim kliničkim situacijama, ne izvodi se rutinski, već kod praćenja bolesnika tijekom i nakon kardiokirurškoga zahvata, bilo kojega oblika šoka refrakternog na standardnu terapiju, diferencijacije akutnoga respiratornog distres sindroma od kardijalnoga edema pluća i sl. Kateterizacija plućne arterije omogućava mjerenje središnjega venskog tlaka, sistoličkoga i dijastoličkog tlaka desnoga ventrikula, plućnoga arterijskog tlaka te mjerenje okluzijskoga tlaka u plućnoj arteriji - neizravnoga pokazatelja tlakova u lijevom srcu prema kojemu se procjenjuje funkcija lijeve strane srca. Osim mjerenja tlakova, bolesnicima s plućnim arterijskim kateterom mogu se termodilucijskom metodom te različitim matematičkim izračunima mjeriti i minutni volumen i drugi hemodinamski parametri (srčani indeks, sistemski vaskularni otpor, plućni vaskularni otpor, udarni volumen, udarni indeks, radni indeks desne i lijeve klijetke) – Slika 3.6.
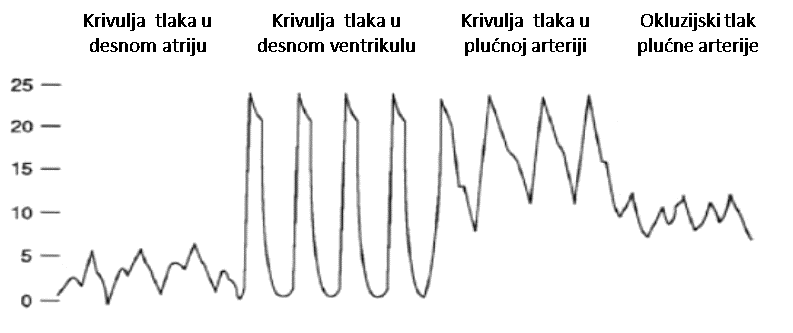
Slika 3.6. Krivulje tlakova pri kateterizaciji plućne arterije Swan-Ganzovim kateterom (mmHg)
Ostale metode nadzora kardiocirkulatornog nadzora. Primjenom metoda LiDCO (od engl. lithium dilution cardiac output) i PiCCO (od engl. pulse contour cardiac output) dobivaju se slični hemodinamski parametri kao i kod kateterizacije plućne arterije. Pri promatranju tkivne perfuzije najčešće se primjenjuju tonometrija mukoze gastrointestinalnoga sustava te vrijednost saturacije miješane venske krvi koja se uzima iz plućne arterije pomoću Swan-Ganzova katetera. Na temelju dobivenih vrijednosti može se procijeniti stanje potrošnje kisika i perfuzije perifernih tkiva.
Metode nadzora respiratorne funkcije. ajznačajnije metode nadzora respiratorne funkcije su pulsna oksimetrija, kapnometrija i kapnografija te plinske analize arterijske krvi.
Pulsna oksimetrija omogućava mjerenje arterijske oksigenacije periferne krvi na principu spektrofotometrije i dio je osnovnoga nadzora bolesnika u jedinici intenzivnoga liječenja. Senzori pulsnoga oksimetra postavljaju se na periferiju (prsti, uška) te se spajaju s glavnim monitorom na kojemu se ispisuje izmjerena vrijednost saturacije arterijske krvi. Iako je laka i korisna, ta metoda ima brojna ograničenja koja treba uzeti u obzir pri interpretaciji nalaza: 1) metoda je onemogućena kod bolesnika s hiperpigmentacijom, hiperbilirubinemijom ili značajnom anemijom; 2) periferna vazokonstrikcija (hladnoća, primjena vazopresora) može dovesti do lažno niske vrijednosti uslijed usporenoga i smanjenog protoka krvi; 3) pri pulsnoj oksimetriji oksihemoglobin se ne razlikuje od karboksihemoglobina i methemoglobina te 4) prisutnost laka za nokte smanjuje vrijednost izmjerene saturacije arterijske krvi.
Kapnometrija označava mjerenje koncentracije ugljičnoga dioksida tijekom svakoga izdaha, a njegova koncentracija na kraju izdaha (etCO2, od engl. end-tidle CO2) približno je jednaka vrijednosti parcijalnoga tlaka ugljičnoga diokisida (PaCO2) u arterijskoj krvi. Kapnometrija je sastavni dio praćenja respiratorne funkcije intubiranih bolesnika kod kojih se kapnometar spaja s enotrahealnim tubusom i tako omogućava nesmetano mjerenje vrijednosti etCO2 koje se ispisuju na monitoru kao brojčana vrijednost ili kao grafička krivulja (kapnografija). Povišene vrijednosti etCO2 ukazuju na hipoventilaciju (poremećaj alvelokapilarne membrane, bolesti dišnih puteva) ili pojačan metabolizam (pojačano stvaranje ugljičnoga dioksida). Mjerenje etCO2 sastavni je dio i provjere pravilnoga položaja enotrahealnoga tubusa (pri intubaciji jednjaka ne dobivamo krivulju etCO2), a može biti i znak iskrvarenja. Također, povećanje vrijednosti etCO2 s nemjerljivih ili niskih vrijednosti na normalne tijekom reanimacijskoga postupka znak je zadovoljavajuće perfuzije.
Plinska analiza arterijske krvi (PAAK) predstavlja najobjektivniju procjenu respiratorne funkcije, a obuhvaća mjerenje vrijednosti parcijalnih tlakova kisika i ugljičnoga dioksida (PaO2, PaCO2), pH te vrijednosti bikarbonata i manjka baza iz krvi uzorkovane iz neke od perifernih arterija (radijalna, brahijalna, femoralna). Njihovom analizom utvrđuje se postojanje hiper- ili hipoksije, hiper- ili hipokapnije te s njima povezane respiracijske acidoze ili alkaloze.
Metode nadzora moždane funkcije ponajprije uključuju klinički nadzor (utvrđivanje stanja svijesti, uočavanje neuroloških deficita i ispada pri neurološkom pregledu) uz nadopunu nekom od specifičnih pretraga, kao što su CT ili MR mozga, elektroencefalografija, lumbalna punkcija i sl. U posebnim je okolnostima moguće i praćenje vrijednosti intrakranijskoga tlaka što je od manjega interesa u jedinicama intenzivnoga liječenja internističkih bolesnika. Primjena scintigrafije mozga koristi se u procjeni moždane smrti komatoznih bolesnika.
Ostale metode nadzora uključuju nadzor bubrežne funkcije (mjerenje diureze, praćenje vrijednosti metabolita dušika u krvi), nadzor probavnoga sustava (auskultacija peristaltike, praćenje stolice, povrat sadržaja na nazogastričnu sondu – razvoj retencije, ultrazvučne i endoskopske emtode), nadzor jetrene funkcije i funkcije gušterače (laboratorijsko praćenje, praćenje stanja svijesti – portalna encefalopatija, ultrazvučni pregled), mjerenje intraabdominalnoga tlaka i sl.
Laboratorijsko praćenje kao metoda nadzora bolesnika u jedinici intenzivnoga liječenja također predstavlja bitan dio cjelokupnoga praćenja bolesnika, osobito kod bolesnika s poremećajem stanja svijesti koji ne može usmeno ukazati na neko novonastalo zbivanje. Ipak, laboratorijskim pretragama treba pristupati racionalno, kako bi se izbjegle bespotrebne učestale venepunkcije (za svako određivanje krvi bolesniku se odstranjuje oko 10 mL krvi). Također, u jedinicama intenzivnoga liječenja često se nalaze i priručni tzv. point-of-care laboratorijski uređaji koji omogućuju brzu analizu krvi (uređaji za mjerenje plinske analize arterije krvi, uređaj za rotacijsku tromboelastometriju i sl.).
Zaključak. Unatoč postojanju različitih naprednih, invazivnih i neinvazivnih metoda nadzora vitalno ugroženoga bolesnika, u jedinici intenzivnoga liječenja osnovni nadzor čini dobar klinički pregled bolesnika.
OSNOVE MEHANIČKE VENTILACIJE
Uvod. Mehanička ventilacija predstavlja postupak pružanja strojne, umjetne potpore disanju i predstavlja jednu od najznačajnijih potpornih mjera liječenja u jedinicama intenzivne skrbi. Omogućava potpuno ili djelomično nadomještanje respiratorne funkcije kod bolesnika s razvijenom respiratornom insuficijencijom. U osnovi se razlikuju dva temeljna oblika mehaničke ventilacije: neinvazivna i invazivna. Neinvazivna mehanička ventilacija je ona pri kojoj se zrak upuhuje u bolesnika različitim sučeljima koja ne zahtijevaju osiguranje dišnoga puta endotrahealnim tubusom, supraglotičnim pomagalom ili endotrahealnom kanilom, dok invazivna mehanička ventilacija zahtijeva osiguranje dišnoga puta nekime od navedenih pomagala. Osnovni fiziološki ciljevi mehaničke ventilacije su poboljšanje alveolarne ventilacije, povećanje plućnih volumena te redukcija rada pri disanju.
Indikacije. Mehanička ventilacija indicirana je kod svih bolesnika koji ne dišu ili je njihovo disanje nedostatno, što se može očitovati značajnom hipoksemijom i/ili hiperkapnijom te respiracijskom acidozom, ali mehanička ventilacija može biti indicirana i kod bolesnika s poremećenim stanjem svijesti te pojačanim i otežanim dišnim radom. Odluka o primjeni mehaničke ventilacije temelji se na individualnoj kliničkoj procjeni.
Princip rada ventilatora. Uređaj koji omogućava mehaničku ventilaciju pluća naziva se ventilator, s obzirom na to da on primarno nadomješta funkciju ventilacije, a ne respiracije, iako je u kliničkoj praksi uvriježen naziv respirator. Današnji ventilatori djeluju na principu stvaranja pozitivnoga tlaka (tzv. ventilatori pozitivnoga tlaka), budući da upuhuju zrak pod pozitivnim tlakom u dišne puteve bolesnika, bilo preko umjetnih dišnih puteva (tubusi, kanile), bilo preko različitih sučelja neinvazivne ventilacije (maske, kacige). Glavni je zadatak ventilatora osiguranje gradijenta tlaka između gornjih dišnih puteva i alveola (što omogućava kretanje zraka) te proizvodnja inspiracijske sile kojom se vrši upuhivanje zadane smjene plinova u bolesnika. Tijekom inspirija se plinovi upuhuju kroz jednu cijev iz ventilatora prema bolesniku, a tijekom ekspirija odvode kroz drugu cijev nazad u ventilator, što je omogućeno inspiracijskim i ekspiracijskim valvulama. Cijeli je proces nadziran brojnim senzorima i mikroprocesorima kojima se omogućava isporuka smjese plinova prema unaprijed zadanim parametrima (volumen, tlak, vrijeme).
Osnovni respiracijski parametri koji se koriste pri mehaničkoj ventilaciji su respiracijski volumen, frekvencija disanja, maksimalni tlak u dišnim putevima, koncentracija kisika u inspiriranom zraku, pozitivni tlak na kraju ekspirija te inspiratorna tlačna potpora.
Respiracijski volumen (VT) volumen je zraka isporučen u bolesnika za vrijeme jednoga inspirija. Danas se preporuča korištenje manjih respiracijskih volumena, obično 6 do 8 ml/kg tjelesne mase, u odnosu na ranije primjenjivane volumene (i do 15 ml/kg tjelesne mase).
Frekvencija disanja (RR) značava broj respiracija koje ventilator omogućuje tijekom jedne minute. Obično iznosi 10 do 20, iako se pri nekim stanjima preporuča viša frekvencija (npr. kod bolesnika s hiperkapnijom povećanjem broja respiracija poboljšava se eliminacija ugljičnoga dioksida iz organizma).
Maksimalni tlak u dišnim putevima (Pmax) predstavlja gornju dopuštenu vrijednost tlaka u dišnim putevima tijekom respiracije. Ako se dosegne ta vrijednost tlaka, ventilator će automatski prestati s daljnjim upuhivanjem zraka čime se sprečava moguće mehaničko oštećenje pluća (prevencija barotraume i volutraume). Maksimalni tlak u dišnim putevima obično se postavlja na vrijednost 30 do 35 mbar.
Koncentracija kisika u inspiriranom zraku (FiO2) predstavlja koncentraciju (udio) kisika u smjesi plinova koju se upuhuje u bolesnika. Njezina vrijednost kreće se od 21 % (0.21), što podrazumijeva da se u bolesnika upuhuje sobni zrak, do 100 % (1.0), što podrazumijeva da se u bolesnika upuhuje čisti kisik. Pri mehaničkoj ventilaciji teži se postizanju zadovoljavajuće saturacije i oksemije uz primjenu što nižih vrijednosti FiO2.
Pozitivni tlak na kraju ekspirija (PEEP, positive end-expiratory pressure) predstavlja pozitivan tlak koji ostaje u alveolama na kraju ekspirija i onemogućava da alveole kolabiraju (Slika 3.7.). Njegovim povećanjem povećava se i promjer alveole, pri čemu se povećava respiratorna površina, a sprečavanjem kolabiranja alveola smanjuje se dišni rad koji je potreban da bi se one ponovno ekspandirale. Njegove se vrijednosti kreću od 0 do 15 mbar jer vrijednosti veće od 15 mbar ne dovode do značajnijega povećanja volumena, a nose rizik od rupture.
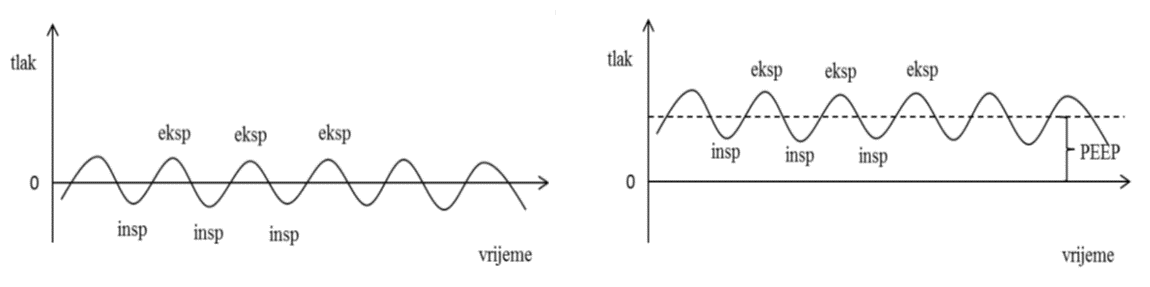
Slika 3.7. Prikaz tlakova u dišnim putevima bez potpore (lijevo) i s tlačnom potporom – PEEP (desno)
Inspiratorna tlačna potpora (PS) predstavlja dodatan tlak pod kojime se vrši upuhivanje zraka u bolesnika i kojime se svladava otpor dišnih puteva. Uobičajene vrijednosti inspiratorne tlačne potpore kreću se od 0 do 10 mbar, ali prema potrebi mogu biti i više.
Dodatni respiracijski parametri mogućavaju prilagođavanje ventilacije bolesnikovim potrebama, a uključuju odnos inspirij:ekspirij, trajanje platoa (Tplat %), nagib (engl. slope), okidač (engl. trigger) te trajanje inspirija (Ti).
Odnos inspirij:ekspirij (I:E) označava parametar kojime se podešava trajanje odnosa inspirija prema ekspriju. On se normalno postavlja na 1:2 što znači da ekspirij traje dvostruko duže od inspirija, a može se postaviti i na vrijednost 1,5:1.
Trajanje platoa (Tplat%) predstavlja inspiracijsku pauzu koja se izražava u postotku trajanja vremena inspirija. Obično se on u zadanim postavkama namješta na nulu (0).
Nagib (engl. slope) označava brzinu kojom se doseže zadani inspiratorni protok. Nagib može biti oštar, što označava brže vrijeme dosega zadanoga protoka, ili može biti blag, što označava duže vrijeme dosega zadanoga protoka.
Okidač (engl. trigger) predstavlja inspiracijski napor bolesnika koji će ventilator zamijetiti kao pokušaj bolesnika da udahne i na temelju kojega će isporučiti zrak. Taj se parametar koristi kod oblika mehaničke ventilacije kod kojih bolesnik ima vlastite udahe s kojima se ventilator mora sinkronizirati. Kao okidač se može staviti protok ili tlak (promjena u protoku ili tlaku koji nastaje uslijed bolesnikova samostalnog pokušaja da ostvari udah). Osjetljivost okidača na tlak postavlja se na 0,5 do 2 mbar, a ako se radi o protoku, onda se osjetljivost postavlja na 2 - 3 L/min.
Trajanje inspirija (Ti) označava parametar kojime se podešava vremensko trajanje inspirija u sekundama. Trajanje inspirija obično se podešava na trajanje između 2 i 10 sekundi.
Vrste mehaničke ventilacije. Podjela mehaničke ventilacije može se temeljiti na dva osnovna kriterija: udjelu bolesnikova spontanog disanja te na kontrolnoj (konstantnoj) varijabli tijekom mehaničke ventilacije.
Mehanička ventilacija prema udjelu bolesnikova spontanog disanja. S obzirom na udio spontanoga disanja tijekom mehaničke ventilacije, razlikuju se tri oblika mehaničke ventilacije: kontrolirano strojno disanje, asistirano strojno disanje te spontano disanje. Kod kontroliranoga strojnog disanja bolesnik uopće ne diše niti ima pokušaja udaha te stroj isporučuje inspirij prema unaprijed zadanim parametrima. Kod asistiranoga strojnog disanja bolesnik ima vlastitih pokušaja udaha, ali su oni nedostatni. Stroj prepoznaje takve udahe na temelju postavke okidača (engl. trigger) te ih u konačnici dovršava. Kod spontanoga disanja bolesnici spontano dišu, ali je svaki njihov inspirij strojno potpomognut (pozitivan tlak na kraju ekspirija, inspiratorna tlačna potpora).
Mehanička ventilacija prema kontrolnoj (konstantnoj) varijabli. S obzirom na kontrolnu (konstantnu) varijablu, razlikujemo volumenom i tlakom kontrolirano disanje. Volumenom kontrolirano disanje ono je kod kojega je konstatntna varijabla volumen, dok je tlak promjenjiva varijabla. Pri volumenom kontroliranoj ventilaciji u postavkama se postavlja zadani volumen koji se treba upuhati u bolesnika i stroj vrši inspirij sve dok se ne dosegne taj volumen, bez obzira na vrijednost tlaka. Tlakom kontrolirano disanje podrazumijeva tlak kao konstantnu varijablu, dok je volumen promjenjiv. Kod toga načina ventilacije u postavkama se postavlja zadani tlak koji se mora dosegnuti u dišnim putevima tijekom inspirija te inspirij traje sve dok se on ne dosegne, bez obzira na količinu volumena koja se pri tome primjenjuje.
Najčešći modaliteti mehaničke ventilacije. Najčešći modaliteti mehaničke ventilacije koji se primjenjuju u svakodnevnoj kliničkoj praksi prikazani su u Tablici 3.9. te su detaljnije opisani u daljnjem tekstu.
|
Tablica 3.9. Najčešći modaliteti mehaničke ventilacije
|
|
Volumenom kontrolirana ventilacija
|
Tlakom kontrolirana ventilacija
|
|
Kontrolirana mehanička ventilacija (CMV)
Asistirana kontrolirana mehanička ventilacija (A/C)
Sinkronizirana intermitentna mandatorna ventilacija (SIMV)
|
Tlačno kontrolirana ventilacija (PCV)
Tlačno potpomognuta ventilacija (PSV)
Pozitivni tlak na kraju ekspirija (CPAP)
|
Kontrolirana mehanička ventilacija (CMV, od engl. controlled mandatory ventilation) označava potpunu respiracijsku kontrolu, a primjenjuje se kod bolesnika koji nemaju nikakvih spontanih ventilacija. Ventilator prema unaprijed zadanim parametrima upuhuje zrak u bolesnika, a temeljni respiracijski parametri pri ventilaciji bolesnika na taj način su volumen zraka koji se isporučuje tijekom udaha te frekvencija (broj) udaha u jednoj minuti. Taj se modalitet ventilacije još naziva i IPPV (od engl. intermitet positive pressure ventilation), ako je PEEP nula, ili CPPV (od engl. continuous positive pressure ventilation) ako je PEEP veći od nule.
Asistirano kontrolirana strojna ventilacija (A/C, od engl. assisted/controlled ventilation) označava djelomičnu respiracijsku potporu koja se primjenjuje kod bolesnika s očuvanim vlastitim udasima. Ventilator potpomaže svaki bolesnikov spontani udah pri čemu bolesnik određuje frekvenciju, a ventilator dišni volumen (na ventilatoru se namještaju željeni inspiracijski volumen i osjetljivost okidača, što znači da će ventilator kada prepozna bolesnikov udah osigurati isporuku zadanoga volumena). Ukoliko bolesnik ne aktivira respiracijski ciklus, ventilator će automatski nastaviti isporučivati zadani volumen frekvencijom koja je postavljena kao najniža (odnosno prebacuje se u CMV način).
Sinkronizirana intermitentna mandatorna ventilacija (SIMV, od engl. synchronized intermittent mandatory ventilation) jedan je od najčešćih modaliteta koji se koristi u kliničkoj praksi s obzirom na to da predstavlja kombinaciju mandatorne ventilacije i spontanoga disanja. Ventilator zadanim (mandatornim) udasima niske frekvencije upuhuje zadani volumen zraka kao u A/C načinu uz omogućavanje samostalnoga disanja (svojom frekvencijom i volumenom) između zadanih respiracija. Spontano disanje bolesnika između zadanih udaha može se potpomoći pozitivnim tlakom na kraju ekspirija, kao i inspiratornom tlačnom potporom.
Minutna mandatorna ventilacija (MMV, od engl. minute mandatory ventilation) noviji je modalitet mehaničke ventilacije koja koristi kombinaciju spontanoga disanja i kontrolirane ventilacije, kao i SIMV način, ali ventilator nadzire izdahnuti minutni volumen te ga automatski uspoređuje sa zadanim (željenim) minutnim volumenom i u odnosu na njegovu vrijednost povećava ili smanjuje frekvenciju zadanih udaha, čime se omogućuje veći doprinos bolesnikova disanja zadanom minutnom volumenu.
Tlačno kontrolirana ventilacija (PCV, od engl. pressure controlled ventilation) predstavlja inačicu kontrolirane mandatorne ventilacije, s time da su temeljni parametri pri ovome načinu ventilacije tlak (vrijednost tlaka koji se postiže u dišnom putu) te respiratorna frekvencija. S obzirom na to da udasi nisu sinkronizirani s bolesnikovim pokušajima udaha, ako ih ima, ovaj se modalitet, kao i CMV, preporuča samo kod bolesnika koji nemaju vlastite udahe i nisu budni.
Tlačno potpomognuta ventilacija (PSV, od engl. pressure support vetilation) podrazumijeva spontano disanje koje je tlačno potpomognuto, odnosno disanje u kojemu bolesnik samostalno započinje udah koji ventilator prepoznaje te ga potpomaže inspiratornom tlačnom potporom (PS). Volumen disanja pri tome je različit i ovisi o razini zadane tlačne potpore, kao i o bolesnikovom inspiracijskom naporu. Taj je način ventilacije indiciran samo kod bolesnika koji imaju očuvane vlastite udahe. Naziva se još i ASB (engl. assisted spontaneous breathing).
Kontinuirano pozitivan tlak u dišnim putevima (CPAP, od engl. continous positive airway pressure) podrazumijeva oblik spontane ventilacije pri kojemu se održava stalno pozitivan tlak u dišnom putu. On se temelji na primjeni pozitivnoga tlaka na kraju ekspirija (PEEP) koji povećava respiratornu površinu te olakšava dišni rad. Taj se oblik ventilacije primjenjuje samo kod bolesnika koji spontano dišu, i to najčešće u kombinaciji s PSV-om (CPAP/PSV).
Ostali oblici mehaničke ventilacije, koji se rjeđe koriste, su inverzna ventilacija (IRV, od engl. inverse ratio ventilation) pri kojoj je trajanje inspirija dulje od trajanja ekspirija čime se nastoji poboljšati oksigenacija te visokofrekventna ventilacija (HFV, od engl. high frequency ventilation) koja omogućava primjenu malih volumena uz visoku frekvenciju disanja čime se smanjuje oštećenje pluća posredovano volumenom, što ima veliku ulogu kod bolesnika s akutnim respiratornim distres sindromom (tzv. ultraprotektivan način mehaničke ventilacije).
Nadzor bolesnika na mehaničkoj ventilaciji. Tijekom provođenja mehaničke ventilacije potreban je stalan nadzor respiratorne funkcije, a to se postiže redovnim i učestalim kliničkim pregledima, pulsnom oksimetrijom, kapnometrijom i kapnografijom te povremenim plinskim analizama arterijske krvi.
Klinički pregled osnovna je metoda nadzora respiratorne funkcije. Pri pregledu je potrebno obratiti pozornost na frekvenciju disanja te uočiti znakove asinkronije bolesnikovih udaha s ventilatorom, odnosno uočiti tzv. znakove borbe bolesnika s ventilatorom. Pojava cijanoze i marmorizacije kože također ukazuju na lošu ventilaciju.
Pulsna oksimetrija predstavlja spektrofotometrijsku metodu koja omogućava mjerenje zasićenosti (saturacije) hemoglobina kisikom na razini arteriola, što neizravno ukazuje na respiratornu funkciju. Pulsni oksimetar postavlja se na okrajine (prsti, uške, nos, čelo) te se povezuje s centralnim monitorom koji osim brojčanoga ispisa vrijednosti saturacije prikazuje i njezin grafički izgled u obliku krivulje. Normalne vrijednosti saturacije hemoglobina kisikom mjereno tom metodom iznose više od 90 %. Interpretacija ovoga nalaza može biti otežana i nepouzdana kod bolesnika s teškom anemijom, perifernom vazokonstrikcijom, patološkom hemoglobinemijom, kod tamnoputih bolesnika i sl.
Kapnometrija i kaponografija odnose se na metode mjerenja i bilježenja vrijednosti parcijalnoga tlaka ugljičnoga dioksida u izdahnutom zraku (etCO2, end-tidal CO2). Vrijednosti ugljičnoga dioksida na kraju ekspirija približno odgovaraju njegovim vrijednostima u alveolama. Princip kapnometrije sastoji se od apsorpcije infracrvenoga svjetla ugljičnoga dioksida (Mainstream meoda, Siole metoda), a dobivene vrijednosti izražavaju se u mmHg i kPa. Povišene vrijednosti ukazuju na hiperkapniju, a niske vrijednosti na neodgovarajuću ventilaciju (dislokacija tubusa ili cijevi) ili promjene u kvaliteti (anemija, krvarenje) ili kvantiteti plućnoga krvotoka (plućna embolija). Uredne vrijednosti etCO2 kreću se između 35 i 45 mmHg.
Plinske analize arterijske krvi podrazumijevaju određivanje vrijednosti parcijalnoga tlaka kisika i ugljičnoga dioksida u arterijskoj krvi te vrijednosti pH, što predstavlja najobjektivniji pokazatelj respiratorne funkcije. Zbog učestalih uzorkovanja arterijske krvi koja zahtijevaju opetovane punkcije perifernih arterija, preporuča se postavljanje intraarterijske kanile iz koje se može uzorkovati arterijska krv.
Odvajanje bolesnika od mehaničke ventilacije označava postupak postupnoga ukidanja strojne ventilacijske potpore, uvjetovan stanjem bolesnika. Odvajanje se vrši postupnim smanjenjem tlačne potpore i omogućavanjem većega udjela spontanoga disanja (SIMV, CPAP, BiPAP), a potom i potpunim odvajanjem od strojne potpore. Pokazatelji koji upućuju na nedostatnost spontanoga disanja i nemogućnost odvajanja od strojne ventilacijske potpore su: tahipneja (> 25/min), bradipneja (< 8/min), mali respiracijski volumeni (< 300 mL), tahikardija (> 110/min), pojava srčanih aritmija i sl.
Komplikacije mehaničke ventilacije mogu biti vezane uz umjetni dišni put, ventilaciju pozitivnim tlakom, promjene acidobaznoga statusa te uz promjene na tjelesnim sustavima.
Komplikacije vezane uz umjetni dišni put mogu biti povezane sa samim postupkom osiguranja dišnoga puta - intubacijom (traumatske lezije gornjih dišnih puteva, laringospazam, krvarenje) ili uz njegovu dugotrajnu prisutnost (ulceracije, infekcije, fistule). Umjetni dišni put uzrokuje i pogodnost razvoja respiratornih infekcija, osobito upala pluća (VAP, od engl. ventilator-associated pneumonia).
Komplikacije vezane uz ventilaciju pozitivnim tlakom povezane su s rupturom alveola uslijed visokoga tlaka (barotrauma) ili velikoga volumena zraka (volutrauma), što se klinički može očitovati pneumotoraksom, pneumomedijastinumom, pneumoperitoneumom, zračnom embolijom ili subkutanim emfizemom.
Komplikacije vezane uz promjene acidobaznog statusa. Neodgovarajuća ventilacija može biti uzrokom promjena acidobazne ravnoteže arterijske krvi. Hiperventilacija rezultira smanjenjem vrijednosti parcijalnoga tlaka ugljičnoga dioksida, što u konačnici vodi u respiracijsku alkalozu, dok hipoventilacija ima suprotan učinak, tj. rezultira nakupljanjem ugljičnoga dioksida i posljedičnom respiracijskom acidozom.
Komplikacije vezane uz promjene na tjelesnim sustavima. Primjena mehaničke ventilacije pozitivnim tlakom može dovesti do promjena u funkciji različitih organskih sustava, posebno kardiovaskularnoga. Porast intratorakalnoga tlaka koji nastaje uslijed primjene pozitivnoga tlaka tijekom ventilacije prenosi se na srce i velike krvne žile što se ponajprije očituje na sustavu donje i gornje šuplje vene gdje dolazi do smanjenja venskoga priljeva (engl. preload) i posljedičnoga smanjenja srčanoga izbačaja (minutni volumen). Iz tih razloga bolesnici s oslabljenim kardiovaskularnim sustavom ne mogu kompenzirati to stanje te razvijaju hipotenziju s posljedičnom cerebralnom i splanhičnom hipoperfuzijom. Kao posljedica splanhične hipoperfuzije dolazi do aktivacije kompenzacijskih mehanizama, kao što su aktivacija sustava renin-angiotenzin-aldosteron i povećano lučenje antidiuretskoga hormona što dovodi do dodatnoga povećanja intravaskularnoga volumena. Smanjen minutni volumen može biti uzrokom cerebralne hipoperfuzije s pratećim kvalitativnim ili kvantitativnim poremećajem stanja svijesti.
Neinvazivna mehanička ventilacija predstavlja oblik strojne potpore disanju koja ne zahtijeva umjetni dišni put (endotrahealni ili nazotrahealni tubus, enotrahealna kanila, supraglotično pomagalo i sl.). Princip neinvazivne mehaničke ventilacije jednak je kao i kod invazivne te podrazumijeva primjenu tlaka koji je viši od atmosferskoga tlaka u alveolarnom prostoru tijekom inspirija. Neinvazivna ventilacija temelji se na primjeni PEEP-a koji održava alveole otvorenima (sprečava kolaps) i povećava respiratornu površinu te na promjeni inspiratorne tlačne potpore kojom se pojačava bolesnikom inspiratorni napor. Neinvazivna ventilacija može se primjenjivati isključivo kod bolesnika koji su pri svijesti i suradljivi su. Najčešće su indikacije kardiogeni plućni edem i egzacerbacija kronične opstruktivne plućne bolesti, ali se može primijeniti i kod drugih oblika respiratorne insuficijencije. Neinvazivna mehanička ventilacija kontraindicirana je kod nesuradljivih bolesnika i bolesnika s poremećenim stanjem svijesti, s nedavnom operacijom dišnih ili probavnih organa, s kraniofacijalnim ozljedama, s visokim rizikom od aspiracije te kod bolesnika s opstrukcijom dišnoga puta. Glavna sučelja kojima se isporučuje zadana smjesa zraka iz ventilatora u dišne puteve bolesnika su nazalna maska, oronazalna maska, usnik, totalna facijalna maska i kaciga (helmet) – Slika 3.8. Ovisno o trajanju i vrijednostima PEEP-a, razlikujemo dva oblika ventilacije: NIV-CPAP (engl. continuous positive airway pressure) i NIV-BiPAP (engl. biphasic positive airway pressure). Glavni su ciljevi neinvazivne ventilacije postizanje kliničkoga poboljšanja bolesnika, postizanje odgovarajućega minutnog volumena i saturacije hemoglobina kisikom te ispravak plinskih analiza i acidobaznoga statusa arterijske krvi.

Slika 3.8. Sučelja za primjenu NIV-a (redom): nazalna maska, oronazalna maska, usnik, totalna facijalna maska, kaciga (helemt)
Ostale potporne metode respiratorne funkcije. U slučaju neuspjeha invazivne mehaničke ventilacije u pogledu stabilizacije respiratorne funkcije dostupne su i druge invazivne metode, kao što su ekstrakorporalna eliminacija ugljičnoga dioksida te venovenska ekstrakorporalna membranska oksigenacija.
Ekstrakorporalna eliminacija ugljičnog dioksida (ECCO2R) rezervirana je za bolesnike s razvijenim akutnim respiratornim distres sindromom (ARDS) koji imaju potrebu za provođenjem ultraprotektivne ventilacije, odnosno ventilacije volumenom manjim od 6 ml/kg, s ciljem sprječavanja volutraume i barotraume ionako vulnerabilnih pluća. Kako bi se osigurala dostatna minutna ventilacija, kod takvih se bolesnika primjenjuje visoka frekvencija disanja, što je dostatno za osiguranje odgovarajuće vrijednosti parcijalnoga tlaka kisika u arterijskoj krvi, ali nije dostatno za eliminaciju ugljičnoga dioksida, pri čemu dolazi do razvoja hiperkapnije i respiracijske acidoze. Kako bi se spriječila ta hiperkapnija, bolesnike se priključuje na posebne uređaje s membranama koje omogućavaju eliminaciju ugljičnoga dioksida, što se radi metodom ekstrakoroporalne cirkulacije (metoda je slična kontinuiranim metodama dijalize) – Slika 3.9. Ultraprotektivna ventilacija uz istodobnu primjenu ekstrakoroporalne eliminacije ugljičnoga dioksida omogućuje tlačno i volumno rasterećenje pluća što povećava vjerojatnost za rezoluciju patohistoloških promjena i oporavak plućne funkcije.
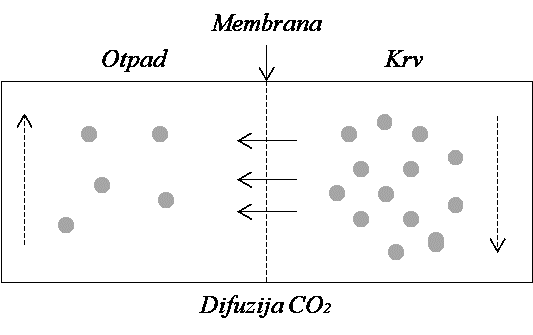
Slika 3.9. Shematski prikaz principa rada ECCO2R
Venovenska ekstrakorporalna membranska oksigenacija (VV-ECMO) postupak je koji omogućava potpunu zamjenu plućne funkcije čime se omogućava ventilacija pluća u poštednom režimu s ciljem izbjegavanja oštećenja pluća mehaničkom ventilacijom. Postupak je indiciran kod bolesnika s teškim ARDS-om kod kojih je plućna funkcija toliko oštećena da se niti uz mjere mehaničke ventilacije ne može postići njezina zadovoljavajuća stabilizacija ili je ona moguća uz izrazito visoke volumene i tlakove, što uzrokuje dodatno mehaničko oštećenje plućnoga tkiva. Sam ECMO postupak nije kurabilna metoda, kao niti mehanička ventilacija, nego omogućava preživljenje bolesnika do oporavka plućne funkcije. Postupak se sastoji od dreniranja krvi iz venskoga sustava preko katetera postavljenoga u jednu od centralnih vena u ekstrakorporalni krug koji sadrži oksigenator u kojemu se vrši ekstrakcija ugljičnoga dioksida te oksigenacija kisikom, a nakon toga se ponovno vraća u venski sustav preko katetera postavljenoga u drugu centralnu venu (Slika 3.10.). Postavljanje bolesnika na VV-ECMO pri ARDS-u ima smisla samo ako se to radi u prvih sedam dana bolesti dok dominira eksudacijska faza bolesti, dok kasnije nastaju ireverzibilne fibrozne promjene, pa sam postupak nema smisla. Indikacija za VV-ECMO postavlja se kod bolesnika koji imaju oksigenacijski indeks manji od 35, a on se dobiva matematičkim izračunom: FiO2 x MAP (srednji arterijski tlak)/PaO2 (parcijalni tlak kisika arterijske krvi). Ujedno, oksigenacijski indeks predstavlja i prognostički kriterij te njegova vrijednost viša od 35 označava 80 %-tnu prediktivnu smrtnost bolesnika. Glavne su kontraindikacije mehanička ventilacija koja traje dulje od sedam dana, imunosupresija, nedavno krvarenje u središnji živčani sustav, kao i sve ostale kontraindikacije za sustavnu heparinizaciju koja je nužna pri ekstrakorporalnoj cirkulaciji, uznapredovala životna dob, maligna uznapredovala bolest i sl. Smrtnost bolesnika vezana uz ovaj postupak visoka je i kreće se oko 50 %.
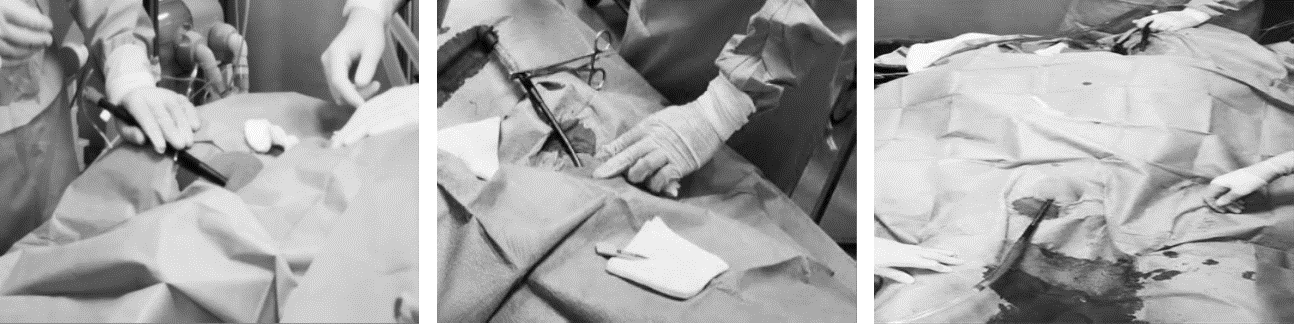
Slika 3.10. Osiguranje krvožilnog pristupa za postupak VV-ECMO (desna unutarnja jugularna vena i desna femoralna vena)
Definicija. Kardiorespiratorni arest predstavlja nagao zastoj u radu srca (kardijalni arest) i disanja (respiratorni arest) koji osobu vodi u smrt. S obzirom na to da su rad srca i disanje usko povezani, zastoj u radu jednoga od njih ubrzo će rezultirati zastojem drugoga: kada je primarni događaj kardijalni arest, respiratorni arest nastupit će unutar najviše 30 sekundi, dok u slučaju respiratornoga aresta kao primarnoga događaja kardijalni arest nastupa unutar tri minute. Bez obzira na primarni događaj (zastoj srca ili zastoj disanja), konačni ishod je isti, a on uključuje potpuni zastoj krvnoga optoka te sistemsku anoksiju i smrt stanica, osobito neurona koji su najosjetljiviji na ishemiju (unutar pet minuta gotovo sve moždane stanice izumiru i dolazi do nepovratnoga oštećenja mozga).
Epidemiologija. Kardiovaskularne bolesti najčešći su uzrok smrti u Hrvatskoj i u svijetu i čine oko 40 % svih uzroka smrti osoba u dobi iznad 75 godina starosti. Nakon reanimacije započete izvan medicinske ustanove, bolničko preživljenje iznosi oko 5 do 10 %, dok rana reanimacija i defibrilacija u kontroliranim, bolničkim uvjetima (započeta unutar 1 do 2 minute od aresta) mogu rezultirati preživljenjem većim od 60 %.
Etiologija. Iako je najčešći uzrok kardiorespiratornoga aresta srčane prirode, on može biti uzrokovan i drugim bolestima i stanjima, tako da uzroke kardiorespiratornoga aresta dijelimo u tri skupine: kardijalni, respiratorni i opći (Tablica 3.10.). Kardijalni uzroci dominiraju kod starijih osoba, dok respiratorni i opći uzroci dominiraju kod djece i u mlađoj dobi. Prema kliničkome nastupu, razlikujemo iznenadan (neočekivan) kardiorespiratorni arest, koji se razvija unutar sat vremena od početnih simptoma u do tada naizgled zdravih pojedinaca, ili može biti očekivan (predvidiv), koji se razvija kod teško oboljelih osoba (akutnih, kroničnih) čija priroda bolesti i težina stanja predstavljaju rizičan čimbenik za razvoj kardiopulmonalnoga aresta.
|
Tablica 3.10. Etiologija kardiorespiratornoga aresta
|
|
Kardijalni uzroci
|
Respiratorni uzroci
|
Opći uzroci
|
|
Koronarna bolest
Sindrom srčanoga popuštanja
Miokarditis i kardiomiopatije
Stečene valvularne greške
Aritmogeni poremećaji (produljeni QT, WPW sindrom)
|
Opstrukcija dišnoga puta (strano tijelo, bronhospazam)
Bolesti respiracijske površine
Slabost mišićnoga rada (mišići, živci)
Promjene u prsnom košu (hemato-, pneumotoraks)
|
Metabolički poremećaji
Toksični uzroci (akutna intoksikacija)
Fizikalni agensi (trauma, toplina, hladnoća, elektricitet)
Refleksni uzroci (podražaj parasimpatikusa)
|
Klinička slika. Tri su osnovna znaka kardiorespiratornoga aresta: gubitak svijesti, prestanak disanja te prestanak cirkulacije. Gubitak svijesti u pravilu nastupa unutar 15 sekundi od razvoja aresta uslijed ishemije moždane kore. Ponekad gubitku svijesti prethodi prolazan napad u vidu klonično-toničnih grčeva nalik velikom epileptičkom napadaju. Prestanak disanja javlja se vrlo brzo nakon prekida srčane akcije. Prije pojave apneje često se kod bolesnika viđaju agonalne respiracije u vidu rijetkih i dubokih udaha. Prestanak cirkulacije karakterizira promjena boje kože (cijanoza, marmorizacija) uz produljeno kapilarno punjenje i nemogućnost palpacije pulsa na perifernim arterijama.
Dijagnoza kardiorespiratornoga aresta postavlja se na osnovi kliničkoga pregleda. Svim bolesnicima s kardiorespiratornim arestom potrebno je što prije učiniti elektrokardiogram kako bi se otkrilo o kojoj se vrsti arestne aritmije radi (asistolija, električna aktivnost srca bez pulsa, ventrikularna tahikardija bez pulsa ili ventrikularna fibrilacija) zbog daljnjega terapijskog pristupa i zbrinjavanja. Za procjenu ritma kod takvih se bolesnika ne smije gubiti vrijeme s 12-kanalnim elektrokardiogramom, nego se on provjerava putem pedala defibrilatora ili postavljanjem tri elektrode na prsni koš (desno rame, lijevo rame, lijeva prednja aksilarna linija u razini vrška srca) koje su spojene s defibrilatorom ili monitorom. Cijeli postupak mora biti brz i usklađen jer se sa svakom sekundom odgode kardiopulmonalne reanimacije smanjuju izgledi za njezinu uspješnost, odnosno za preživljenje bolesnika.
Klinički pregled osobe sa sumnjom na kardiorespiratorni arest mora biti brz i ne bi trebao trajati duže od 10 do 15 sekundi. Odmah prilikom pristupa osobi bez svijesti potrebno ju je protresti i pitati čuje li nas. Ako ne reagira na poziv i protresanje, bolesnik je bez svijesti te je potrebno provjeriti diše li i ima li puls, odnosno cirkulaciju. Disanje i puls provjeravaju se istodobno na način da se jednom rukom zabaci glava bolesnika kako bi se otvorio dišni put, dok se drugom rukom palpira puls nad karotidnom arterijom uz slušanje, promatranje i osjećanje bolesnikova disanja (glava osobe koja pregleda bolesnika namještena je tako da uhom pokušava čuti disanje bolesnika, osjeti eventualno strujanje zraka na licu ako bolesnik diše uz istodobno promatranje pomičnosti prsnoga koša). Ukoliko je bolesnik bez svijesti, ne diše i nema pulsa, on je u kardiorespiratornom arestu i treba što prije pozvati pomoć, odnosno osigurati defibrilator (monitor) kojime će se provjeriti srčani ritam.
Provjera srčanog ritma ključna je za zbrinjavanje takvih bolesnika. Razlikuju se četiri osnovna arestna ritma: asistolija, električna aktivnost srca bez pulsa (elektromehanička disocijacija), ventrikularna tahikardija bez pulsa te fibrilacija atrija. Asistolija označava potpuni prestanak srčane aktivnosti (električne i mehaničke) što se na elektrokardiogramu prezentira kao ravna, blago sinusoidna linija ("ravna crta"). Električka aktivnost srca bez pulsa (PEA, od engl. pulseless electrical activity) označava prestanak mehaničke srčane aktivnosti pri čemu se registira električni potencijal miokarda u obliku pojave pravilnoga ili nepravilnog QRS-kompleksa, ali se puls ne palpira te, ukoliko je dostupna, ehokardiografija ne pokazuje znakove srčane kontrakcije. Ventrikularna tahikardija bez pulsa označava stanje u kojemu se ventrikul kontrahira frekvencijom većom od 250/min pri čemu je dijastola toliko skraćena da se ventrikuli ne stignu napuniti krvlju, pa ni nemaju što izbaciti, zbog čega se razvija hemodinamski (cirkulatorni) arest. Taj poremećaj ritma kratko traje i brzo prelazi u fibrilaciju ventrikula. Ventrikularna fibrilacija označava stanje kaotične električne aktivnosti ventrikula koja uzrokuje treperenje ventrikula, ali ne i njegovu kontrakciju kojom bi se iz njega izbacila krv.
Liječenje kardiorespiratornoga aresta podrazumijeva provođenje kardiopulmonalne reanimacije (oživljavanje). Mjere naprednoga održavanja života (ALS, od engl. advance life support) podrazumijevaju kardiopulmonalnu reanimaciju koja uključuje napredne mjere održavanja dišnoga puta i disanja, vanjsku masažu srca, defibrilaciju te primjenu lijekova dok mjere osnovnoga održavanja života (BLS, od engl. basic life support) označavaju samo primjenu vanjske masaže srca i umjetnoga disanja bez medicinskih pomagala i uređaja. U nastavku teksta naglasak će biti na naprednim mjerama održavanja života. Algoritam naprednoga održavanja života prikazan je shematski (Slika 3.11.), a temelji se na što ranijem prepoznavanju ritma jer se liječenje kardiopulmonalne reanimacije razlikuje ovisno o prisutnosti ritmova koji se defibriliraju i ritmova koji se ne defibriliraju.
Napredne mjere održavanja dišnog puta i disanja u bolničkim uvjetima podrazumijevaju hitnu endotrahealnu intubaciju i pripajanje na mehaničku ventilaciju. Primjena orofaringealnoga ili nazofaringealnog tubusa te supraglotičkih pomagala opravdana je kao privremena mjera održavanja dišnoga puta do endotrahealne intubacije. Načini i pomagala održavanja dišnoga puta opisani su u poglavlju o osiguravanju krvožilnoga i dišnog puta. Asistirano disanje, osim primjene mehaničke ventilacije, može uključivati i isporuku zraka putem samoširećega balona (tzv. ambu-balon) na koji se može priključiti dotok kisika tako da se u bolesnika upuhuje vanjski zrak obogaćen kisikom. Pri postupku kardiopulmonalne reanimacije, ako dišni put nije osiguran supraglotičnim pomagalom ili endotrahealnim tubusom, pri provođenju vanjske masaže mora se poštovati odnos 30:2, odnosno na svakih 30 kompresija prsnoga koša slijede dva upuha zraka, dok se kod bolesnika s dišnim putem osiguranim supraglotičnim pomagalom ili endotrahealnim tubusom vanjska masaža srca i asistirano disanje odvijaju paralelno (100 kompresija prsnoga koša, 10 - 12 upuha zraka).
Vanjska masaža srca uz asistirano disanje čini osnovu kardiopulmonalne reanimacije. Vanjska masaža srca zamjenjuje ulogu srca kao pumpe, a izvodi se kompresijama na prsni koš pri čemu srce i velike krvne žile bivaju komprimirani između prednje stijenke prsnoga koša i kralješnice zbog čega se istiskuje krv iz njih, dok se njihovo punjenje vrši u vremenu između kompresija uslijed stvaranja negativnoga tlaka. Frekvencija kompresija treba iznositi 100 u minuti, a vremenski odnos kompresija i dekompresija mora treba biti u odnosu 50 %:50 %. Vanjska masaža srca može se provoditi manualno ili uz pomoć posebnih uređaja namijenjenih vanjskoj masaži srca. Pri manualnoj vanjskoj masaži srca kompresija se vrši na sredinu donjega dijela prsne kosti ispruženim dlanovima (ruka na ruku) isprepletenih prstiju.
Defibrilacija označava prolazak istosmjerne struje kroz miokard, dovoljne jakosti da dovede do depolarizacije stanica miokarda i time omogući predvodniku (SA-čvor) da preuzme kontrolu nad stvaranjem srčanoga impulsa. Defibrilacija je osnovni način liječenja ventrikularne fibrilacije i ventrikularne tahikardije bez pulsa. Ovisno o načinu rada razlikujemo bifazne i monofazne defibrilatore, a prema načinu upotrebe manualne i automatske. Danas su gotovo svi defibrilatori bifazni jer omogućavaju isporuku manje energije uz bolju uspješnost u odnosu na monofazne (početna energija treba iznositi 150 J, a druga i sljedeće se mogu povećavati do 360 J). U okviru pružanja stručne medicinske pomoći koriste se manualni defibrilatori, dok su automatski defibrilatori ponajprije namijenjeni laicima (postavljaju se obično na javnim mjestima). Standardni položaj elektroda pri defibrilaciji podrazumijeva postavljanje jedne elektrode ispod desne ključne kosti, dok se druga postavlja u srednju aksilarnu liniju na položaju V6. Alternativni položaji su antero-posteriorni (jedna elektroda preko sredine lijevoga prekordija, a druga straga iza srca ispod lijeve lopatice), postero-lateralni (jedna elektroda u srednjoj aksilarnoj liniji na položaj V6, a druga straga preko desne lopatice) te biaksilarni (jedna elektroda na lijevu lateralnu stijenku prsnoga koša, a druga nasuprot na desnu lateralnu stijenku). Tijekom isporuke električnoga šoka za vrijeme defibrilacije potrebno je primjenjivati mjere sigurnosti (prostor mora biti suh, tijekom postupka nitko ne smije biti u kontaktu s bolesnikom, udaljiti izvor kisika minimalno jedan metar od bolesnikovih prsa).
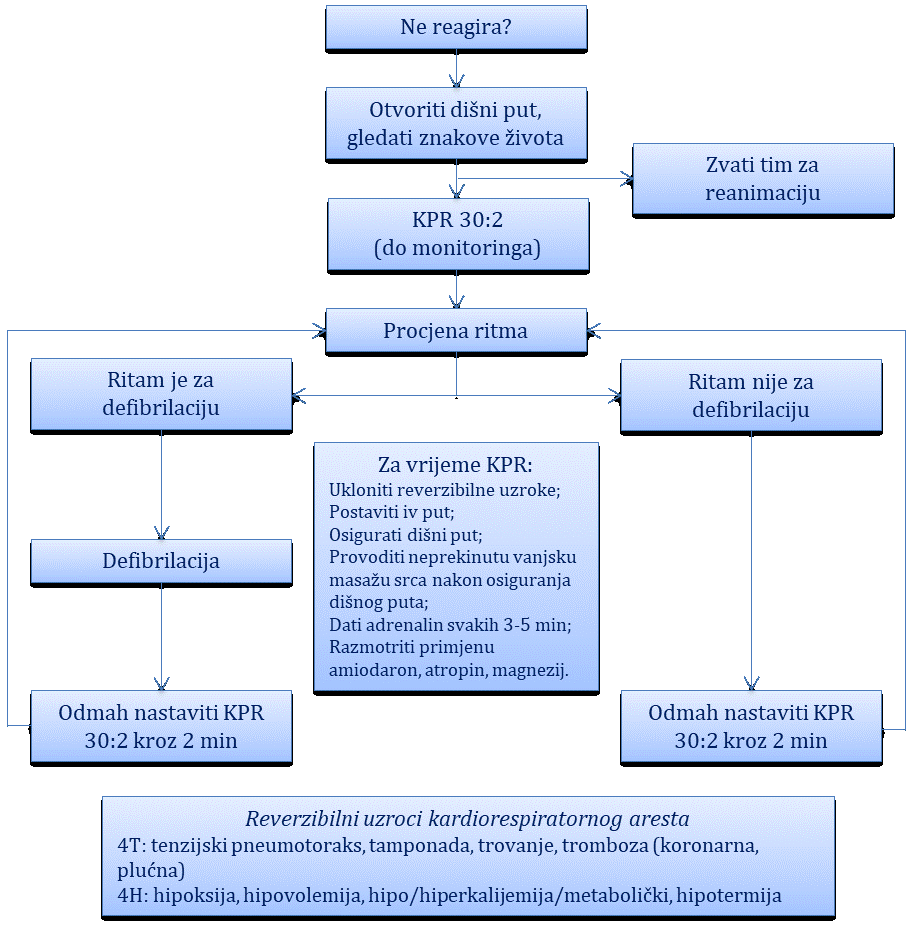
Slika 3.11. Shematski prikaz naprednoga održavanja života
Arestne aritmije koje se liječe defibrilacijom (engl. shockable rhythms) su ventrikularna fibrilacija (VF) i ventrikularna tahikardija bez pulsa (VTBP), a osnovni pristup liječenju takvih bolesnika je što ranija defibrilacija (Slika 3.12.). Uspješnost reanimacije kod tih bolesnika ovisi o brzini kojom se primjenjuje defibrilacija (u prvoj minuti ona iznosi više od 90 %, a sa svakom minutom opada za 7 do 10 %). Defibrilaciju treba izvesti što je ranije moguće, a određeno razdoblje kardiopulmonalne reanimacije prije provjere ritma i defibrilacije više se ne preporučuje. Nakon isporuke defibrilacijskoga šoka treba odmah nastaviti s kardiopulmonalnom reanimacijom bez provjere ritma ili pulsa neposredno nakon defibrilacije te se ona treba provoditi kroz dvije minute do sljedeće provjere ritma (ako se uspostavi učinkovit ritam, vanjska masaža srca neće povećati rizik vraćanja VF/VT, a s druge strane, pri poslijedefibrilacijskoj asistoliji vanjska masaža srca može izazvati VF). Kod osvjedočenoga VF/VT (pacijent je na monitoru) moguće je odmah isporučiti tri šoka u slijedu te nakon trećega nastaviti s kardiopulmonalnom reanimacijom kroz dvije minute (ta se tri šoka promatraju kao jedan). Važno je vanjsku masažu srca svesti na najmanji mogući period prekida zbog defibrilacije (kod manualne defibrilacije ne treba prekidati masažu dok se defibrilator puni). Interval između prestanka masaže i isporuke šoka treba biti manji od 5 sekundi. Ako se koriste bifazni defibrilatori, početna energija šoka treba iznositi 150 J, a druga i sljedeće mogu se povećavati do 360 J, dok kod monofaznih defibrilatora prvi i sljedeći šokovi trebaju iznositi 360 J. Ako VF/VTBP perzistira, nakon trećega šoka primjenjuju se adrenalin (1 mg iv) te amiodaron (300 mg iv), što se ponavlja i nakon petoga šoka ako VF/VTBP perzistira i dalje, a potom se nastavlja s adrenalinom svakih tri do pet minuta.
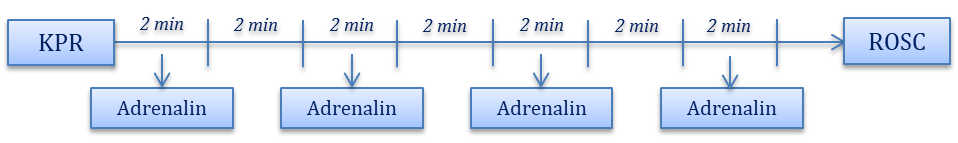
Slika 3.12. Algoritam KPR-a uz aritmije koje se liječe defibrilacijom
Arestne aritmije koje se ne liječe defibrilacijom (engl. non-shockable rhythms) su asistolija i električna aktivnost srca bez pulsa (elektromehanička disocijacija) – Slika 3.13. Temelj liječenja tih poremećaja čini kardiopulmonalna reanimacija uz primjenu adrenalina (1 mg iv) svakih tri do pet minuta i provjera ritma svake dvije minute, kao i kod aritmija koje se liječe defibrilacijom. U slučaju da se pri provjeri ritma zabilježe VF ili VTBP, nastavlja se algoritam liječenja za arestne aritmije koje se liječe defibrilacijom, a isto vrijedi i za obrnuti slijed.
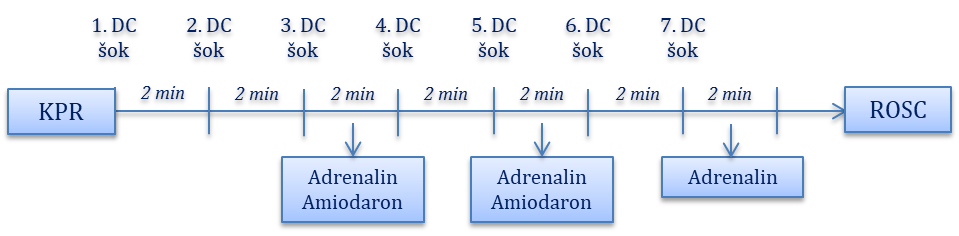
Slika 3.13. Algoritam KPR-a uz aritmije koje se ne liječe defibrilacijom
Ostali lijekovi u reanimaciji. Kisik treba primjenjivati tijekom cijeloga reanimacijskog postupka, bilo putem mehaničkoga ventilatora, bilo putem samoširećega balona. Atropin, iako se često daje pri reanimaciji bolesnika s asistolijom i električnom aktivnosti srca bez pulsa, nije dio smjernica i algoritma ERC-a i stoga nije obvezan, a ako se primjenjuje pri toj indikaciji, daje se u dozi od 3 mg iv. Primjena bikarbonata pri reanimaciji ograničena je na nekoliko indikacija: srčani zastoj u hiperkalijemiji, trovanje tricikličkim antidepresivima te u postreanimacijskoj fazi u slučaju da se ne postiže odgovarajuća korekcija metaboličke acidoze (unatoč odgovarajućoj mehaničkoj ventilaciji). Bikarbonati se primjenjuju u dozi od 50 mL 8,4 %-tnog NaHCO3. Otopina kalcija primjenjuje se u slučaju aresta povezanoga s hiperkalijemijom, hipokalcijemijom te trovanjem blokatorima kalcijskih kanala ili magnezijem, a daje se u dozi od 10 mL 10 %-tne otopine CaCl2. Magnezijev sulfat primjenjuje se u liječenju posebnoga oblika ventrikularne fibrilacije ("torsade de pontes") te u slučaju hipomagnezijemije, a daje se u dozi od 2 g 50 %-tne otopine MgSO4 pomiješane s 10 do 100 mL 5 %-tne glukoze.
Ostala pitanja vezana uz reanimaciju. Kardiopulmonalna reanimacija provodi se do pojave uspostave spontane cirkulacije (ROSC, od engl. recovery of spontaneous circulation) ili do proglašenja smrti. Na odluku o proglašenju smrtnoga ishoda utječu sljedeći čimbenici: trajanje srčanoga zastoja prije početka reanimacije, trajanje same reanimacije, prethodno zdravstveno stanje bolesnika te ostalo (dob i sl.). Reanimacija se ne započinje u sljedećim okolnostima: postojanje ozljeda nespojivih sa životom, kada je prošao duži vremenski period od nastupa srčanoga zastoja (osim u slučajevima hipotermije i trovanja lijekovima), kada postoje podaci da se radi o bolesniku s terminalnom fazom neizlječivih bolesti te kada su prisutni sigurni znaci smrti.
Postupak s bolesnikom nakon reanimacije. Nakon uspostave spontane cirkulacije potrebno je što hitnije učiniti 12-kanalni elektrokardiogram te uzeti krv za laboratorijske pretrage. Kada elektrokardiogram ukazuje na akutnu ishemiju, indicirana je hitna koronarografija. Kod bolesnika kod kojih se isključi akutni koronarni sindrom potrebno je snimiti CT mozga i CT angiografiju plućne arterije kako bi se isključila akutna intrakranijska zbivanja i akutna plućna tromboembolija pluća (iako nove smjernice sugeriraju ehokardiografiju kao pretragu izbora kod hemodinamski nestabilnih bolesnika s klinički suspektnom plućnom embolijom, umjesto CT angiografije). Bolesnike se nakon reanimacije smješta u jedinice intenzivnoga liječenja.
Postreanimacijska skrb započinje trenutkom pojave spontane cirkulacije i traje sve do kliničke stabilizacije bolesnika. Usmjerena je na optimiziranje funkcije organa primjenom specifičnih lijekova i postupaka. Osnovni postupci usmjereni su na stabilizaciju kardiorespiratornoga sustava, održavanje funkcije i sprečavanje razvoja oštećenja mozga te ispravak metaboličkih poremećaja. Stabilizacija kardiorespiratornoga sustava podrazumijeva zadovoljavajuću primjenu volumena i vazoaktivnih lijekova (vazopresori, inotropi) te primjenu mehaničke ventilacije ako bolesnik nedostatno diše ili je poremećenoga stanja svijesti. Sedacija bolesnika s ciljem prevencije moždanih oštećenja provodi se uz indikaciju, odnosno prema procjeni liječnika (sedirani bolesnici imaju smanjene metaboličke potrebe za kisikom i energijom). Jedna od metoda prevencije moždanih oštećenja je i terapijska hipotermija koja poboljšava ishode bolesnika nakon moždane hipoksije. Ona se sastoji od indukcije hipotermije, održavanja hipotermije te ponovnoga zagrijavanja. Metode mogu biti različite, a najčešće su to infuzije otopina ohlađenih na temperaturu od 4℃, primjena intravaskularnoga izmjenjivača topline uvođenjem posebnih katetera u femoralnu ili potključnu venu te primjenom kardiopulmonalne premosnice. Kako bi se spriječio tremor (drhtavica), primjenjuje se magnezijev sulfat (5 g/5 sati). Temperaturu se nadzire termometrom postavljenim u mokraćni mjehur ili jednjak. Cilj je terapijske hipotermije postići unutarnju temperaturu tijela od 32 ℃ do 34 ℃ te je održavati kroz 24 sata, a potom bolesnika ponovno zagrijati brzinom od 0,25 ℃ do 0,5 ℃ na sat.
AKUTNI RESPIRATORNI DISTRES SINDROM
Definicija i epidemiologija. Akutni respiratorni distres sindrom (ARDS) predstavlja akutnu difuznu upalnu ozljedu pluća koju mogu uzrokovati različite bolesti i stanja. Klinički je karakterizira naglo nastala respiratorna insuficijencija hipoksemijskoga tipa te radiološki nalaz koji uključuje difuzne bilateralne plućne infiltrate. Radi se o teškoj bolesti koja, ako ju se ne prepozna i pravodobno ne započne liječiti, kod većine bolesnika završava smrtnim ishodom. Procjenjuje se da između 10 do 15 % bolesnika primljenih u jedinice intenzivnoga liječenja, kao i oko 20 do 25 % bolesnika na mehaničkoj ventilaciji, ispunjava kriterije akutnoga respiratornog distres sindroma.
Klinički se bolest definira prema Berlinskim kriterijima iz 2012. godine, a oni su sljedeći: 1) pojava simptoma unutar jednoga tjedna od početka djelovanja nokse uz postupnu progresiju simptoma; 2) prisutnost bilateralih, difuznih radioloških plućnih infiltrata (RTG, CT) koji se ne povezuju s atelektazom, plućnim nodusima i efuzijom; 3) kliničko stanje bolesnika ne povezuje se sa srčanim popuštanjem ili volumnim preopterećenjem.
Također, prema Berlinskoj definiciji razlikujemo tri oblika bolesti: blagi, umjereni i teški akutni respiratorni distres sindrom. Kategorizacija se zasniva na omjeru vrijednosti parcijalnoga tlaka kisika u arterijskoj krvi (PaO2) izraženoga u milimetrima žive (mmHg) te vrijednosti frakcije (udjela) kisika u udahnutom zraku (FiO2) izraženoga u decimalama (ako bolesnik udiše sobni zrak, postotak kisika u udahnutome zraku iznosi 21 %, a izraženo u decimalama je to 0.21). Blagi oblik bolesti karakterizira PaO2/FiO2 omjer između 200 i 300, umjereni između 100 i 200, a teški manji od 100. Većina bolesnika ima umjereni oblik bolesti (50 %), dok manji broj ima blagi (30 %) ili teški oblik (20 %).
Etiopatogeneza. ARDS nastaje kao posljedica difuznoga alveolarnog oštećenja kojega mogu uzrokovati različite bolesti i stanja. Patofiziološku osnovu bolesti čini oslobađanje proupalnih citokina, kao što su TNF-α, IL-1, IL-6 te IL-8, kao odgovor na djelovanje nokse. Proupalni citokini dovode do kemotaksije neutrofilnih leukocita u intersticijski prostor gdje se oni aktiviraju te izlučuju različite medijatore, kao što su proteaze i slobodni kisikovi radikali koji posreduju oštećenje endotela plućnih kapilara, kao i alveolarnoga endotela. Posljedično dolazi do transudacije tekućine, izlaska proteina i krvnih stanica u intersticij i alveole (nekardiogeni edem pluća) gdje zajedno sa staničnim detritusom čine konsolidacijska žarišta koja se na radiološkim snimkama vide kao mrljasta, difuzna, bilateralna zasjenjenja (infiltrati).
Glavne su patofiziološke posljedice takvoga stanja: 1) smanjen kapacitet respiracije, odnosno izmjene plinova (smanjena respiratorna površina, edematozna alveokapilarna membrana), 2) smanjena plućna popustljivost koja zahtijeva pojačan mišićni respiratorni rad (konsolidacijska žarišta povećavaju krutost pluća) te 3) razvoj plućne hipertenzije (vazokonstrikcija uvjetovana hipoksijom, vaskularna kompresija izazvana edemom).
Najčešće bolesti i stanja koja uvjetuju razvoj ARDS-a ona su koja uzrokuju izravno difuzno oštećenje pluća, kao što je aspiracijski pneumonitis, upala pluća, trauma i operacije prsnoga koša, inhalacijske opekline, lijekovi i radioterapija i sl., te stanja praćena nastankom citokinske oluje, kao što su sepsa, pankreatitis, višestruka trauma, opsežne opekline, masivna transfuzija i ozljeda pluća izazvana transfuzijom (TRALI, od engl. transfusion-relate acute lung injury), transplantacija matičnih stanica i sl.
Patohistologija. Patohistološke promjene pluća kod bolesnika s ARDS-om (tzv. šok na pluća) prate određen vremenski slijed. Prvih sedam do deset dana bolest obilježava tzv. rani eksudativni stadij karakteriziran intersticijskim edemom, staničnom infiltracijom u kojoj dominiraju neutrofili te stvaranjem tzv. eozinofilnih hijalnih membrana uz rub alveola. Nakon te faze slijedi fibroproliferativni stadij karakteriziran rezolucijom edema te postupnim razvojem fibrozne organizacije konsolidacijskih žarišta (infiltracija miofibroblasta, kolagenski depoziti), proliferacijom pneumocita tipa II te skvamoznom metaplazijom. Taj stadij traje dva do tri tjedna, a nastavlja se ireverzibilnim fibrotičkim stadijem kojega karakterizira potpuna fibrozna organizacija konsolidacijskih žarišta uz narušavanje normalne plućne arhitekture i razvoj kronične respiratorne insuficijencije.
Klinička slika. ARDS karakteriziraju simptomi i znakovi osnovne bolesti koja je dovela do njegova razvoja te postupni razvoj akutne respiratorne insuficijencije, što se obično zbiva unutar 6 do 72 sata od nastupa inicijalnih simptoma osnovne bolesti, iako se ona može razviti i unutar prvih sedam dana. Osnovna klinička manifestacija akutne respiratorne insuficijencije kod bolesnika s ARDS-om pojava je brzoprogresivne dispneje pri čemu su bolesnici tahipnoični, tahikardični, cijanotični te imaju razvijeni obrazac disanja pomoćnom dišnom muskulaturom (uvlačenje juguluma i međurebrenih prostora, dominantno abdominalni obrazac disanja). Često su prisutni i povišena tjelesna temperatura, bol u prsima, kašalj i iskašljavanje, hemoptize, a u uznapredovalim fazama bolesti dolazi i do razvoja poremećaja stanja svijesti.
Dijagnoza ARDS-a zasniva se na kliničkoj slici i kliničkom nalazu, osnovnim laboratorijskim nalazima te radiološkoj dijagnostici. Paralelno s tim pretragama provode se i pretrage s ciljem isključenja drugih potencijalnih uzroka takvoga stanja, kao i otkrivanja uzročne bolesti ako ona nije poznata.
Laboratorijski nalazi bolesnika su nespecifični. Osnovnu laboratorijsku dijagnostiku kod njih čini plinska analiza i acidobazni status arterijske krvi. Početno se kod tih bolesnika prati parcijalna (hipoksemijska) respiratorna insuficijencija s pridruženom metaboličkom alkalozom koja nastaje kao posljedica tahipneje, kompenzacijskoga mehanizma kojime se nastoji ispraviti nastala hipoksemija. S napredovanjem bolesti hipoksemija se produbljuje, a postupno se razvija i hiperkapnija s respiracijskom acidozom koja predstavlja ozbiljan znak respiracijske ugroženosti i prijetećega zastoja disanja. Prate se i ostali laboratorijski nalazi, kao što su kompletna i diferencijalna krvna slika, koagulogram, upalni parametri, jetreni i bubrežni pokazatelji, elektroliti, laktati i sl., a njihove vrijednosti ovise o osnovnoj bolesti, kao i o pridruženim komplikacijama.
Radiološka dijagnostika ključna je za postavljanje dijagnoze ARDS-a (Slika 3.14.). Za to je često dovoljna klasična radiografska snimka srca i pluća kojom se prikazuju karakteristična nehomogena, mrljasta zasjenjenja koja su difuzno i nepravilno raspoređena na oba plućna krila. Rendgenogram srca i pluća osim uloge u postavljanju dijagnoze ARDS-a može biti značajan i za postavljanje dijagnoze uzročne bolesti (npr. nalaz upalne konsolidacije ili zračnoga bronhograma kod bakterijske upale pluća), kao i za isključenje bolesti koje se mogu slično manifestirati (npr. znakovi srčanoga popuštanja i volumnoga opterećenja). Kod nejasnih bolesnika, kao i u svrhu diferenciranja uzroka, izvodi se i kompjuterizirana tomografija koja omogućava detaljniju i bolju patomorfološku procjenu plućnoga parenhima.
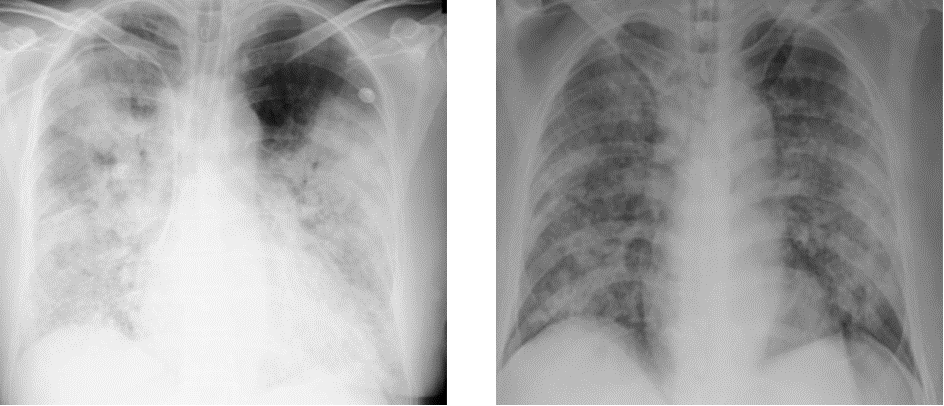
Slika 3.14. Radiološki primjeri ARDS-a (obostrana inhomogena, mrljasta zasjenjena)
Ostale dijagnostičke metode metode idu u dva smjera. Jedan smjer podrazumijeva isključenje akutnoga srčanog popuštanja i volumnoga preopterećenja što se laboratorijski i radiološki može manifestirati gotovo identično kao i ARDS, a drugi predstavlja dijagnostiku i obradu bolesti u podlozi, tj. bolesti koja je dovela do razvoja ARDS-a. Osnovne dijagnostičke metode kojima se procjenjuje i isključuje akutno srčano popuštanje i volumno preopterećenje su elektrokardiografija, ehokardiografija te laboratorijsko određivanje vrijednosti NT-proBNP-a. Postavljanje dijagnoze osnovne uzročne bolesti obično se temelji na anamnestičkim podacima te na patološkim vrijednostima laboratorijskih nalaza koji mogu na nju ukazivati i usmjeravati daljnji dijagnostički tijek (npr. povišene vrijednosti amilaza i lipaza ukazuju na mogući akutni pankreatitis, osobito uz anamnestičke podatke o bolovima u trbuhu, mučnini i povraćanju). Visok diferencijalno-dijagnostički značaj kod ovih bolesnika ima i bronhoskopija s izvođenjem bronhoalveolarne lavaže (ili mini-bronhoalveolarne lavaže) pri čemu se uzroci mogu mikrobiološki, citološki i biokemijski analizirati što može biti značajno pri razlučivanju upalne od neupalne etiologije ARDS-a.
Diferencijalna dijagnoza ARDS-a je široka te obuhvaća različite bolesti i stanja: akutni kardiogeni plućni edem, bilateralna upala pluća, difuzna alveolarna hemoragija, akutna eozinofilna upala pluća, plućni vaskulitis (sistemski eritematozni lupus, Wegenerova granulomatoza, Goodpastureov sindrom, Churg-Straussov sindrom), kriptogena organizirajuća upala pluća, akutni intersticijski pneumonitis, akutna egzacerbacija idiopatske plućne fibroze, akutna fibrozirajuća organizirajuća upala pluća te diseminirana maligna bolest.
Liječenje ARDS-a u prvom se redu temelji na liječenju uzročne bolesti u podlozi, što i predstavlja ključni dio čitavoga procesa liječenja, a paralelno s time provode se mjere liječenja hipoksemije, kao i ostalih potpornih mjera liječenja. Liječenje ARDS-a provodi se u jedinicama intenzivnoga liječenja s mogućnosti pružanja mehaničke ventilacijske potpore.
Liječenje hipoksemije. Stabilizacija respiratorne funkcije odvija se kroz nekoliko uzastopnih koraka. Osnovnu respiracijsku potporu čini primjena kisika preko nazalnoga katetera ili maske za kisik, što može biti dostatno samo kod manjega broja bolesnika s blagim oblikom ARDS-a koji povoljno i brzo reagiraju na liječenje osnovne, uzročne bolesti. Kada se kod bolesnika ne postiže respiratorna stabilizacija primjenom oksigenoterapije, indicirana je neinvazivna mehanička ventilacija, ako ona nije kontraindicirana i bolesnik je suradljiv. Ona omogućuje postizanje željene vrijednosti PEEP-a u alveolama, što sprečava njihov kolaps, smanjuje se dišni rad i osigurava određena inspiratorna tlačna potpora. To se postiže različitim modalitetima, kao što su NIV-CPAP ili NIV-BiPAP, a to je detaljno opisano u poglavlju o mehaničkoj ventilaciji. Ako se kod bolesnika ne postiže respiratorna stabilizacija neinvazivnom mehaničkom ventilacijom, ili je ona kontraindicirana (poremećeno stanje svijesti bolesnika, klaustrofobija, aktivno povraćanje i sl.), indicira se endotrahealna intubacija te invazivna mehanička ventilacija. Pri provođenju invazivne mehaničke ventilacije vodimo se režimom poštedne ventilacije, odnosno nastoji se postići zadovoljavajuća saturacija arterijske krvi uz primjenu što manjih volumena i tlakova koje isporučuje ventilator, kako bi se spriječile dodatne mehaničke ozljede pluća (barotrauma, volutrauma), s obzirom na njihovu vulnerabilnost. Ako se niti invazivnom mehaničkom ventilacijom ne postiže odgovarajuća respiratorna resuscitacija, u obzir dolazi liječenje metodom ekstrakorporalne cirkulacije – venovenska ekstrakorporalna membranska oksigenacija (VV-ECMO) koja omogućava izvantjelesnu oksigenaciju krvi (vrši ulogu umjetnih pluća), čime se nastoji premostiti period dok se pluća bolesnika ne oporave i ne postignu stanje u kojemu mogu ponovno preuzeti respiratornu funkciju. Kao međukorak između invazivne mehaničke ventilacije u režimu poštedne ventilacije i VV-ECMO procedure, sve više se provodi mehanička ventilacija u tzv. ultrapoštednom režimu (ventilacija izuzetno niskim volumenima i visokom dišnom frekvencijom) kojom se nastoji izbjeći dodatno opterećenje pluća volumenima i tlakovima koje isporučuje ventilator, što je obično dostatno za postizanje zadovoljavajuće saturacije, ali ne i za eliminaciju ugljičnoga dioksida pri čemu bolesnici razvijaju hiperkapniju i metaboličku acidozu, zbog čega se u tom koraku mora primijeniti metoda ekstrakorporalne eliminacije ugljičnoga diokisida. Ta se metoda provodi u nekim centrima, ali njezina uspješnost nije potkrijepljena velikim studijama. Također, oksigenacija se poboljšava tijekom mehaničke ventilacije postavljanjem bolesnika u potrbušni položaj (engl. prone position) te primjenom tzv. recruitment manevara koji podrazumijevaju kratkotrajnu primjenu visokih intrapulmonalnih tlakova s ciljem distenzije alveola. Više je o načinima i mogućnostima respiratorne resuscitacije pisano u poglavlju o osnovama mehaničke ventilacije.
Medikamentno liječenje ARDS-a ARDS-a podrazumijeva primjenu analgetika, sedativa i neuromišićnih blokatora, glukokortikoida te plućnih vazodilatatora. Analgosedacija i neuromišićna relaksacija smatraju se, između ostaloga, ključnim koracima tijekom provođenja mehaničke ventilacije bolesnika, osobito ako se pri tome primjenjuju visoki tlakovi. To ima dvojaku ulogu: s jedne strane rješava bolesnika neugodnoga osjećaja i bolova tijekom mehaničke ventilacije koji mogu potrajati i kroz dulji vremenski period, a s druge se strane smanjuje otpor stijenke prsnoga koša koji stvaraju respiratorni mišići, što omogućuje lakšu ekspanziju pluća tijekom ventilacije (smanjuje se potreba za primjenom visokih tlakova tijekom ventilacije bolesnika). Analgetici, sedativi i neuromuskularni blokatori koji se primjenjuju u ovoj prilici opisani su u poglavlju o farmakoterapiji u jedinici intenzivnoga liječenja. Primjena glukokortikoida kod ovih bolesnika temelji se na činjenici da je ARDS u svojoj osnovi upalno posredovana bolest. Ipak, oni se ne primjenjuju rutinski kod svih bolesnika, a njihova primjena opravdana je kod bolesnika u prvoj fazi bolesti (do 14 dana), i to kod bolesnika koji imaju umjeren ili teški ARDS koji ne pokazuje poboljšanje primjenom drugih metoda liječenja. Glukokortikoid izbora je metilprednizolon u dozi od 1 mg/kg/dan. Primjena plućnih vazodilatatora, kao što su dušični oksid i prostaciklin, nisu dio kliničke prakse u liječenju ARDS-a i predmet su različitih kliničkih studija.
Ostalo potporno liječenje podrazumijeva provođenje metoda prevencije nazokomijalnih upala pluća (toaleta dišnoga puta, antibiotska profilaksa), profilakse duboke venske tromboze (niskomolekularni heparin) i gastrointestinalnoga krvarenja (inhibitori protonske pumpe) uz odgovarajuću nutritivnu potporu (enteralna, parentrelna prehrana) i kontrolu glikemije.
Prognoza. ARDS je teška bolest praćena relativno visokom stopom smrtnosti, osobito ako se radi o teškom obliku bolesti i bolesnicima s od ranije prisutnim višestrukim komorbiditetima. Prognoza bolesnika ovisi i o osnovnoj, uzročnoj bolesti u podlozi.
MASIVNO KRVARENJE I HEMORAGIJSKI ŠOK
Definicija. Masivno krvarenje i hemoragijski šok predstavljaju životno ugrožavajuća stanja koja se ubrajaju u hitnoće prvoga reda i nalažu neodgodivo zbrinjavanje i liječenje. Šok (krvotočni urušaj) definira se kao poremećaj cirkulacije koji rezultira generaliziranom hipoperfuzijom i tkivnom ishemijom koja može uzrokovati razvoj višeorganskoga zatajenja. Šok koji nastaje kao posljedica gubitka intravaskularnoga volumena, odnosno krvarenja, zove se hemoragijski šok. Masivno krvarenje definira se kao naglo nastao, iznenadan gubitak jednoga volumena krvi (oko 5 L) unutar 24 sata ili gubitak polovine od ukupnoga volumena krvi (oko 2,5 L) unutar tri sata. Masovno krvarenje i hemoragijski šok povezani su s visokom stopom smrtnosti i zahtijevaju liječenje u jedinici intenzivne skrbi.
Etiologija. Najčešći uzroci masivnoga krvarenja su: 1) traumatska krvarenja (vanjska ili unutarnja), 2) gastrointestinalna krvarenja (varikoziteti jednjaka, krvareći ulkus, angiodisplazije), 3) vaskularni poremećaji (ruptura aneurizme aorte, disekcija aorte, ruptura arteriovenskih malformacija) te 4) ginekološko-opstetrička krvarenja (ruptura ektopične trudnoće, ruptura hemoragične ciste jajnika, abrupcija posteljice, postpartalna krvarenja). Masivno krvarenje može se javiti i kod manje dramatičnih događaja kod osoba koje imaju sklonost krvarenju (hemoragijska dijateza), kao što su bolesnici s trombocitopenijom, poremećenim koagulogramom, bilo zbog bolesti, bilo zbog lijekova (antikoagulantna terapija) i sl.
Patofiziologija. Nastanak masivnoga krvarenja, bez obzira na njegovu etiologiju, dovodi do trenutne aktivacije kompenzacijskih mehanizama koji za cilj imaju očuvanje perfuzije vitalnih organa (mozak, srce, pluća), što se naziva centralizacija krvotoka. To ima visok značaj s obzirom na to da su baš ti organi najosjetljiviji na ishemiju koja vrlo brzo dovodi do njihove disfunkcije i stanične smrti, u odnosu na druge organe koji mogu preživjeti dulji period u uvjetima hipoperfuzije i ishemije, prvenstveno zahvaljujući staničnim mehanizmima koji se aktiviraju u anaerobnim uvjetima, a dovode do zaustavljanja metaboličkih aktivnosti i stanicu uvode u tzv. stanje hibernacije. Kosti, mišići i koža najotporniji su na ishemiju, pa se u uvjetima krvarenja najprije smanjuje protok kroz njih, a potom kroz visceralne organe (organi probavne cijevi, jetra, bubrezi). Najraniji i prvi kompenzacijski mehanizam povlačenje je tekućine iz intersticija u krvotok čime se nastoji osigurati početni gubitak krvi te se na taj način može kompenzirati i do jedne litre izgubljene krvi. Postupno se aktiviraju i drugi kompenzacijski mehanizmi kojima se nastoji održati odgovarajuća centralizacija krvotoka: 1) pojačana simpatička aktivacija, 2) aktivacija sustava renin-angiotenzin-aldosteron, 3) pojačano lučenje kortikosteroida (hormoni stresa) te 4) pojačano lučenje antidiuretskoga hormona. Osnovne karakteristike tih kompenzacijskih mehanizama prikazane su u Tablici 3.11.
|
Tablica 3.11. Osnovni kompenzacijski mehanizmi pri masivnom krvarenju
|
|
Kompenzacijski mehanizam
|
Način aktivacije
|
Učinak na hemodinamiku
|
|
Pojačana simpatička aktivnost
|
Aktivacija baroreceptora hipotenzijom
|
Tahikardija, hiperkontraktilnost, periferna vazokonstrikcija
|
|
Renin-angiotenzin-aldosteron sustav
|
Hipoperfuzija bubrega
|
Periferna vazokonstrikcija, zadržavanje soli i vode (↑intravskularnoga volumena)
|
|
Pojačano lučenje kortikosteroida
|
Lučenje CRH-a inducirano stresom
|
Pojačana glukoneogeneza, zadržavanje soli i vode (↑intravskularnoga volumena)
|
|
Pojačano lučenje antidiuretskoga hormona
|
Hipovolemija, hiponatrijemija
|
Zadržavanje natrija i vode (↑intravskularnoga volumena)
|
Kompenzacijski mehanizmi nastoje održati perfuziju vitalnih organa na račun visceralnih organa i periferije što početno ne mora dovesti do težih posljedica, no kroz dulji vremenski period i na tim se organima razvijaju ishemična oštećenja stanica i dolazi do njihove disfunkcije. Stanice u ishemiji dostatnu energiju za svoje potrebe nastoje osigurati anaerobnim metabolizmom, tj. anaerobnom glikolizom. Anaerobna glikoliza daje znatno manje energije (od jedne molekule glukoze nastaje dvije molekule ATP-a u odnosu na aerobnu glikolizu kada od jedne molekule glukoze nastaje 36 molekula ATP-a) te kao metabolički nusprodukti nastaju laktati, zbog čega nastaje hiperlaktatemija koja vodi organizam u metaboličku acidozu. Uslijed nedostatka energije potrebne za održavanje osnovnih staničnih mehanizma, dolazi do staničnoga oštećenja koje se manifestira disrupcijom stanične membrane i otpuštanjem staničnih produkata što je praćeno aktivacijom upalnih stanica koje stvaraju proupalne medijatore odgovorne za razvoj sindroma upalnoga odgovora (SIRS) i višeorganskoga zatajenja. Proupalni citokini odgovorni su i za pojačanu proizvodnju dušičnoga oksida koji djeluje vazodilatacijski, što smanjuje učinak kompenzacijskih mehanizama te vodi produbljivanju hipotenzije. Dodatni poticaj razvoju SIRS-a predstavljaju i enteropatogene bakterije koje uslijed ishemije crijevne sluznice i gubitka mukozne barijere dospijevaju u sistemsku cirkulaciju.
Klinička slika. U odnosu na količinu izgubljene krvi, razlikujemo četiri stadija krvarenja (prema American college of surgeons), koji se mogu razlikovati već na temelju kliničke slike, odnosno fizikalnoga pregleda.
Prvi stadij obilježen je gubitkom krvi manjim od 15 %, odnosno manjim od 10 ml/kg. Taj je stadij potpuno kompenziran pomakom intersticijske tekućine u krvotok tako da u njemu ne nalazimo znakove poremećaja hemodinamike, u prvom redu hipotenzije.
Drugi stadij obilježen je gubitkom 15 do 30 % ukupnoga volumena krvi, odnosno gubitkom krvi od 10 do 20 ml/kg. U ovome su stadiju izraženi kompenzacijski mehanizmi koji osiguravaju odgovarajući krvni tlak i perfuziju, a klinički ga obilježavaju tahikardija i posturalne promjene krvnoga tlaka (niže vrijednosti krvnoga tlaka u stojećem položaju).
Treći stadij obilježen je gubitkom 30 do 45 % ukupnog volumena krvi, odnosno gubitkom krvi od 20 do 30 ml/kg. Pri gubitku tolike količine krvi kompenzacijski mehanizmi postaju insuficijentni za održavanje odgovarajuće perfuzije, pa se razvija klinička slika hemoragijskoga šoka: bolesnici su blijedi, orošeni hladnim znojem, imaju ubrzan i jedva pipljiv puls uz izraženu hipotenziju, razvija se oligoanurija, a nerijetko dolazi i do razvoja poremećaja svijesti uslijed cerebralne hipoperfuzije. U krvi nalazimo povišene laktate i metaboličku acidozu, a kada se mjeri koncentracija ugljičnoga dioksida u izdahnutom zraku ili etCO2 (ako su bolesnici intubirani i na mehaničkoj ventilaciji), ona je niska ili nemjerljiva kao odraz smanjene izmjene plinova.
Četvrti stadij obilježen je gubitkom više od 45 % ukupnoga volumena krvi, odnosno gubitkom krvi većim 30 ml/kg. Taj stadij podrazumijeva dubok hemoragijski šok pri kojemu dolazi do razvoja višeorganskoga zatajenja i teške metaboličke (laktat) acidoze. Smrtnost je u toj fazi hemoragijskoga šoka vrlo visoka.
Dijagnostički pristup. Inicijalni pristup bolesniku koji krvari (vidljivi vanjski znakovi krvarenja), ili za kojega se sumnja da krvari, podrazumijeva brzu dijagnostičku procjenu koja uključuje klinički pregled, uzorkovanje krvi za laboratorijske pretrage te, ovisno o stanju, druge dijagnostičke metode (slikovne dijagnostičke metode, endoskopska dijagnostika). Kako se radi o životno ugroženim bolesnicima, niti jedna dijagnostička metoda ne smije odgađati početak liječenja te se u pravilu dijagnostički i terapijski postupci odvijaju istodobno.
Klinički pregled. Klinički znakovi koji ukazuju na krvarenje su blijeda koža orošena znojem, hladne okrajine, hipotenzija, slab, ubrzan i jedva pipljiv (filiformni) puls uz poremećaj svijesti. Nakon stavljanja urinarnoga katetera uočava se oligoanurija (satna diureza manja od 30 ml). Kod bolesnika koji krvare, a nalaze se u drugom stadiju, prisutne su posturalne promjene vrijednosti tlaka i pulsa na što treba obratiti pozornost. Normalno, nakon promjene položaja iz ležećega u uspravan dolazi do povlačenja određene količine krvi u donje ekstremitete (7 - 8 ml/kg) uvjetovano gravitacijom što dovodi do umjerenoga ubrzanja srčane frekvencije (oko 10/min) te umjerenoga pada vrijednosti sistoličkoga tlaka (do 5 mmHg). Kod bolesnika koji su izgubili više od 15 % ukupnoga volumena krvi te će promjene biti značajnije izražene te će srčana frekvencija porasti za više od 30/min, a sistolički tlak pasti za više od 20 mmHg, što se smatra pouzdanim specifičnim i osjetljivim pokazateljem akutnoga krvarenja.
Laboratorijska dijagnostika. Najvažniju ulogu u dijagnostici i procjeni težine krvarenja ima krvna slika u kojoj se gledaju broj eritrocita te vrijednosti hemoglobina i hematokrita, a dodatnu važnost imaju i broj trombocita te osnovni koagulogram (protrombinsko vrijeme, aktivirano parcijalno tromboplastinsko vrijeme, fibrinogen, antitrombin III). Pokazatelji težine krvarenja, odnosno hemoragijskoga šoka, vrijednosti su laktata te prisutnost metaboličke acidoze.
Procjena težine krvarenja na osnovi vrijednosti hematokrita nije primjenjiva prvih 8 do 12 sati od nastupa krvarenja, osobito ako bolesnik nije primao volumnu nadoknadu infuzijskim otopinama. Kako hematokrit predstavlja stanični udio u plazmi, a krvarenjem se gube jednake (proporcionalne) količine i plazme i stanica, hematokrit u prvim satima ostaje uredan. Tek nakon nekoliko sati, kada dođe do razvoja kompenzacijskih mehanizama kojima se povlači tekućina iz intersticija i smanjuje njezino lučenje kroz bubrege (ili nakon primjene infuzijskih otopina), dolazi do razvoja dilucije, odnosno razređenja te posljedičnoga pada vrijednosti hematokrita (Slika 3.15.).
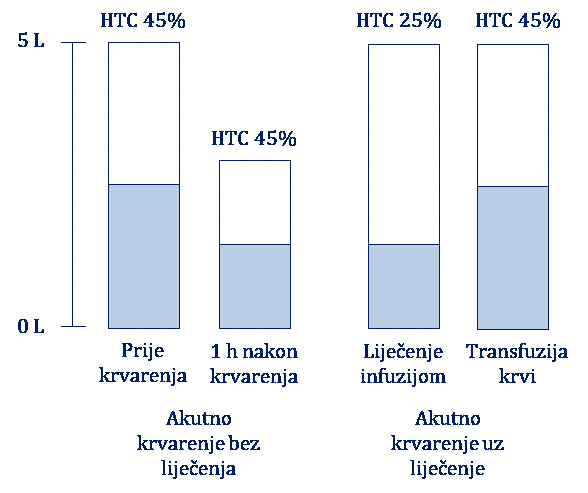
Slika 3.15. Interpretacija hematokrita pri akutnome krvarenju
Ostale dijagnostičke metode. Ovisno o kliničkoj sumnji, na raspolaganju su različite dijagnostičke metode kojima se potvrđuje postojanje i/ili mjesto (uzrok) krvarenja: ultrazvuk abdomena, kompjuterizirana tomografija prsnoga koša i abdomena, angiografija, endoskopske pretrage (gastroskopija, kolonoskopija, bronhoskopija), dijagnostička abdominalna paracenteza i sl.
Terapijski pristup. Osnovni terapijski postupak pri zbrinjavanju bolesnika s krvarenjem i hemoragijskim šokom odgovarajuća je hemostaza, bilo intervencijskim postupcima, bilo kirurškom intervencijom, što je i opisano u odgovarajućim dijelovima udžbenika. Ovdje će biti opisan opći terapijski postupak za krvarećega bolesnika bez obzira na mjesto i uzrok (hemodinamska stabilizacija) i on se provodi paralelno s dijagnostičkim i terapijskim postupcima čiji je cilj otkrivanje i zbrinjavanje nastaloga krvarenja. Osnovu zbrinjavanja krvarećega bolesnika čini primjena infuzijskih otopina i krvnih pripravaka, primjena vazoaktivnih lijekova te korekcija drugih poremećaja (koagulacijski poremećaj, hipotermija, poremećaj elektrolita…).
Postupak s bolesnikom. Kao i u svim hitnostima, osnovu zbrinjavanja čini zbrinjavanje dišnoga puta i disanja, što ovisi o bolesnikovu stanju (oksigenoterapija, potreba za intubacijom i mehaničkom ventilacijom). Što hitnije je potrebno osigurati krvožilni pristup, a preporuke se kod bolesnika s krvarenjem odnose na postavljanje više perifernih venskih puteva uz korištenje intravenskih kanila većega promjera u odnosu na centralni venski put, koji je indiciran samo u slučajevima kada se ne mogu postaviti periferni putevi. Razlog tome leži u činjenici da se volumna nadoknada lakše i brže ostvaruje primjenom volumena na više mjesta kroz široke intravenske kanile nego preko centralnog venskog katetera, osobito ako postoji više krakova koji se istodobno koriste, što usporava ukupnu primjenu volumena.
Volumna resuscitacija. Inicijalni i osnovni korak zbrinjavanja krvarećih bolesnika nadoknada je izgubljenoga intravaskularnog volumena. To se postiže primjenom infuzijskih otopina (kristaloidne, koloidne) te primjenom krvnih pripravaka (koncentrati eritrocita, svježe smrznuta plazma), a količina i brzina volumne nadoknade mora biti individualno prilagođena. Nekadašnji stav o agresivnoj nadoknadi volumena danas je napušten i preporuča se nadoknada volumenom i brzinom koja će osigurati vrijednosti sistoličkog tlaka između 80 i 90 mmHg. Takav se pristup pokazao uspješnijim zbog samoga procesa koagulacije i spontanoga zaustavljanja krvarenja. Prilikom primjene infuzija velikoga volumena i brzine postižu se više vrijednosti krvnoga tlaka što pospješuje krvarenje samo po sebi (krvarenje je veće iz krvne žile s višim krvnim tlakom), a s druge strane dolazi do razvoja lagane hipotermije zbog unosa izvanjske tekućine koja često nije odgovarajuće zagrijana na unutarnju temperaturu organizma što smanjuje učinkovitost koagulacijskoga sustava. Stoga polaganija primjena volumena uz održavanje umjerene hipotenzije (80 - 90 mmHg) pospješuje učinak koagulacijskoga sustava i smanjuje krvarenje. Volumna resuscitacija započinje primjenom infuzijskih otopina, a nastavlja se primjenom krvnih preparata kada postanu dostupni.
Izotone kristaloidne otopine predstavljaju infuzijske otopine prvoga izbora u liječenju krvarećih bolesnika, a na raspolaganju je fiziološka otopina (0,9 % NaCl) te Ringerov laktat. Kod pretpostavke da će u liječenju biti primijenjena velika količina infuzijskih otopina, prednost se daje Ringerovom laktatu u odnosu na fiziološku otopinu s obzirom na to da fiziološka otopina sadrži klor te se kod primjene velikih količina može razviti hiperkloremijska acidoza. Budući da te otopine imaju jednaku koncentraciju natrija kao i plazma, distribucija nije ograničena samo na intravaskularni prostor nego se raspodjeljuje između intravaskularnoga i intersticijskog prostora u odnosu 1:3 (zbog toga se kod primjene velike količine infuzije kod bolesnika događaju edemi ekstremiteta).
Koloidne otopine, u prvome redu otopine hidroksietil škroba (HES), danas se koriste samo pri jednoj indikaciji, a to je jasno, akutno krvarenje hemodinamski nestabilnih bolesnika, kod kojih nije na raspolaganju primjena krvnih pripravaka. Primjena koloida osigurava povećanje koloidno-osmotskoga tlaka plazme zbog čega se dodatno povlači tekućina iz intersticija te se tako osigurava bolja hemodinamska stabilizacija uz promjenu manjega volumena nego kod kristaloidnih otopina koje se u najvećem dijelu distribuiraju ekstravaskularno. Njihova primjena pri krvarenju strogo je ograničena, unatoč opisanom boljem učinku na hemodinamiku, zbog kasnijih mogućih nuspojava koje proizlaze iz nakupljanje molekula hidroksietil škroba u bubrezima, plućima i drugim tkivima, a djeluje i inhibitorno na agregaciju trombocita.
Primjena krvnih preparata podrazumijeva u prvome redu primjenu koncentrata eritrocita te svježe smrznute plazme koja osigurava nadoknadu koagulacijskih faktora i drugih tvari otopljenih u plazmi. Primjena pune krvi danas se nije u praksi. Cilj primjene koncentriranih eritrocita osiguravanje je vrijednosti hemoglobina iznad 70 g/L, odnosno kod plućnih i kardioloških bolesnika između 80 i 100 g/L, dok nekadašnje preporuke o ciljnim vrijednostima hemoglobina preko 100 g/L danas ne vrijede. S obzirom na to da se koncentriranim eritrocitima nadoknađuju samo eritrociti, a da se krvarenjem gubi puna krv, u određenim je situacijama potrebna i nadoknada drugim krvnim pripravcima, a to su u prvom redu svježe smrznuta plazma i trombociti. Nakon transfundiranih šest doza koncentriranih eritrocita potrebno je primijeniti dvije doze svježe smrznute plazme i dalje se nakon svake sljedeće primjene dvije doze koncentriranih eritrocita primjenjuju po dvije doze svježe smrznute plazme. Koncentrati trombocita primjenjuju se da bi se osigurao broj trombocita od minimalno 50 x 109/L, odnosno 100 x 109/L ako se radi o intrakranijskom krvarenju. Nakon zaustavljanja krvarenja daljnje primjene transfuzije nisu potrebne ako je vrijednost hemoglobina iznad 70 g/L.
Vazoaktivno liječenje. Ako se navedenim mjerama volumne resuscitacije ne postiže hemodinamska stabilizacija bolesnika, indicirana je primjena vazoaktivnih lijekova pri čemu se najčešće koriste noradrenalin, dopamin, dobutamin i adrenalin (Tablica 3.12.).
|
Tablica 3.12. Vazoaktivno liječenje hemoragijskoga šoka
|
|
Lijek
|
Doza
|
Učinak
|
|
Noradrenalin
|
0,05 - 1 mcg/kg/min
|
periferna vazokonstrikcija
|
|
Adrenalin
|
0,05 - 0,5 mcg/kg/min
|
periferna vazokonstrikcija
|
|
Dopamin
|
5 - 10 mcg/kg/min
|
pojačana kontraktilnost, tahikardija
|
|
Dobutamin
|
2 - 10 mcg/kg/min
|
pojačana kontraktilnost, tahikardija
|
Ostale terapijske preporuke. Za postizanje zadovoljavajuće kontrole nad krvarenjem potrebno je osigurati odgovarajući učinak koagulacijskoga sustava, što se u prvome redu temelji na sprečavanju hipotermije te korekciji metaboličke acidoze i vrijednosti kalcija. Analiza koagulograma bolesnika s hipotermijom, metaboličkom acidozom ili hipokalcijemijom nije zadovoljavajuća i najprije je potrebno u red dovesti navedene čimbenike (tek nakon postizanja zadovoljavajuće temperature, pH arterijske krvi te normalnih vrijednosti kalcija koagulogram se može odgovarajuće tumačiti). Osim primjene svježe smrznute plazme i trombocita, u određenim je uvjetima indicirana i primjena i drugih krvnih pripravaka i koncentrata koagulacijskih faktora. Koncentracija fibrinogena kod bolesnika koji krvare mora se održavati iznad 1 g/L. Ako padne, indicirana je primjena krioprecipitata ili koncentrata fibrinogena. Kod bolesnika s hemofilijom ili onih koji su na antikoagulantnoj terapiji indicirana je primjena humanoga protrombinskog kompleksa. Primjena antitrombina III preporučena je samo kod bolesnika sa stečenim ili urođenim deficitom antitrombina III, dok se rutinska nadoknada ostvaruje primjenom svježe smrznute plazme. Također, kod bolesnika koji aktivno krvare (osobito ako se radi o traumatskom krvarenju) može se razmotriti i primjena antifibrinolitika s ciljem kočenja razgradnje stvorenoga ugruška, a najčešće se u tu svrhu primjenjuje traneksamična kiselina (500 mg početno kao intravenski bolus, nastaviti kontinuirano s 1 g kroz osam sati). Primjena pojedinih komponenti koagulacijskoga sustava može biti vođena nalazom rotacijske tromboelastografije (ROTEM) koja osigurava brz (kroz nekoliko minuta) uvid u koagulacijski poremećaj, odnosno specifični deficit (trombociti, fibrinogen i sl.).
Definicija. Sepsa i septički šok predstavljaju patofiziološki kontinuum koji započinje infekcijom i posljedičnom bakterijemijom, a mogu završiti po život opasnim stanjem ako ih se na vrijeme ne prepozna i ne započne s prikladnim liječenjem. Danas se za definiciju sepse koristi ona iz 2016. godine (engl. The third international consensus definitions for sepsis and septic shock, Sepsis-3) koja sepsu definira kao životno ugrožavajuće stanje uslijed organske disfunkcije kao posljedice poremećenoga odgovora organizma na infekciju. U kliničkoj se praksi za definiciju sepse koriste qSOFA i SOFA kriteriji (engl. sequential organ failure assessment score) kako je to navedeno u algoritmu (Slika 3.16.).
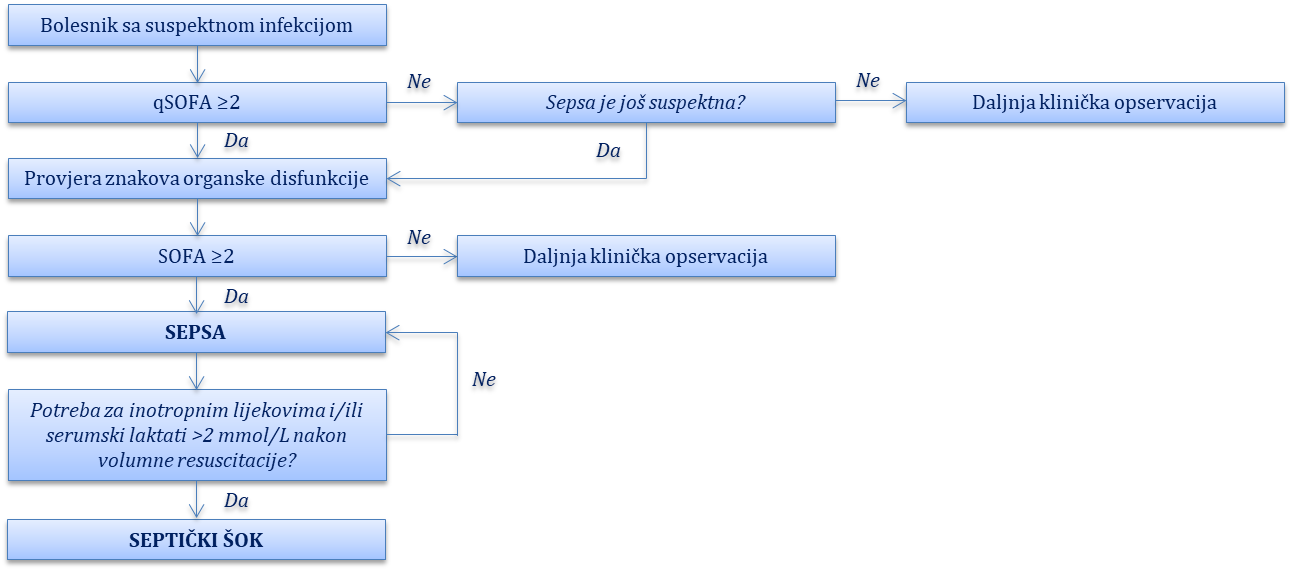
Slika 3.16. Dijagnostički algoritam za postavljanje dijagnoze sepse i septičkog šoka
SOFA kriteriji (engl. sequential organ failure assessment score) standardizirani su kriteriji u dijagnostici sepse i septičkoga šoka. Pri probiru bolesnika najprije se koristi brzi SOFA kriterijski sustav (tzv. qSOFA, quick SOFA) koji se sastoji od tri elementa, a svaki od njih nosi jedan bod: hipotenzija (sistolički tlak < 100 mmHg), tahipneja (respiracijska frekvencija > 22/min) te poremećeno stanje svijesti. Pri konačnoj procjeni bolesnika koristi se puni SOFA kriterijski sustav naveden u Tablici 3.13.
|
Tablica 3.13. SOFA kriteriji (engl. Sequential Organ Failure Assessment Score)
|
|
Varijabla/bodovi
|
0
|
1
|
2
|
3
|
4
|
|
Respiratorni sustav
|
PaO2/FiO2 > 400
SpO2/FiO2 > 302
|
PaO2/FiO2 < 400
SpO2/FiO2 < 302
|
PaO2/FiO2 < 300
SpO2/FiO2 < 221
|
PaO2/FiO2 < 200
SpO2/FiO2 < 142
|
PaO2/FiO2 < 100
SpO2/FiO2 < 67
|
|
Kardiovaskularni sustav (doze u mcg/kg/min)
|
MAP > 70 mmHg
|
MAP > 70 mmHg
|
Dopamin < 5
|
Dopamin > 5
Noradrenalin < 0,1
Fenilefrin < 0,8
|
Dopamin > 5
Noradrenalin > 0,1
Fenilefrin > 0,8
|
|
Jetra (bilirubin, mg/dL)
|
< 1,2
|
1,2 - 1,9
|
2,0 - 5,9
|
6,0 - 11,9
|
> 12
|
|
Bubrezi (kreatinin, mg/dL)
|
< 1,2
|
1,2 - 1,9
|
2,0 - 3,4
|
3,5 - 4,9
|
> 5,0
|
|
Broj trombocita (x109/L)
|
|
< 150
|
< 100
|
< 50
|
< 20
|
|
Mozak (GCS)
|
15
|
13 - 14
|
10 - 12
|
6 – 9
|
< 6
|
Epidemiologija. Sepsa, odnosno septički šok predstavlja jednu od najčešćih indikacija za prijem u jedinicu intenzivnoga liječenja i jedan je od najčešćih uzroka smrti u jedinici intenzivnoga liječenja. Incidencija sepse u stalnom je porastu, prvenstveno zbog sve dužega životnog vijeka te se procjenjuje da iznosi 3 do 10 oboljelih na 100 osoba opće populacije u razvijenim zemljama. Smatra se da je sepsa uzrok smrti 5 do 10 milijuna ljudi diljem svijeta godišnje. Ipak, pojedinačno gledajući, smrtnost od same sepse u stalnome je padu, no zbog sve većega broja oboljelih osoba ukupan broj umrlih od sepse raste. Najrizičnije skupine koje obolijevaju od sepse u odrasloj populaciji osobe su starije od 65 godina, bolesnici s kroničnim bolestima (šećerna bolest, kardiomiopatija, kronične plućne bolesti), pothranjeni bolesnici, onkološki bolesnici te imunokompromitirani bolesnici.
Etiologija. S obzirom na mjesto nastanka, razlikujemo domicilne (izvanbolničke) i hospitalne (bolničke) sepse. Najčešći su uzrok domicilnih sepsi gram-negativne enterobakterije, ponajprije Escherichia coli s izvorištem u mokraćnom sustavu, rjeđe u žučnom mjehuru ili vodovima ili probavnoj cijevi (divertikulitis). Ostali češći uzročnici domicilnih sepsi su Streptococcus pneumoniae, Staphylococcus aureus te rjeđe Neisseria meningitidis. Hospitalne upale pluća obično su uzrokovane gram-negativnim bakterijama, poglavito eneterobakterijama, a čest uzrok je i Pseudomonas aeruginosa. Hospitalne sepse obično su praćene lošijim ishodima, ponajprije uslijed multirezistentnosti samih uzročnika. Kod imunokompromitiranih osoba česte su i sepse uzrokovane gljivicama (Candida spp.). Ukupno gledano, najčešća ishodišta sepse su dišni, probavni i mokraćni sustav.
Patofiziologija. Kako je već navedeno, osnovu patofizioloških zbivanja u sepsi čini sistemski upalni odgovor koji započinje invazijom patogena u tkiva domaćina. Ta invazija uzrokuje aktivaciju stanica monocito-makrofagnoga sustava (monociti, makrofazi, mastociti) koji čini prvu liniju imunološke obrane domaćina (nespecifična imunost). Aktivaciju nespecifične imunosti vrše tzv. PAMPs (engl. pathogen-associated molecular patterns) i DAMPs (engl. damage-associated molecular patterns) molekule. PAMPs molekule predstavljaju dijelovi (antigeni) samih bakterija ili gljivica (lipopolisaharid, bakterijska DNA, lipoproteini) dok DAMPs molekule nastaju oštećenjem vlastitih stanica, tj. stanica domaćina koje signaliziraju da je došlo do narušavanja integriteta što zahtijeva aktivaciju i odgovor imunološkoga sustava (heat-shock proteini, urična kiselina, dijelovi DNA). Aktivacija navedenih stanica rezultira pojačanom proizvodnjom proupalnih citokina, u prvom redu TNF-α i IL-1 koji potom djeluju na druge upalne stanice, kao i na lokalne endotelne stanice. Djelujući na druge upalne stanice, u prvome redu leukocite, potiču njihovu kemotaksiju na mjesto upale gdje se oni aktiviraju, luče slobodne radikale i proteaze koje dovode do destrukcije patogena, ali i stanica domaćina, a pojačano se stvaraju i drugi proupalni citokini (IL-6, IL-8, INF-γ). Također, navedeni citokini odgovorni su i za aktivaciju endotelnih stanica koje pojačano stvaraju dušični oksid koji dovodi do vazodilatacije i posljedično pojačane propusnosti kapilarnih stijenki, a odgovorni su i za aktivaciju koagulacijskoga sustava što se obično očituje nastankom mikrotromboza. Sve navedene pojave odgovorne su za razvoj lokalne upalne reakcije, ali pojačana lokalna proizvodnja proupalnih citokina može dovesti i do sistemskih učinaka uslijed njihovoga otpuštanja u cirkulaciju. Generalizirana aktivacija endotelnih stanica odgovorna je za sistemsku vazodilataciju koja dovodi do pada krvnoga tlaka s kompenzatornom tahikardijom i pojačane kontraktilnosti miokarda s posljedičnom sistemskom hipoperfuzijom i tkivnom ishemijom kojoj pridonose i brojne mikrotromboze. Ovaj generalizirani upalni odgovor naziva se sindrom sustavnoga upalnog odgovora (SIRS, od engl. systemic inflammatory response syndrome) koji vodi organizam u stanje opće hipoperfuzije s nastankom ishemije i disfunkcije različitih organa i organskih sustava (sindrom višeorganskoga zatajenja). Karakteristično, zajedno s pojačanom proizvodnjom proupalnih citokina započinje i proizvodnja tzv. antiupalnih citokina koji djeluju kao protuteža i čine tzv. sindrom sistemskoga antiupalnog odgovora (CARS, od engl. counter inflammatory response syndrome). Glavni antiupalni citokini su IL-4 i IL-10 čiji se glavni učinak temelji na inhibiciji stvaranja TNF-α, IL-1, IL-6 i IL-8, a smatra se da su odgovori i za nastanak antagonista receptora za TNF-α i IL-1. Točan razlog zbog kojega dolazi do prevlasti SIRS-a u odnosu na CARS nije poznat, a vjeruje se da u tome veliku ulogu može imati i sama genetika pojedinaca.
Klinička slika. Kako je navedeno, septičko stanje predstavlja jedan kontinuum koji započinje kliničkim manifestacijama lokalne upalne reakcije, a nastavlja se razvojem sistemskih manifestacija, znacima disfunkcije drugih organskih sustava te izraženom hemodinamskom nestabilnošću. Brzina i narav progresije ovoga patofiziološkoga slijeda ovisi o više čimbenika, u prvome redu o imunokompetentnosti i općem kondicijskom stanju domaćina, kao i o virulentnosti uzročnika.
Lokalni simptomi i znakovi često ukazuju na izvor septičkoga stanja: dizurične tegobe i bolovi u slabinama na urinarne infekcije (pijelonefritis); bol u prsima, kašalj i iskašljavanje na respiratorne infekcije (upala pluća); bolovi u trbuhu, mučnina i povraćanje na gastrointestinalne infekcije; otok, hiperemija i bolnost kože i potkože na celulitis i sl.
Sistemske kliničke manifestacije koje prate septično stanje pojava su tresavice, zimice i povišene tjelesne temperature (febrilno stanje obično se javlja pola sata do sat nakon izražene tresavice i zimice), a česti su i klonulost, umor i malaksalost. Bolesnici imaju slabiji tek, a nerijetko su izraženi i mučnina, povraćanje i proljev kao dio sistemskih manifestacija. U fizikalnom pregledu osim povišene (ili snižene) tjelesne temperature obično nalazimo i tahikardiju (nerazmjernu tjelesnoj temperaturi) te tahipneju koje ponekad predstavljaju prve i osnovne znakove septičkoga zbivanja.
Kliničke manifestacije višeorganske disfunkcije uključuju kardiocirkulatorni sustav (tvrdokorna hipotenzija), respiratorni (akutna respiratorna insuficijencija), uropoetski (akutno bubrežno oštećenje), središnji živčani sustav (poremećaj stanja svijesti, septička encefalopatija), koagulacijski sustav (diseminirana intravaskularna koagulopatija) te probavni sustav (paralitički ileus, jetrena insuficijencija).
Hemodinamska nestabilnost definira se vrijednostima sistoličkoga krvnog tlaka nižima od 100 mmHg ili srednjega arterijskog tlaka nižima od 65 mmHg, unatoč odgovarajućoj volumnoj nadoknadi, što je osnovna karakteristika septičkoga šoka. Da se ne radi samo o konstitucijski uvjetovanim niskim vrijednostima krvnoga tlaka, što se obično viđa u starijoj populaciji, potrebno je utvrditi određivanjem i vrijednosti laktata jer je hiperlaktatemija (> 2 mEq/L) s ili bez metaboličke acidoze najpouzdaniji znak sistemske hipoperfuzije.
Dijagnoza sepse i septičkoga šoka temelji se na anamnestičkim podacima, kliničkom pregledu te osnovnim laboratorijskim pokazateljima, a potvrđuje se mikrobiološkom dijagnostičkom obradom te drugom, specifičnom obradom koja za cilj ima otkriti sijelo, odnosno ishodište septičkoga zbivanja.
Laboratorijska dijagnostika. Osnovni laboratorijski pokazatelji koji ukazuju na infekciju i septičko zbivanje su upalni parametri: broj i vrsta leukocita, C-reaktivni protein, prokalcitonin i fibrinogen. Sepsu obilježavaju leukocitoza ili leukopenija, a veliki diferencijalno-dijagnostički značaj ima njihovo diferenciranje (neutrofilija, limfocitoza, pojava nezrelih oblika). C-reaktivni protein i fibrinogen su reaktanti akutne faze koji se stvaraju u jetri i čije su vrijednosti povišene u stanju sepse, ali su podložne i drugim utjecajima, kao što je funkcija jetre (smanjene vrijednosti) ili prisutnost drugih stimulirajućih čimbenika (npr. povišene vrijednosti kod malignih bolesti). Prokalcitonin je protein kojega stvaraju upalne stanice kao odgovor na prisutnost bakterijskih endotoksina, a to je u prvome redu povezano s porastom proupalnih citokina i predstavlja osjetljiviji laboratorijski parametar u dijagnostici bakterijskih infekcija u odnosu na CRP ili broj leukocita, koji mogu biti povišeni i u drugim, neinfektivnim upalnim stanjima. Osim toga, dinamika prokalcitonina vjerodostojnije prati dinamiku upale i sam klinički tijek (vrijednosti prokalcitonina brže padaju od vrijednosti CRP-a nakon pada vrijednosti proupalnih citokina i smirivanja upale), što ga čini boljim parametrom za vođenje antibiotske terapije (skraćuje trajanje liječenja antibioticima širokoga spektra). Osim upalnih parametara, kod bolesnika sa sepsom prate se i drugi, standardni laboratorijski nalazi, kao što su broj trombocita, koagulogram, jetreni i bubrežni parametri, elektroliti, laktati, pH i plinske analize arterijske krvi, glukoza u plazmi, sediment urina i dr., s ciljem ranoga otkrivanja komplikacija, odnosno razvoja disfunkcije pojedinih organa/organskih sustava što se susreće kod bolesnika s teškom sepsom, kao i prepoznavanja mogućega uzroka, tj. ishodišta sepse.
Mikrobiološka dijagnostika. Uzimanje hemokulture indicirano je kod svih bolesnika sa sumnjom na septično stanje i predstavlja zlatni standard u identifikaciji uzročnika sepse, iako je ona pozitivna tek kod trećine bolesnika. Uzorkovanje krvi za hemokulturu potrebno je provesti s više mjesta u isto vrijeme u odvojene aerobne i anaerobne epruvete, a za svaku epruvetu potrebno je uzeti minimalno 20 ml krvi. Izvođenje venepunkcije mora biti strogo aseptično kako bi se smanjila mogućnost kontaminacije bakterijama s površine kože. Uzimanje hemokulture preporuča se u vrijeme febriliteta kada se smatra da se u krvi nalazi najveća koncentracija bakterija što povećava uspješnost izolacije uzročnika, a svakako prije početka antimikrobnoga liječenja (ako to uvjeti i prilike dozvoljavaju). Osim hemokulture, potrebno je provesti i drugo mikrobiološko uzorkovanje ovisno o kliničkoj slici i kliničkoj sumnji (urin, iskašljaj, aspirat traheje, cerebrospinalni likvor, bris rane i dr.).
Ostala dijagnostika. S ciljem otkrivanja uzroka (ishodišta) sepse obično se koriste različite slikovne i druge dijagnostičke metode, kao što su rendgenogram srca i pluća, ultrazvuk i/ili kompjuterizirana tomografija abdomena, lumbalna punkcija, ehokardiografija i sl., što se indicira ovisno o pratećoj kliničkoj slici i fizikalnom nalazu.
Liječenje sepse i septičkoga šoka treba započeti što ranije, odmah nakon postavljanja sumnje, bez odgode, uglavnom već u okvirima hitne službe. Osnovi terapijski ciljevi kod takvih su bolesnika poboljšanje tkivne perfuzije i rana primjena antibiotika. Poboljšanje tkivne perfuzije podrazumijeva hemodinamsku stabilizaciju koja se postiže odgovarajućom volumnom nadoknadom, a prema potrebi i primjenom vazoaktivnih lijekova, a rana primjena antibiotika podrazumijeva njihovu primjenu unutar jednog sata od postavljanja kliničke sumnje na septičko zbivanje, ali nakon provedenoga mikrobiološkog uzorkovanja. Uz te osnovne mjere liječenja provode se i druge specifične i potporne mjere liječenja, kao što su primjena kortikosteroida, aktiviranoga proteina C i sl. Inicijalni terapijski ciljevi kod bolesnika sa sepsom, teškom sepsom ili septičkim šokom navedeni su Tablici 3.14.
|
Tablica 3.14. Inicijalni terapijski ciljevi kod bolesnika sa sepsom, teškom sepsom i septičkim šokom
|
- Srednji arterijski tlak (MAP) viši od 65 mmHg;
- Diureza veća od 0,5 ml/kg/h;
- Središnji venski tlak između 8 i 10 mmHg, odnosno 12 i 15 mmHg ako je bolesnik mehanički ventiliran;
- Saturacija centralne venske krvi veća od 70 %, odnosno miješane venske krvi veća od 65 %.
|
Inicijalni pristup bolesniku podrazumijeva paralelno provođenje dijagnostičkih metoda i terapijsko zbrinjavanje bolesnika. Svim je bolesnicima potrebno osigurati zadovoljavajuću respiratornu funkciju (oksigenoterapija, intubacija, mehanička ventilacija), krvožilni pristup (više perifernih venskih puteva, središnji venski put) te započeti volumnu nadoknadu, provesti mikrobiološko uzorkovanje i uključiti antimikrobnu terapiju.
Hemodinamska stabilizacija postiže se odgovarajućom volumnom nadoknadom s obzirom na izraženu hipovolemiju kod ovih bolesnika te primjenom vazoaktivnih lijekova kod bolesnika koji ne reagiraju na volumnu nadoknadu.
Intravenska infuzija velikoga volumena od minimalno 30 ml/kg kroz prva tri sata označava početnu mjeru postizanja hemodinamske stabilizacije septičkih bolesnika uz iznimku bolesnika s preedemom ili edemom pluća kod kojih se nadoknada volumena odvija sporije i uz manje volumene. Infuzije se primjenjuju u bolusima od 500 mL, a nakon svake infuzije provjerava se odgovor koji uključuje provjeru krvnoga tlaka ili uočavanje znakova srčane dekompenzacije. U tu se svrhu preporučuje primjena izotonih kristaloidnih otopina kao što je fiziološka otopina ili Ringerov laktat, dok je primjena albumina dvojbena, a primjena otopina hidrokisetil škroba (HES) pri ovoj je indikaciji kontraindicirana.
Ako se nakon inicijalne volumne nadoknade ne postigne hemodinamska stabilizacija bolesnika, indicirana je primjena vazoaktivnih lijekova, u prvom redu noradrenalina. Noradrenalin je vazoaktivni lijek izbora kod ovih bolesnika, a daje se u inicijalnoj dozi od 8 do 12 mcg/min, dok je za održavanje obično dostatna doza od 2 do 4 mcg/min. Kod bolesnika koji zahtijevaju primjenu visokih doza noradrenalina preporuča se dodatno uvođenje vazopresina u dozi od 0,01 do 0,03 jedinice/min što smanjuje potrebe za visokim dozama noradrenalina. Kao treći lijek bolesnicima refrakternim unatoč noradrenalinu i vazopresinu dodaje se dobutamin koji se primjenjuje u dozi od 0,5 do 20 mcg/kg/min.
Rana primjena antibiotika predstavlja glavni izazov u kliničkoj praksi. Trenutne smjernice navode da se s intravenskom primjenom antibiotika treba započeti već unutar jednoga sata od postavljene kliničke sumnje na septičko stanje (iako je to obično teško izvedivo), odmah nakon provedenoga mikrobiološkog uzorkovanja, jer svako daljnje kašnjenje s njihovom primjenom pogoršava prognozu i daje lošije rezultate. Treba naglasiti da nemogućnost odgovarajućega mikrobiološkog uzorkovanja ne smije odgađati ranu primjenu antibiotika.
Početno antibiotsko liječenje je empirijsko, a izbor antibiotika mora biti individualiziran. Pri toj odluci u obzir treba uzeti sve relevantne podatke i čimbenike, kao što su kliničko stanje bolesnika, skorije infekcije u osobnoj anamnezi (izolirani patogeni, korišteni antibiotici), komorbiditeti i imunosuprimiranost bolesnika, klinički kontekst infekcije (domicilna ili hospitalna), kao i suspektni izvor i zahvaćenost infekcijom (pluća, trbuh, mokraćni sustav, središnji živčani sustav). Empirijska primjena antibiotika kojega je bolesnik primao u zadnja tri mjeseca nije preporučena. Početno liječenje obično obuhvaća primjenu jednoga ili više antibiotika širokoga spektra (s različitim mehanizmima djelovanja) za koje se pretpostavlja da pokrivaju širi spektar gram-negativnih i gram-pozitivnih bakterija. Osim antibiotika, u određenim se kliničkim okolnostima primjenjuju i antimikotici i antivirotici (imunosupresivni bolesnici, neutropenija, epidemiološke prilike). Preporučeno empirijsko antimikrobno liječenje prema izvorištu navedeno je u Tablici 3.15.
Kada se sumnja na infekciju S. aureus (MRSA) rezistentnim na metilcilin, empirijskom liječenju treba dodati vankomicin ili, u slučaju oštećene bubrežne funkcije i/ili pluća kao izvorišta sepse, linezolid. Liječenje pseudomonasne infekcije (P. aeruginosa) obično se provodi kombinacijom vankomicina/linezolida i antibiotika treće ili četvrte generacije cefalosporina (ceftriakson, cefotaksim, cefepim) ili beta-laktamskih antibiotika uz inhibitor betalaktamaze (piperacilin-tazobaktam) ili karbapenemom (meropenem, imipenem).
Klinički učinak, revizija antimikrobne terapije praktički se radi svakodnevno, a svakako nakon 48 do 72 sata. Pokazatelji dobroga odgovora na primjenjenu terapiju su kliničko poboljšanje bolesnika i pad upalnih parametara, osobito prokalcitonina. Revizija antimikrobne terapije podrazumijeva izmjenu, dodavanje ili deeskalaciju postojeće terapije što je uvjetovano učinkom liječenja do toga trenutka, otkrivanjem izvora sepse kao i prispijećem mikrobioloških nalaza (ciljana, antibiogramom vođena terapija).
Kortikosteroidi. Primjena kortikosteroida u liječenju septičkog šoka predstavlja dvojbenu odluku zbog oprečnih rezultata dobivenih u brojnim studijama. Ipak, uvriježen je stav da je primjena kortikosteroida opravdana samo kod bolesnika koji imaju razvijeni septički šok, a kod kojih se ne može postići hemodinamska stabilizacija unatoč odgovarajućoj volumnoj nadoknadi i primjeni vazopresora, dok se njegova rutinska primjena kao dio inicijalne terapije ne preporuča. U tu se svrhu primjenjuje hidrokortizon u dnevnoj dozi od 200 do 300 mg, bilo u obliku kontinuirane infuzije, bilo bolusno tri do četiri puta na dan. On se primjenjuje tijekom sedam dana (ili manje ukoliko dođe do prestanka potrebe za primjenom vazopresora) uz postupno snižavanje doze, a ako je prisutna povijest ili je dokazana adrenalna disfunkcija, njihova primjena može biti i produljena.
Rekombinantni humani aktivirani protein C (rhAPC). Primjena rekombinantnoga humanoga aktiviranog proteina C koji pored fibrinolitičkoga ima i protuupalni učinak rjeđa je u kliničkoj praksi, iako postoje studije koje podupiru njegovu primjenu i koje su pokazale bolje preživljenje bolesnika koji su ga primali. On je indiciran u slučajevima septičkoga šoka s visokim smrtnim ishodom (APACHE II score > 25) te višeorganskom disfunkcijom, a uz odsutnost kontraindikacija kao što su aktivno krvarenje, hemoragijski inzult u zadnja tri mjeseca te trauma ili neurokirurški zahvat u zadnja dva mjeseca. rhAPC se primjenjuje u obliku kontinuirane infuzije u dozi od 24 mcg/kg/h tijekom 96 sati. Najznačajnija komplikacija toga liječenja je krvarenje.
Ostale potporne metode liječenja. Uz navedene mjere liječenja potrebno je provoditi i druge specifične metode liječenja vezane uz kritično oboljele osobe, kao što su tromboprofilaksa (niskomolekularni heparin), profilaksa stresnih ulceracija i stresnih ulkusa (inhibitori protonske pumpe), metode fizikalne i medikamentozne antipireze, transfuzijsko liječenje, kontrola glikemije i sl.
Metode ekstrakorporalnoga pročišćavanja krvi podrazumijevaju uklanjanje proupalnih citokina i bakterijskih toksina iz cirkulacije bolesnika s ciljem smanjenja SIRS-a. Ipak, njihova primjena nije rutinska i obično se povezuje s akutnim bubrežnim oštećenjem kada se koristi nadomjesno liječenje u vidu kontinuirane dijalize (kontinuirana venovenska hemodijafiltracije, CVVHDF) pri čemu se koriste posebne adsorbirajuće membrane koje imaju sposobnost adsorpcije citokina i toksina na svoju površinu tijekom protoka krvi kroz njih. Zbog nekonzistentnih rezultata brojnih studija i činjenice da se ovom metodom uklanjaju i antiupalni citokini, primjena te metode ograničena je samo na početak septičkoga zbivanja kada u cirkulaciji dominiraju proupalni citokini.
Prognoza bolesnika sa sepsom ovisi ponajprije o njezinoj težini (sepsa, teška sepsa ili septički šok), kao i o općem zdravstvenom stanju bolesnika, odnosno prisutnosti komorbiditeta. Ukupno gledano, bolesnici bez komorbiditeta imaju stopu preživljenja veću od 90 %, dok se kod starijih bolesnika i bolesnika s višestrukim komorbiditetima ona kreće između 30 i 50 %. Pri predviđanju ishoda kod bolesnika koriste se različiti bodovni sustavi, kao što su APACHE II, SAPS II ili SOFA.
KARDIOGENI I OPSTRUKTIVNI ŠOK
Kardiogeni i opstruktivni šok predstavljaju hitna kardiološka stanja koja zahtijevaju što ranije prepoznavanje i liječenje koje se provodi u jedinicama intenzivnoga liječenja s obzirom na visoku stopu smrtnosti koja ih prati.
KARDIOGENI ŠOK
Definicija. Kardiogeni šok predstavlja poremećaj mikrocirkulacije koji nastaje uslijed naglo nastale srčane disfunkcije i zajedno s akutnim kardiogenim plućnim edemom čini cijeli klinički spektar akutnoga srčanog popuštanja. Glavne kliničke odrednice kardiogenoga šoka su duboka i refrakterna hipotenzija s ili bez kliničkih i radioloških znakova plućnoga edema uz povišen centralni venski tlak (> 12 mmHg) i sniženu saturaciju miješane venske krvi (< 70 %) uz patološki ehokardiografski nalaz. Kardiogeni se šok najčešće susreće kod bolesnika s akutnim infarktom miokarda i predstavlja njegovu najtežu komplikaciju sa stopom smrtnosti između 50 i 80 %. Učestalost kardiogenoga šoka veća je kod bolesnika koji imaju od ranije postojeću srčanu bolest, kao što je srčano popuštanje sa sniženom ejekcijskom frakcijom (HFrEF).
Etiologija. Najčešći i osnovni uzrok kardiogenoga šoka je akutni infarkt miokarda (5 do 10 % bolesnika s akutnim infarktom miokarda razvije kardiogeni šok), iako se on može naći i u podlozi drugih srčanih oboljenja.
Akutni infarkt miokarda najčešći je uzrok kardiogenoga šoka u kliničkoj praksi, a nastaje kao posljedica gubitka funkcije više od 40 % mase lijevoga ventrikula, a moguć je i razvoj u podlozi manje opsežnih infarkata kod bolesnika s ranije postojanom sistoličkom disfunkcijom lijevoga ventrikula. Osim gubitkom kontraktilne snage, može biti uzrokovan i nastankom mehaničkih komplikacija uslijed infarkta miokarda, kao što su ruptura papilarnih mišića i posljedična akutna mitralna regurgitacija, ruptura intraventrikularnoga septuma ili ruptura slobodne stijenke lijevoga ventrikula. Kardiogeni šok moguć je i uz infarkt desnoga ventrikula, a ima nepovoljniji klinički tijek i ishod.
Ostali uzroci kardiogenoga šoka su teški miokarditis, terminalna faza kardiomiopatija, kontuzija miokarda, septički šok praćen disfunkcijom miokarda ili disfunkcija miokarda nakon prolongiranoga kardiopulmonalnog premoštavanja (engl. bypass).
Patofiziologija. Kardiogeni šok nastaje kao posljedica bilo kojega patološkog procesa koji zahvati veći dio mase miokarda i dovede do njegove sistoličke i/ili dijastoličke disfunkcije. Posljedično dolazi do pada udarnoga i minutnog volumena što vodi u sistemsku hipoperfuziju i razvoj krvotočnoga urušaja (šoka). Kao posljedica smanjenoga udarnog volumena, smanjena je i perfuzija koronarnih arterija koja pridonosi miokardnoj disfunkciji. Kompenzacijski mehanizmi, među kojima je najznačajniji aktivirani simpatikus, pojačanjem kontraktilnosti i srčane frekvencije dodatno pogoršavaju ishemiju miokarda povećavajući njegove potrebe za kisikom. Također, aktivacija humoralnih kompenzacijskih mehanizama (natriuretski peptidi, renin-angiotenzin sustav) dodatno pogoršava srčanu funkciju zadržavanjem soli i vode, povećavajući tako srčano predopterećenje i stvarajući uvjete za razvoj kongestije. Ishemija miokada predstavlja i značajan rizični čimbenik za pojavu poremećaja stvaranja i/ili provođenja srčanoga impulsa. Sustavna hipoksija može postati uzrok aktivacije sistemskoga upalnog odgovora u kojemu dominira stvaranje proupalnih citokina koji dodatno mogu uzrokovati kardiodepresiju.
Klinička slika. Glavne kliničke odlike kardiogenoga šoka su duboka i refrakterna hipotenzija, ubrzan i jedva pipljiv (filiformni) puls, sivo-pepeljasta boja kože orošena hladnim znojem, akrocijanoza te različit stupanj poremećaja stanja svijesti uslijed cerebralne hipoperfuzije te oligoanurija uslijed smanjenje perfuzije bubrega. Bolesnici mogu razviti i plućnu kongestiju, odnosno edem pluća, a mogu biti izraženi i znakovi sustavne hipoperfuzije, kao što su nabrekle vene vrata i hepatojugularni refleks. Postupno se razvija slika sindroma višeorganskoga zatajenja (MODS).
Dijagnoza se postavlja na osnovi anamnestičkih podataka, kliničkoga nalaza, elektrokardiografskih promjena (ishemija, poremećaji srčanoga ritma), rendgenograma srca i pluća (kardiomegalija, plućna kongestija) te ehokardiografije (procjena morfologije srčanih šupljina i funkcije valvularnoga aparata, procjena sistoličke i dijastoličke disfunkcije). Laboratorijski nalazi su nespecifični, ali se obično prate povišene vrijednosti kardioselektivnih enzima i nt-proBNP-a uz ostale laboratorijske pokazatelje šoka (hiperlaktatemija, metabolička acidoza, azotemija i dr.). U uvjetima liječenja u jedinicama intenzivnoga liječenja moguća su i specifična hemodinamska mjerenja koja ukazuju na kardiogeni šok (Tablica 3.16.), iako se invazivni hemodinamski nadzor ne preporučuje rutinski, nego samo uz određene indikacije. Paralelno se provode i mjere dijagnostike uzročnoga stanja koje je dovelo do kardiogenoga šoka, ponajprije akutnoga koronarnog sindroma (kardioselektivni enzimi, hitna koronarna angiografija).
|
Tablica 3.16. Hemodinamska mjerenja kod bolesnika u kardiogenom šoku
|
- Arterijska hipotenzija (sistolički tlak niži od 90 mmHg ili pad veći od 40 mmHg u odnosu na kronične vrijednosti);
- Centralni venski tlak viši od 12 mmHg;
- Vrijednost srčanoga indeksa (CI, od engl. cardiac index) manji od 2,2 L/min/m2;
- Plućni kapilarni okluzivni tlak (PCWP, od engl. pulmonary capillary wedge pressure) viši od 18 mmHg
|
Diferencijalna dijagnoza je široka i obuhvaća različite bolesti i stanja, a najčešće su to akutna plućna tromboembolija te nekardiogeni edem pluća (akutni respiratorni distres sindrom, ARDS).
Liječenje kardiogenog šoka usmjereno je na liječenje uzročne bolesti koja je dovela do njegova razvoja, kao što su perkutana koronarna intervencija, kardiokirurška revaskularizacija miokarda, kirurško zbrinjavanje komplikacija infarkta miokarda i sl. Potporne mjere liječenja kardiogenoga šoka uključuju primjenu lijekova ili uređaja koji potpomažu srčanu funkciju uz ostale, klasične mjere intenzivnoga liječenja.
Medikamentozno liječenje kardiogenoga šoka podrazumijeva primjenu vazoaktivnih lijekova (vazopresora i inotropa) kojima se nastoji postići povećanje minutnoga volumena i korekcija hipotenzije, čime se osigurava zadovoljavajuća perfuzija vitalnih organa i prevenira razvoj sindroma višeorganskoga zatajenja.
Inotropi se primjenjuju kod bolesnika sa sistoličkom disfunkcijom koja dovodi do sniženja ejekcijske frakcije, a služe kao privremeno rješenje do konačne terapije i oporavka srčane funkcije. Primjena inotropa nije opravdana kod bolesnika s dijastoličkom disfunkcijom te kod bolesnika s aortalnom stenozom ili opstrukcijom izlaznoga trakta lijevoga ventrikula s obzirom na to da može samo pogoršati stanje, Primjena tih lijekova zahtijeva stalan nadzor srčanoga ritma i krvnoga tlaka (invazivno mjerenje). Najčešći lijekovi koji se primjenjuju u tu svrhu su dobutamin, dopamin, levosimendan i milrinon. Dobutamin primarno djeluje na β-1 receptore, a ima i malen učinak na β-2 i α-1 receptore. Glavni je učinak pojačanje kontraktilne snage miokarda uz zanemariv učinak na frekvenciju. Pri primjeni može dovesti do nepredvidivih hipotenzija. Početna doza je 2,5 mcg/kg/min i može se titrirati do 20 mcg/kg/min. Dopamin u niskim dozama (1 - 3 mcg/kg/min) djeluje primarno na D-1 receptore i dovodi do dilatacije renalnih i mezenteričkih krvnih žila, u srednjim dozama (1 - 10 mcg/kg/min) djeluje poglavito na β-1 receptore i pojačava kontraktilnost s varijabilnim učinkom na srčanu frekvenciju (često izaziva tahiaritmije), dok u visokim dozama (> 10 mcg/kg/min) djeluje na α-1 receptore i dovodi do vazokonstrikcije (djeluje kao vazopresor). Prema tome, dopamin kao inotrop koristimo u srednjim terapijskim dozama. Levosimendan povećava osjetljivost kardijalnih miofibrila za kalcij bez povećanja intracelularne koncentracije kalcija (pojačava kontraktilnost). Zbog relaksacijskoga učinka na glatku muskulaturu dovodi i do vazodilatacije. Povećava kotraktilnost, a smanjuje preload te afterload. Primjenjuje se početno u dozi 6 - 12 mcg/kg kao intravenski bolus, a potom se nastavlja kontinuirana primjena u dozi od 0.05 do 0.2 mcg/kg/min. Milrinon je inhibitor fosfodiesteraze, a inotropni učinak na miokard ostvaruje inhibicijom razgradnje cAMP-a. Također, smanjuje i plućni i periferni vaskularni otpor (rezistenciju). Početna je doza 50 mcg/kg tijekom deset minuta, a potom je treba titrirati od 0,375 do 0,750 mcg/kg/min. Milrinon se često kombinira s dobutaminom.
Vazopresori su lijekovi koji djelujući na α-1 receptore dovode do vazokonstrikcije koja dovodi do povećanja tlaka i poboljšanja centralne perfuzije. Ipak, to uzrokuje tlačno opterećenje lijevoga ventrikula što pogoršava kardijalni status. Primjena vazopresora indicirana je samo za bolesnike s tvrdokornom hipotenzijom i hipoperfuzijom vitalnih organa unatoč primjeni inotropnih lijekova, kao i kod bolesnika kod kojih je ograničena primjena inotropnih lijekova. Najčešći vazopresor u kliničkoj praksi je noradrenalnin koji se primjenjuje u dozi od 0.2 do 1.5 mcg/kg/min, a sličan učinak može se postići i primjenom dopamina u visokim dozama (5 mcg/kg/min).
Mehanička cirkulatorna potpora indicirana je kod bolesnika s kardiogenim šokom kod kojih se ne može postići hemodinamska stabilizacija primjenom vazoaktivnih lijekova. Za tu je svrhu namijenjena intraaortalna balonska pumpa (IABP), vensko-arterijska ekstrakorporalna membranska oksigencija (VA-ECMO) te različiti tipovi uređaja za potporu rada ventrikula (LVAD, od engl. left ventricular assist device, RVAD – right venticular assist device ili BiVAD – biventricular assist device). Intraaortalna balonska pumpa s kontrapulsirajućim mehanizmom predstavlja cilindrični balon koji se plasira u aortu i širi se u vrijeme dijastole čime poboljšava propulziju krvi te poboljšava punjenje i perfuziju koronarnih arterija. Očekivani hemodinamski učinci intraaortalne balonske pumpe su pad sistoličkoga tlaka, povišenje dijastoličkoga tlaka, smanjenje srčane frekvencije te smanjenje plućnoga okluzivnog tlaka. Glavne kontraindikacije za postavljanje intraaortalne balonske pumpe su aortalna regurgitacija, disekcija aorte te poremećaji koagulacije. Komplikacije koje mogu pratiti taj postupak su akutna ishemija gornjih udova ili bubrega, laceracije aorte te cerebrovaskularni incidenti. Primjena vensko-arterijske ekstrakorporalne membranske oksigenacije sve je češći oblik mehaničke cirkulatorne potpore, a temelji se na načelu ekstrakorporalne oksigenacije krvi koja se obično crpi iz femoralne vene jedne noge, a vraća u femoralnu arteriju druge noge pri čemu se krv u izvantjelesnom krvotoku mora kontinuirano heparinizirati što zahtijeva stalni perfuzionistički nadzor. Načelno, sve metode mehaničke cirkulatorne potpore služe kao terapija premoštenja do oporavka srčane funkcije ili konačnoga oblika liječenja (npr. transplantacija).
Prognoza. Kardiogeni šok najčešći je neposredni uzrok smrti bolesnika s akutnim infarktom miokarda. Perkutana koronarna intervencija kao najznačajniji terapijski postupak kod ovakvih bolesnika smanjio je stopu smrtnosti s 80 do 90 % na manje od 50 %. Ukupno gledano, stopa smrtnosti bolesnika s kardiogenim šokom bez obzira na njegovu etiologiju iznosi oko 40 %.
OPSTRUKTIVNI ŠOK
Opstruktivni šok naziv je za poremećaj cirkulacije koji nastaje uslijed intravaskularnih opstrukcija protoka krvi koje možemo podijeliti u dvije kategorije: intrakardijalne i ekstrakardijalne. Najznačajniji intrakardijalni uzroci su tumori (miksom) i vegetacije, dok su najznačajniji ekstrakardijalni uzroci masivna plućna embolija, tamponada perikarda i teški konstriktivni perikarditis. Klinička slika ovisi o etiologiji, ali u pravilu se javljaju simptomi i znaci jednaki onima kod kardiogenoga šoka s izraženom plućnom i/ili sistemskom kongestijom. Ključnu dijagnostičku ulogu imaju ehokardiografija i MSCT angiografija. Više o kliničkoj slici, dijagnostici i liječenju nalazi se u odgovarajućim dijelovima udžbenika (plućna embolija, tamponada srca).
POREMEĆAJI SRČANOGA RITMA U JEDINICI INTENZIVNOGA LIJEČENJA
Uvodne napomene. oremećaji srčanoga ritma česta su pojava kod kritično oboljelih osoba te je uočavanje i liječenje periarestnih aritmija jedan od ključnih koraka u prevenciji kardijalnoga aresta. Detaljan prikaz aritmija nalazi se u odgovarajućim poglavljima o kardiologiji, dok je ovdje opisan univerzalni pristup bolesniku s tahiaritmijom ili bradiaritmijom uz analizu ritma u samo jednome odvodu, kako se i prikazuje kod bolesnika s nadziranom srčanom aktivnošću.
Nepovoljni znakovi. Procjena težine te klinički pristup bolesniku s poremećajem srčanoga ritma u prvome redu ovisi o prisutnosti nepovoljnih znakova. Njihova prisutnost govori o težini aritmije i neposrednoj ugrozi pacijenta (prijeteći arest), stoga nalaže brzu terapijsku intervenciju. Nepovoljni znakovi su: 1) znakovi šoka (hipotenzija, bljedoća, znojenje, poremećaj svijesti), 2) poremećaji svijesti (sinkopa), 3) zatajenje srca (plućni edem, distendirane vratne vene), 4) ishemija miokarda (anginozna bol ili elektrokardiografski nalaz) te 5) ekstremne frekvencije (tahikardija > 200/min, bradikardija < 40/min).
Hemodinamske posljedice. Ekstremna tahikardija ima dvojak učinak na hemodinamiku uslijed skraćenja dijastole: skraćena dijastola onemogućava zadovoljavajuće punjenje srčanih komora zbog čega se smanjuje minutni volumen, dok je s druge strane ugrožena perfuzija miokarda s obzirom na činjenicu da se protok krvi kroz koronarne arterije odvija samo za vrijeme dijastole (stoga je za očekivati da svi bolesnici s ekstremnom tahikardijom imaju promjene ST-segmenta). Ekstremna bradikardija također ima značajan utjecaj na hemodinamku s obzirom na to da smanjeni broj kontrakcija dovodi do smanjenoga minutnog volumena i sistemske hipoperfuzije.
PRISTUP BOLESNIKU S TAHIARITMIJOM
Pristup bolesniku. Osnovni postupak u kliničkom pristupu bolesniku s tahiaritmijom je procjena postoje li nepovoljni znakovi, o čemu ovisi daljnji postupak.
Tahiaritmije u prisutnosti nepovoljnih znakova. Nepovoljni znakovi obično se javljaju kod srčane frekvencije iznad 150 do 200/min ako se radi o zdravome srcu, dok se kod strukturno bolesnoga srca oni mogu javiti i pri nižim frekvencijama, 100 do 150/min. Terapijski izbor u liječenju tahiaritmija kod bolesnika u prisutnosti nepovoljnih znakova je sinkrona elektrokardioverzija bez obzira na vrstu aritmije. Sinkrona elektrokardioverzija provodi se do 3 pokušaja, a ako bolesnik ne reagira, indicirana je intravenska primjena amiodarona u dozi od 300 mg nakon čega treba ponoviti sinkronu elektrokardioverziju. Prema potrebi se može nastaviti s kontinuiranom intravenskom primjenom amiodarona u dozi od 900 mg tijekom 24 sata.
Sinkrona elektrokonverzija podrazumijeva isporuku istosmjerne struje kroz miokard koja se vremenski podudara s vrhom R-vala na elektrokardiogramu čime se izbjegava mogućnost isporuke struje u vrijeme repolarizacije miokarda, s obzirom na to da to može biti okidač nastanka ventrikularne fibrilacije. Postupak se izvodi uz opću anesteziju ili analgosedaciju. Jakost struje koja se primjenjuje ovisi o širini QRS-kompleksa ili vrsti tahiaritmije: kod tahiaritmija širokih QRS-kompleksa ili fibrilacije atrija isporučuje se DC šok jakosti 120 - 150 J ako se radi o bifaznom defibrilatoru, odnosno 200 J ako se radi o monofaznom, dok se kod tahiarimija uskih QRS-kompleksa ili undulacije atrija primjenuje DC šok jakosti 70 - 120 J ako se radi o bifaznom defibrilatoru, odnosno 100 J ako se radi o monofaznom.
Tahiaritmije bez prisutnosti nepovoljnih znakova. Kod takvih bolesnika osnovni korak podrazumijeva analizu tj. određivanje širine QRS-kompleksa. Kada je širi od 0,12 s (120 ms), govorimo o tahikardijama širokoga kompleksa, a kada je uži od 0,12 s (120 ms) govorimo o tahikardijama uskih kompleksa.
Tahikardija širokih kompleksa najčešće je ventrikularnoga porijekla ili se radi o supraventrikularnim tahikardijama s aberantnim provođenjem (obično blok grane). U daljnjemu je pristupu potrebno odrediti pravilnost ritma, odnosno procijeniti RR-intervale. Ako je ritam pravilan (jednaki RR-intervali), govorimo o pravilnoj tahikardiji širokih kompleksa, a ukoliko je ritam nepravilan (nejednaki RR-intervali), govorimo o nepravilnoj tahikardiji širokih kompleksa.
Pravilna tahikardija širokih kompleksa najčešće označava ventrikularnu tahikardiju ili supraventrikularnu tahikardiju u bloku grane ili uz preekscitaciju. Ako nema podataka o postojanju bloka grane ili preekscitacije od ranije, svaka se takva tahikardija tretira kao ventrikularna tahikardija. Liječenje se sastoji od intravenske primjene amiodarona, najprije u bolusu od 300 mg tijekom 10 do 20 minuta, a potom se nastavlja u kontinuiranoj infuziji u dozi od 900 mg tijekom 24 sata. Ako se pouzdano radi o supraventrikularnoj tahikardiji, provode se postupci kao za tahikardiju uskih QRS-kompleksa.
Nepravilna tahikardija širokih kompleksa može označavati fibrilaciju atrija s blokom grane ili preekscitacijom te polimorfnu ventrikularnu tahikardiju (torsades de pointes). Primjena amiodarona kod takvih bolesnika mora biti s oprezom s obzirom na to da se najčešće radi o bolesnicima s fibrilacijom atrija, čija konverzija u sinusni ritam izazvana amiodaronom može biti povezana s nastankom tromboembolijskih incidenata. Kod tih bolesnika u obzir dolazi primjena beta blokatora ili digitalisa (ako su dekompenzirani) kako bi se postigla kontrola frekvencije. U slučaju torsades de pointes tahiaritmije lijek izbora je magnezijev sulfat (2 g tijekom deset minuta), a potrebno je i izostaviti sve lijekove koji produljuju QT-interval te korigirati hipokalijemiju ako postoji.
Tahikardija uskih kompleksa ima supraventrikularno izvorište (sinus-atrijski čvor, atriji, atrioventrikularni čvor), a slično kao i kod tahikardija širokih kompleksa, potrebno je odrediti pravilnost ritma (jednakost RR-intervala) na temelju čega se razlikuje pravilna od nepravilne tahikardije uskih kompleksa.
Pravilna tahikardija uskih kompleksa najčešće označava sinusnu tahikardiju, supraventrikularnu tahikardiju te undulaciju atrija s pravilnim AV-provođenjem (obično blok 2:1). Sinusnu tahikardiju obilježava prisutnost P-vala ispred svakoga QRS-kompleksa s frekvencijom do 150 - 160/min. Ona može biti fiziološka pri naporu i stresu ili može označavati kompenzacijski mehanizam u patološkim stanjima kao što su anemija, krvarenje, zatajenje srca, bol, infekcija i sl. Sinusnu tahikardiju ne treba liječiti (korekcija etiološkoga čimbenika). Supraventrikularna tahikardija obilježena je frekvencijom iznad 150 - 160/min s time da se P-valovi ispred QRS-kompleksa obično ne vide. Rjeđe se vide u periarestnom periodu i često se mogu javiti u strukturno zdravome srcu. Undulacija atrija s pravilnim AV-provođenjem (blok 2:1) obično ima frekvenciju do 160/min (tipična undulacija atrija ima frekvenciju atrija oko 300/min tako da kod bloka 2:1 nastaje tahikardija oko 150/min). Ovaj oblik aritmije nekada je teško razlikovati od supraventrikularne tahikardije, što i nema veći značaj s obzirom na isti terapijski pristup. Inicijalni terapijski pristup podrazumijeva primjenu vagalnih postupaka (masaža karotidnoga sinusa, Valsalvin manevar). Lijek izbora je adenozin i daje se ako prethodni postupci ne daju rezultat (konverzija u sinusni ritam). Adenozin se daje u obliku brzoga venskog bolusa, najprije u dozi od 6 mg, a potom se može još dva puta ponoviti u dozi od 12 mg. Kod primjene se bolesnicima mora naglasiti da nakon primjene izaziva kratkotrajnu nelagodu u prsima. Alternativni su lijekovi verapamil 2,5 - 5 mg iv kroz nekoliko minuta (kontraindiciran kod preekscitacijskoga sindroma) i propafenon u dozi od 2 mg/kg kao spori intravenski bolus (kontraindiciran kod strukturno bolesnoga srca). Današnje smjernice ne preporučuju primjenu amiodarona kod ovih bolesnika.
Nepravilna tahikardija uskih QRS-kompleksa najčešće označava fibrilaciju atrija s brzim odgovorom ventrikula ili undulaciju atrija s varijabilnim AV-blokom. Terapijski pristup ovim bolesnicima uključuje konverziju u sinusni ritam, kontrolu frekvencije te prevenciju tromboembolijskih incidenata što je iscrpno opisano u poglavlju o fibrilaciji i undulaciji atrija. Konverzija u sinusni ritam provodi se samo ako je od nastupa aritmije prošlo do 48 sati, dok se u svim drugim slučajevima to može tek nakon što je isključeno postojanje intrakavitarnoga tromba (transezofagealna ehokardiografija) ili nakon provedene antikoagulantne trapije kroz tri tjedna. U slučaju hitne elektrokardioverzije (prisutni nepovoljni znaci) prije postupanja je potrebno dati niskomolekularni heparin. Konverzija u sinusni ritam može biti farmakološka (propafenon 2 mg/kg iv ili amiodaron 300 mg iv) ili se provodi elektrokardioverzija. Kod bolesnika kod kojih se ne može postići sinusni ritam temeljni terapijski cilj je kontrola frekvencije što se kod najvećega broja bolesnika postiže primjenom beta blokatora, rjeđe kalcijskih blokatora (ako su beta blokatori kontraindicirani) ili digitalisa (dekompenzirani bolesnici). Potreba za antikoagulantnom terapijom indicira se prema CHA2DS2VASc izračunu.
PRISTUP BOLESNIKU S BRADIARITMIJOM
Bradiaritmija je naziv za srčanu frekvenciju manju od 50/min koja se može javiti kao fiziološka pojava u određenim okolnostima (sportaši, teški fizički radnici), a može se javiti i kao posljedica patoloških stanja, bilo da se radi o srčanom porijeklu (bolest SA-čvora, poremećaji AV-provođenja), bilo o izvansrčanom porijeklu (hipotermija, hipotireoza, hiperkalijemija, vazovagalna) te utjecaju lijekova (beta blokatori, kalcijski blokatori, digoksin, amiodaron).
Klinički pristup. U slučaju prisutnih nepovoljnih znakova ili rizika od asistolije (nedavna asistolija, Mobitz II, kompletni AV-blok, ventrikularna stanka viša od 3 s) indicirano je hitno zbrinjavanje i liječenje. U prvom redu je to medikamentno liječenje, a lijek izbora je atropin koji se daje u dozi od 0,5 mg iv te se prema potrebi može ponavljati svakih 3 do 5 minuta do ukupne doze od 3 mg. Bradikardije uskih QRS-kompleksa pokazuju bolji odgovor na primjenu atropina od onih sa širokim QRS-kompleksom. Alternativni lijekovi u liječenju bradikardija su glukagon (kod predoziranja beta blokatorima ili blokatorima kalcijskih kanala), teofilin ili aminofilin (kod bradikardija uz inferiorni infarkt, ozljedu kralješnične moždine ili nakon transplantacije srca) te dopamin (2,5 - 10 µg/min). Kod bolesnika koji ne reagiraju na medikamentno liječenje indicirana je privremena elektrostimulacija (transkutana, intravenska).
Transkutana elektrostimulacija brzo se uspostavlja i lako je izvediva. Osnovni joj je nedostatak nelagoda koja nastaje kontrakcijom muskulature ako je bolesnik pri svijesti (potrebno je razmotriti analgeziju ili sedaciju). Postupak se obavlja se uz pomoć defibirilatora s opcijom elektrostimulacije uz samoljepljive elektrode, a razlikujemo elektrostimulaciju na zahtjev, zamjećivanje vlastitih QRS-a, impuls se odašilje samo kad izostane spontani QRS) te fiksnu elektrostimulaciju (impulsi se odašilju unaprijed određenom frekvencijom). Postupak se izvodi stavljanjem samoljepljivih elektroda na površinu prsnoga koša, a one su povezane s defibrilatorom na kojemu se uključuje program elektrostimulacije. Pri postavljanju elektroda obično se primjenjuje jedan od dva položaja: desna pektoralna i apikalna pozicija te antero-posteriorna pozicija. Na defibrilatoru se potom zadaje frekvencija (obično između 60 i 90/min) te izlazna energija (obično je to struja jakosti 50 do 100 mA, kreće se od niže jakosti te se ona postupno povećava dok se ne pojavi QRS nakon šiljka koji označava isporučeni impuls). Uspješnost elektrostimulacije potvrđuje se prisutnošću perifernih pulsacija.
Privremena transvenska elektrostimulacija podrazumijeva postavljanje elektrode transvenskim pristupom u desno srce pri čemu se vrh elektrode zabode u apeks desnoga ventrikula. Utvrđuje se minimalna voltaža potrebna za stimulaciju i ona se naziva prag stimulacije, a elektroda se postavlja tako da prag stimulacije bude manji od 1 V (viši prag stimulacije ukazuje na nezadovoljavajući kontakt elektrode s miokardom). Srce se stimulira izlaznom energijom od 3 do 4 V (više od praga stimulacije) jer se očekuje povišenje praga stimulacije u prvim danima. Porast praga stimulacije najčešće je posljedica dislokacije elektrode.
AKUTNO JETRENO ZATAJENJE I AKUTNI PANKREATITIS
Akutno jetreno zatajenje i akutni pankreatitis među najčešćim su bolestima iz područja gastroenterologije koje zahtijevaju prijem i liječenje u jedinici intenzivnoga liječenja s obzirom na njihovu težinu i ozbiljnost (poremećaj više organskih sustava) te potrebne metode i oblike liječenja (višestruko potporno liječenje različitih organa i organskih sustava).
AKUTNO JETRENO ZATAJENJE
Akutno jetreno zatajenje podrazumijeva jedan od dva temeljna oblika: akutna jetrena lezija i egzacerbacija kronične jetrene lezije. Akutna jetrena lezija predstavlja naglo i brzo pogoršanje jetrene funkcije de novo kod bolesnika koji do tada nisu imali bolest jetre. Najčešće je posljedica razvoja akutnoga virusnog hepatitisa ili akutne toksične lezije (jedan je od najčešćih uzroka akutne jetrene lezije u zapadnim zemljama predoziranje paracetamolom). Akutna lezija jetre općeprihvaćeno se dijeli u tri skupine: perakutna, akutna i subakutna (Tablica 3.17.). Egzacerbacija kronične jetrene lezije podrazumijeva naglo pogoršanje funkcije jetre, ali kod bolesnika s već postojećem bolesti jetre, najčešće cirozom. Ona može biti potaknuta različitim precipitirajućim čimbenicima, najčešće sistemskom infekcijom ili krvarenjem iz varikoziteta jednjaka. U oba slučaja bolesnici razvijaju karakteristična klinička stanja koja je potrebno prepoznati i prikladno liječiti, a najznačajniji su spontani bakterijski peritonitis, ascites, hepatorenalni sindrom, hemoragijska dijateza (koagulopatija) i hepatalna encefalopatija. Klinički pristup takvim bolesnicima podrazumijeva liječenje navedenih komplikacija što je detaljno opisano u poglavlju o komplikacijama ciroze jetre, a ovdje su predstavljene osnove. Intenzivistički pristup ovim bolesnicima podrazumijeva procjenu bolesnika i postavljanje indikacije za transplantacijsko liječenje ili primjenu ekstrakorporalnih metoda potpomognute funkcije jetre (engl. liver support systems), što je opisano u poglavlju Metode ekstrakorporalne cirkulacije i specifični oblici liječenja.
|
Tablica 3.17. Karakteristike akutne lezije jetre
|
|
Kliničke karakteristike
|
Perakutna jetrena lezija
|
Akutna jetrena lezija
|
Subakutna jetrena lezija
|
|
Najčešći uzroci
|
Paracetamol
Hepatitis A i E
Ishemija
|
Hepatitis B
Toksična lezija (osim paracetamola)
|
Toksična lezija (osim paracetamola)
|
|
Preživljenje bez transplantacije (%)
|
36
|
7
|
14
|
|
Izraženost ikterusa
|
+
|
++
|
+++
|
|
Izraženost encefalopatije
|
+++
|
++
|
+
|
|
Vremenski interval ikterus – encefalopatija
|
0 - 7 dana
|
8 - 28 dana
|
> 29 dana
|
|
Koagulacijski poremećaj
|
+++
|
++
|
+
|
Ascites. Nastanak ascitesa kod bolesnika s akutnim jetrenim zatajenjem u prvome je redu posljedica retencije natrija uslijed aktivacije renin-angiotenzin-aldosteron sustava. Liječenje se temelji na ograničavanju unosa natrija (do 2 g/dan), primjeni diuretika (spirinolakton, furosemid) te abdominalnoj paracentezi. Spironolakton je temeljni lijek u liječenju ascitesa. Antagonizira učinak aldosterona, a primjenjuje se u početnoj dozi od 100 mg i, kada je to potrebno, postupno se povećava do maksimalne doze od 400 mg/dan (potreban je oprez zbog mogućnosti nastanka hiperkalijemije). Furosemid se također primjenjuje u kombinaciji sa spironolaktonom, a temeljni učinak ostvaruje pospješivanjem bubrežne ekskrecije natrija. Početna doza furosemida iznosi 40 mg/dan te se ona postupno može povećavati do 160 mg/dan. Ako se kontrolu ascitesa ne može postići primjenom lijekova, a njegova količina stvara znatne simptome (ugroza disanja), indicirana je paracenteza. Prilikom jedne punkcije obično se evakuira do 5 L tekućine, rijetko više, zbog mogućih hemodinamskih promjena. Kod ovih bolesnika nakon paracenteze se preporuča primjena albumina (8,5 mg/kg za svaku litru tekućine koja se evakuira). Forsiranu diurezu treba izbjegavati kod bolesnika kod kojih se bilježi porast vrijednosti kreatinina radi izbjegavanja nastanka hepatorenalnoga sindroma.
Spontani bakterijski peritonitis označava infekciju ascitesa u odsutnosti intraabdominalnoga izvora infekcije (kolecistitis, kolangitis, ruptura šupljega organa i sl.) za koju se vjeruje da nastaje translokacijom enteropatogenih bakterija kroz stijenku crijeva u peritonealnu tekućinu. Ovu komplikaciju obično susrećemo kod bolesnika s akutnom lezijom jetre koji u podlozi od ranije imaju kroničnu jetrenu bolest (ciroza). Najčešći uzročnici su gram-negativni aerobni bacili (Escherichia coli) te, nešto rjeđe, gram-pozitivni aerobni koki (Streptococcus spp). Glavne kliničke manifestacije su povišena tjelesna temperatura, bol u trbuhu, napetost trbušne stijenke, iako kod trećine bolesnika to stanje može proći i bez simptoma. Dijagnoza se postavlja biokemijskom, mikrobiološkom i citološkom analizom uzorka dobivenoga abdominalnom paracentezom. Za postavljanje dijagnoze dovoljan je nalaz povišenih vrijednosti neutrofila (> 250/mm3) u dobivenom uzorku, što ujedno predstavlja i indikaciju za antibiotski tretman. Lijek izbora predstavlja cefotaksim (3 x 2 g/dan) ili neki drugi cefalosporin III. generacije. Stopa smrtnosti kod takvih je bolesnika visoka i kreće se između 30 do 40 %, što se povezuje s visokom stopom razvoja hepatorenalnoga sindroma kod njih.
Hepatorenalni sindrom predstavlja funkcionalni poremećaj bubrežne funkcije koji se razvija kod bolesnika s uznapredovalom bolesti jetre, a osobito kod bolesnika s razvijenim spontanim bakterijskim peritonitisom i/ili sepsom drugoga ishodišta. Smatra se da hepatorenalni sindrom nastaje kao posljedica hemodinamskih poremećaja koji uključuju splanhičnu vazodilataciju i kompenzatornu renalnu vazokonstrikciju (detaljno opisano u poglavlju Komplikacije ciroze jetre). Dijagnostički kriteriji za hepatorenalni sindrom uključuju: 1) akutno ili kronično zatajenje jetre s portalnom hipertenzijom, 2) serumski kreatinin veći od 132 µmol/L ili klirens kreatinina manji od 40 ml/min, 3) odsutnost šoka, infekcije, nefrotoksičnih lijekova i hipovolemije, 4) odsutnost poboljšanja bubrežne funkcije nakon ukidanja diuretika i volumne nadoknade te 5) proteinurija manja od 5 g/L, bez ultrazvučnoga dokaza opstruktivne uropatije ili znakova bolesti bubrežnoga parenhima. Osnovu liječenja čini primjena splanhičnih vazokonstriktora (terlipresin 1 - 2 mg iv svakih 4 do 6 sati) te volumnoga ekspandera (albumin 1 g/kg prvi dan, a potom 20 do 40 mg/dan do postizanja vrijednosti serumskoga albumina od 45 mg/dL). Ostale metode liječenja uključuju transjugularni intrahepatični portosistemski šant (TIPPS), jetrenu dijalizu ili transplantaciju jetre.
Hepatalna encefalopatija naziv je za moždanu disfunkciju koja se javlja pri teškom obliku jetrene bolesti, a povezana je sa smanjenom detoksikacijskom funkcijom jetre i razvojem kolateralne cirkulacije, zbog čega različite neurotoksične tvari dospijevaju u sistemsku cirkulaciju zaobilazeći jetru, a u konačnici prolaze krvno-moždanu barijeru i dospijevaju u središnji živčani sustav. Glavni neurotoksin odgovoran za nastanak takvoga stanja je amonijak koji nastaje u crijevima razgradnjom proteina, aminokiselina, ureje i dušičnih baza, što je posredovano crijevnim bakterijama. Osim anomijaka, neurotoksični učinak imaju i druge molekule, kao što su fenilalanin, tirozin i triptofan. Kliničku sliku hepatalne encefalopatije čini progresivno pogoršanje neurološkoga statusa i stanja svijesti kroz nekoliko stadija: stadij 1 (kognitivne smetnje, blaža konfuzija, zbunjenost, nesanica), stadij 2 (izražena pospanost, dezorijentacija, nemogućnost izvođenja misaonih zadataka), stadij 3 (somnolencija, nerazgovijetan govor, ne izvršava zadane naredbe), stadij 4a (komatozno stanje s motoričkim odgovorom na grube podražaja) te stadij 4b (komatozno stanje s potpunom nereaktivnošću). Pri fizikalnom pregledu dominiraju distalni tremor i foetor haepaticus. Dijagnoza se postavlja na temelju kliničke slike i laboratorijske dijagnostike pri čemu ključnu ulogu ima nalaz hiperamonijemije. Vrijednosti amonijaka koreliraju s težinom kliničke slike, a potrebno je naglasiti da su vrijednosti amonijaka više u arterijskoj krvi nego u venskoj, što ima visok dijagnostički značaj u početnim fazama bolesti kada su vrijednosti amonijaka u venskoj krvi uredne, a u arterijskoj povišene. Kod svih je bolesnika potrebno isključiti i druge moguće uzroke poremećaja stanja svijesti, kao što su kronični subduralni hematom i Wernickeova encefalopatija, pri čemu značajnu ulogu ima neuroradiološka dijagnostika (CT ili MR mozga). Osnovu liječenja čini smanjenje proizvodnje amonijaka u crijevima što se postiže primjenom laksativa (laktuloza) kao prvom linijom liječenja te neapsorbirajućih antibiotika što čini drugu liniju liječenja. Laktuloza dovodi do acidifikacije kolona što dovodi do disocijacije amonijaka koji se onda ne može apsorbirati, a dovodi i do promjene same crijevne flore. Najčešći put primjene je peroralni (oralni unos, nazogastrična sonda) pri čemu se inicijalno daje 45 ml laktuloze svaki sat do postizanja defekacije, a potom se daje 30 ml svakih 8 do 12 sati. Ako je taj put nemoguć (bolesnik bez svijesti s varikozitetima jednjaka zbog kojih se ne može plasirati nazogastrična sonda), laktuloza se primjenjuje u obliku rektalne klizme. Princip se sastoji od primjene mješavine 300 ml laktuloze u jednoj litri vode koja se potom aplicira u debelo crijevo nakon čega se bolesnika kroz sat vremena drži u Trendeleburgovom položaju. Najčešći neapsorbirajući antibiotik koji se koristi u liječenju hepatalne encefalopatije je neomicin koji se primjenjuje peroralno u dozi od 3 do 6 g podijeljeno u tri dnevne doze (3 x 1 g ili 3 x 2 g) kroz 7 do 14 dana. Osim njega, može se primjenjivati i rimfampicin u dozi od 3 x 400 mg peroralno kroz 14 do 21 dana. Također, bolesnicima s hepatalnom encefalopatijom potrebno je reducirati unos proteina i to na preporučene vrijednosti od 1,2 do 1,5 g/kg/dan. U slučaju potvrđenoga edema mozga neuroradiološkim metodama, primjenjuje se antiedematozna terapija (intravenski manitol, acetazolamid).
Koagulopatija i hemoragijska dijateza česte su komplikacije akutnoga zatajenja jetrene funkcije, a mogu se javiti iz nekoliko razloga: 1) smanjenjem sintetske funkcije jetre dolazi i do smanjene sinteze većine faktora koagulacije; 2) splenomegalija je odgovorna za povećanu sekvestraciju trombocita zbog čega se razvija klinički značajna trombocitopenija (hipersplenizam) te 3) toksemija koja prati uznapredovalu fazu jetrene bolesti može djelovati kao depresor normalne funkcije koštane srži. Klinički, bolesnici su skloni spontanim krvarenjima (ekhimoze, petehije, epistaksa), krvarenju iz probavnoga sustava te na mjestima invazivnih procedura (središnji venski kateter, biopsije, punkcije i sl.). Dijagnoza se postavlja određivanjem klasičnoga koagulograma i određivanjem broja trombocita: trombocitopenija, produljeno protrombinsko vrijeme i aktivirano parcijalno tromboplastinsko vrijeme (PV i APTV) uz snižen fibrinogen i antitrombin III. Primjena vitamina K kod takvih bolesnika ima ograničen učinak s obzirom na to da je oštećena sintetska funkcija jetre, bez obzira na malapsorpciju vitamina topljivih u mastima, pa tako i vitamina K. Osnovu liječenja čini primjena svježe smrznute plazme kojom se vrši supstitucija faktora zgrušavanja, iako je njezin vremenski učinak ograničen pa se i ne primjenjuje rutinski, nego samo u slučaju krvarenja ili prije neophodnih invazivnih procedura. Transfuzija trombocita indicirana je kod bolesnika s aktivnim krvarenjem ili kod kritično niskih vrijednosti trombocita (< 5 x 109/L). Primjena eltrombopaga (trombopoetin) može reducirati potrebu za transfuzijom trombocita kod bolesnika s cirozom jetre i vrijednostima trombocita nižima od 50 x 109/L, ali njegova primjena nosi rizik od razvoja tromboze portalne vene i arterijskih tromboembolijskih incidenata. U liječenju aktivnoga krvarenja kod ovih bolesnika može biti indicirana i primjena aktiviranoga faktora VII, kao i protrombinskoga kompleksa.
Ekstrakorporalne metode potpomognute funkcije jetre (engl. liver support systems). Unazad desetak i više godina razvijane su metode kojima se nastoji potpomoći funkcija jetre kako bi se premostio period do oporavka (regeneracije) jetrenoga parenhima ili do transplantacije čime se povećava preživljenje ovih bolesnika. One se primjenjuju u slučaju kada se prethodno opisanim, konzervativnim (medikamentnim) metodama liječenja ne postiže oporavak bolesnika te se bilježi daljnje napredovanje jetrenoga zatajenja. Tri najčešće korištene metode su MARS (engl. molecular adsorbent recirculating system), FPSA (engl. fractionated plasma separation and adsorption) te SPAD (engl. single-pass albumin dialysis).
Indikacije za transplantaciju jetre. Svi bolesnici s akutnim jetrenim zatajenjem koje ne reagira na poduzete mjere liječenja uzimaju se u razmatranje za transplantaciju. Indikacije za transplantaciju jetre kod bolesnika s toksičnom lezijom jetre dane su u King's College kriterijima (Tablica 3.18.), dok su indikacije za transplantaciju kod drugih specifičnih oblika (npr. akutni hepatitis) opisane u odgovarajućim dijelovima o gastroenterologiji (akutni i kronični virusni hepatitisi).
|
Tablica 3.18. Indikacije za transplantaciju jetre pri akutnoj toksičnoj leziji jetre (King's College criteria).
|
|
Toksična lezija jetre uzrokovana acetaminofenom
|
Toksična lezija jetre uzrokovana drugim lijekovima i toksinima
|
|
pH < 7.3
|
INR > 6.5 ili bilo koja tri sljedeća kriterija:
|
|
Laktati > 3.5 nM nakon 8 sati
|
|
|
Laktati > 3.0 nM nakon 12 sati
|
|
|
Kreatinin > 300 mmol/L
|
|
|
INR > 6.5
|
- Dob između 10 i 40 godina
|
|
Encefalopatija 3. - 4. Stupanj
|
- Etiologija: reakcija na lijek i li nepoznato
|
AKUTNI PANKREATITIS
Akutni pankreatitis naziv je za akutnu upalu gušterače koja se manifestira bolovima u trbuhu te povišenjem pankreatičnih enzima (amilaze, lipaze), a u osnovi može imati blaži (intersticijski) i teži (nekrotizirajući) oblik. Akutni nekrotizirajući pankratitis čini 10 do 15 % svih pankreatitisa, obilježen je nekrozom i destrukcijom tkiva gušterače te jakim sistemskim upalnim odgovorom (SIRS) koji može dovesti do sindroma višeorganskoga zatajenja (pluća, bubrezi, cirkulacija). Smrtnost od akutnoga nekrotizirajućeg pankreatitisa kreće se i do 40 %. Najčešći uzroci akutnoga pankreatitisa su žučni kamenci (40 %) te alkohol (30 %), dok su rjeđi uzroci abdominalna trauma, hipertrigliceridemija, lijekovi (acetaminofen, pentamidin, omeprazol, furosemid), infekcije (HIV, cytomegalovirus, mycoplasma, legionella) te vaskulitisi. Kod oko 20 % bolesnika uzrok akutnoga pankreatitisa ostaje nepoznat.
Teški pankreatitis naziv je za kliničko stanje karakterizirano prisutnošću akutnoga pankreatitisa (obično nekrotizirajućega) u vremenskom periodu dužem od 48 sati uz pridruženi poremećaj jednoga ili više organa, odnosno organskoga sustava, kao posljedice razvoja sistemskoga upalnog odgovora (SIRS). Najčešće se radi o plućima (akutni respiratorni distres sindrom), bubrezima (akutno bubrežno oštećenje) te kardiovaskularnom sustavu (hipotenzija, šok).
Dijagnoza akutnoga pankreatitisa zasniva se na kliničkoj slici, povišenim vrijednostima pankreatičkih enzima (amilaze, lipaze) te analizi patomorfoloških promjena slikovnim dijagnostičkim metodama, posebice kompjuteriziranoj tomografiji (CT).
Amilaze predstavljaju pankreasne enzime koji sudjeluju u razgradnji ugljikohidrata, a osim u gušterači, mogu nastati i u žlijezdama slinovnicama te jajovodima. Vrijednosti serumskih amilaza počinju rasti 6 do 12 sati nakon nastupa bolesti, vršne koncentracije ostvaruju se tijekom 24 do 48 sati, a potom padaju i vraćaju se u normalu kroz tri do pet dana. U prilog akutnom pankreatitisu ide povišenje vrijednosti amilaza trostruko iznad referentnih vrijednosti, što nosi visoku osjetljivost (> 90 %), ali i nižu specifičnost (60 – 70 %) zbog mogućih drugih uzroka njihova povišenja, kao što su akutni kolecistitis, bubrežno zatajenje, parotitis, ulkusna bolest, ileus, ektopična trudnoća, dijabetička ketoacidoza te akutna alkoholna intoksikacija (pri akutnoj alkoholnoj intoksikaciji povišenje serumskih amilaza može biti prisutno i u do 40 % slučajeva, pri čemu su one porijeklom od žlijezda slinovnica, a ne od gušterače i njezine upale).
Lipaze predstavljaju pankreasne enzime koji sudjeluju u razgradnji triglicerida, a osim gušterače, izvori lipaza su i jetra, crijeva te cirkulirajući lipoproteini. Za razliku od amilaza, porast lipaza nastupa ranije, već unutar četiri do osam sati od nastupa simptoma te se njihove povišene vrijednosti duže zadržavaju, obično kroz 8 do 14 dana. Iako povišene vrijednosti lipaza možemo naći i pri nekim drugim stanjima (lezije jetre i crijeva), rijetka su pojava pa se smatraju specifičnijim markerom za akutni pankreatitis u odnosu na amilaze. U prilog akutnom pankreatitisu ide povišenje vrijednosti lipaza trostruko iznad referentnih.
Slikovne metode. CT uz primjenu kontrastnoga sredstva omogućava odgovarajuću procjenu patomorfologije tkiva gušterače, što ima ulogu u razgraničenju intersticijskoga od nekrotizirajućega pankreatitisa, kao i u uočavanju razvoja komplikacija (infekcije, ciste, pseudociste). Potpuni opseg nekroze gušterače neće se vidjeti u prvim danima bolesti, stoga se preporuča ponavljanje pretrage za 7 do 10 dana, a tada se obično uočavaju komplikacije ako su se razvile. S obzirom na to da su žučni kamenci među najčešćim uzrocima akutnoga pankreatitisa, svim se bolesnicima preporuča ultrazvuk abdomena s osvrtom na jetru, žučnjak i žučne puteve.
Liječenje. Osim liječenja osnovnoga uzroka bolesti (endoskopska retrogradna kolangiopankreatografija kod bilijarne etiologije, alkoholna apstinencija, plazmafereza kod visokih vrijednosti triglicerida i sl.), kod bolesnika je potrebno provoditi mjere potpornoga liječenja zahvaćenih organa i organskih sustava. Osnovne mjere liječenja akutnoga pankreatitisa u jedinici intenzivnoga liječenja prikazane su u nastavku teksta.
Hemodinamska stabilizacija. Hipotenzija i šok su među glavnim komplikacijama akutnoga pankreatitisa i nastaloga SIRS-a. Inicijalni korak u hemodinamskoj stabilizaciji podrazumijeva volumnu resuscitaciju kristaloidnim infuzijskim otopinama pri čemu se početno daje volumen od 20 ml/kg tijekom 60 do 90 minuta, a potom se nastavlja primjenom volumena od 250 ml/sat tijekom sljedećih 24 do 48 sati s ciljem postizanja vrijednosti srednjega arterijskog tlaka više od 65 mmHg te satne diureze više od 0,5 ml/kg/sat (ako se to može postići i uz manje volumene, nije potrebno davati ovu preporučenu količinu volumena infuzijskih otopina). Ako se navedene ciljne vrijednosti srednjega arterijskog tlaka i satne diureze ne mogu osigurati navedenom volumnom resuscitacijom (volumen infundiranih otopina ne smije prelaziti 250 ml/h), indicirano je vazoaktivno liječenje pri čemu se preporuča primjena noradrenalina (0,1 ug/kg/h) kao vazopresora prvoga izbora.
Respiratorna stabilizacija. Pri stabilizaciji respiratorne funkcije vodimo se plinskim analizama arterijske krvi (vrijednosti parcijalnih tlakova kisika i ugljičnog dioksida) te radiološkim nalazom pluća. Početni korak podrazumijeva primjenu oksigenoterapije (primjena kisika preko nosnoga katetera ili maske), a ako se to pokaže neučinkovitim, pristupa se neinvazivnoj ili invazivnoj mehaničkoj ventilaciji. Primjena kortikosteroida dolazi u obzir, ali njihova učinkovitost nije potvrđena i provjerena odgovarajućim kliničkim studijama.
Stabilizacija bubrežne funkcije. Razvoj akutnoga bubrežnog oštećenja kod bolesnika s akutnim pankreatitisom česta je pojava, ali ono dobro reagira na volumnu nadoknadu. Često se uz primjenu volumena primjenjuju i niže doze diuretika Henleove petlje (furosemid) kako bi se dodatno potaknulo mokrenje. Primjene visokih doza diuretika ne preporuča se zbog jakoga opterećenja ionako bolešću opterećenih glomerula, što može biti kontraproduktivno. Ako se ne postigne zadovoljavajuća diureza i kontrola azotemije, ili se razviju klasične komplikacije akutnoga bubrežnog oštećenja (hipervolemija, hiperkalijemija, metabolička acidoza), indicirano je liječenje hemodijalizom pri čemu se prednost daje kontinuiranim metodama (CVVHDF) kada se radi o hemodinamski nestabilnom bolesniku.
Antibiotska profilaksa. Infekcija nekrotizirajućega pankreatičkog tkiva prisutna je kod oko trećine bolesnika, razvije se obično od sedmoga do desetoga dana od početka bolesti, a glavni uzročnici su gram-negativne bakterije. Profilaktička primjena antibiotika nije pokazala smanjenje učestalosti tih infekcija, pa se ni ne preporuča, a antibiotici se daju samo u slučaju razvoja infekcije. Unatoč tim preporukama, velika većina kliničara ipak takvim bolesnicima daje profilaktičke antibiotike, i to najčešće iz skupine karbapenema (meropenem).
Prehrana. Nasuprot nekadašnjim preporukama o dugotrajnoj karenciji kod ovih bolesnika, danas se preporuča započeti enteralnu prehranu unutar 48 sati od početka bolesti i to korištenjem enteralnih sondi. Takav pristup potpomaže održavanje crijevne funkcije i sprečavanje razvoja atrofije crijevnih resica te sindroma bakterijskoga prerastanja i bakterijske translokacije kroz crijevnu stijenku, što se smatra glavnim uzrokom nastanaka infekcija nekroze pankreasa. Glavni način enteralnoga unosa hrane kod ovih bolesnika predstavlja nazojejunalna sonda koja se obično postavlja uz pomoć endoskopa, čime se izbjegava hranom potaknuto lučenje enzima gušterače. Zbog funkcionalnih osobitosti jejunuma (kapacitet, sekrecija), pripravci koji se primjenjuju trebaju biti izotonični, a primjena polagana (obično tijekom više sati putem enteralnih pumpi).
Ostale metode liječenja. Danas je jedan od čestih postupaka u liječenju akutnoga pankreatitis s razvijenim sistemim upalnim odgovorom (SIRS) i akutnim bubrežnim oštećenjem primjena kontinuiranih metoda dijalize (CVVHDF) uz korištenje membrana koje imaju sposobnost adsorpcije citokina. Uspješnost ove metode u liječenju akutnoga pankreatitisa nije jasno potvrđena studijama, a glavne dvojbe uključuju uklanjanje antiupalnih citokina koji se suprostavljaju SIRS-u zajedno s proupalnima, zbog čega se prilikom odluke za ovu metodu liječenja preporuča što ranija primjena, dok u krvi dominiraju proupalni citokini.
Infekcija pankreatičnoga tkiva najčešća je komplikacija akutnoga nekrotizirajućeg pankreatitisa koja se događa između sedmoga i desetog dana bolesti, a osnovni uzročnici su gram-negativne bakterije koje translokacijom iz crijeva dospijevaju u trbušnu šupljinu. Dijagnoza se postavlja CT pregledom (pojava mjehurića unutar nekrotičnoga tkiva), a potvrđuje CT vođenom iglenom aspiracijom sadržaja. Liječenje podrazumijeva primjenu antibiotika (meropenem, piperacilin-tazobaktam) uz kiruršku ili perkutanu intervenciju (nekrostomija).
ANEMIJA, TROMBOCITOPENIJA I KOAGULOPATIJA KOD KRITIČNO OBOLJELIH BOLESNIKA
Anemija, trombocitopenija i koagulopatija hematološki su poremećaji koji se često susreću kod teško oboljelih bolesnika u jedinicama intenzivnoga liječenja. U ovome će dijelu biti opisane posebnosti njihovoga nastanka i kliničkoga pristupa u kontekstu kritično oboljeloga bolesnika.
ANEMIJA KOD KRITIČNO OBOLJELIH BOLESNIKA
Definicija. Anemija se često viđa kod kritično oboljelih osoba, a definira se vrijednostima hemoglobina ispod 130 g/L za muškarce, odnosno 120 g/L za žene. Anemija je prisutna kod gotovo trećine bolesnika pri prijemu u jedinicu intenzivnoga liječenja te se razvije kod više od 95 % bolesnika nakon sedam dana intenzivnoga liječenja.
Etiopatogeneza. Uzroci i mehanizmi razvoja anemije kod ove skupine bolesnika su različiti. Ona može biti posljedica pojačanoga gubitka krvi, poremećene eritrocitopeze, malapsorpcijskoga sindroma, pojačane sekvestracije željeza te utjecaja lijekova.
Pojačani gubitak krvi kod ovih bolesnika najčešće nastaje uslijed učestalih venepunkcija kojima se na dnevnoj bazi može izgubiti i 40 do 70 ml krvi, uslijed gubitka krvi preko probavnoga sustava (erozivni gastritis, stresni ulkusi), a može nastati i kao posljedica poslijeoperativnoga i poslijetraumatskog gubitka krvi.
Poremećena eritrocitopoeza nastaje kao posljedica djelovanja proupalnih citokina koji mogu djelovati na više razina: inhibiraju lučenja eritropetina iz bubrega, smanjuju osjetljivost koštane srži za eritropetin te potiču sekvestraciju željeza u makrofazima. Uslijed navedenoga dolazi do smanjenoga stvaranja eritrocita u koštanoj srži i/ili dolazi do stvaranja nezrelih oblika eritrocita koji se otpuštaju u cirkulaciju.
Malapsorpcijski sindrom. Nezadovoljavajuća prehrana (malnutricija), kao i poremećena funkcija probavnoga trakta (maldigestija), kod kritično oboljelih osoba rezultira manjkom tvari nužnih za normalnu eritrocitopezu, u prvom se redu tu misli na vitamin B12, folnu kiselinu i željezo.
Pojačana sekvestracija željeza u upalne stanice i stanice retikuloendotelnoga sustava uz infektivna stanja i kronične upalne bolesti (reumatske bolesti, upalna bolest crijeva) kojima dominira aktivnost proupalnih citokina dodatno pridonosi neučinkovitoj eritrocitopezi i razvoju anemije. Sama sekvestracija željeza predstavlja prirodni obrambeni mehanizam s obzirom na to da željezo potiče rast i virulenciju mnogih mikroba.
Utjecaj lijekova. Primjena različitih lijekova kod kritično oboljelih osoba može se odraziti na nastanak anemije, bilo zbog supresije stvaranja eritrocita, najčešće uslijed smanjenja lučenja eritropoetina (blokatori kalcijskih kanala, beta blokatori, lijekovi s učinkom na renin-angiotenzin sustav, teofilin), bilo zbog pojačane razgradnje, odnosno hemolize (piperacilin, ceftriakson, diklofenak, metildopa, nitrofurantion).
Klinička slika. Anemija se kod ovih bolesnika najčešće uočava na temelju redovnoga praćenja laboratorijskih nalaza s obzirom na težinu i izraženost drugih kliničkih simptoma i znakova. Razvoj anemije kod kritično oboljelih bolesnika povezan je s lošijim kliničkim ishodima, osobito kod starijih bolesnika s prisutnim različitim kroničnim komorbiditetima (kronične bolesti srca, pluća ili bubrega). Razvoj kompenzacijskih mehanizama, posebice povećanje srčanoga minutnog volumena može rezultirati težim oporavkom ili pogoršanjem kardijalnoga statusa. Također, kod bolesnika s izraženom anemijom bilježi se i teže odvajanje od mehaničke ventilacije, kao i viši postotak reintubacije, osobito kod bolesnika s od ranije prisutnim kroničnim plućnim bolestima.
Dijagnoza se postavlja na temelju laboratorijskih nalaza. Gotovo se kod svih bolesnika u jedinici intenzivnoga liječenja na dnevnoj razini prati crvena krvna slika koja omogućava praćenje vrijednosti broja eritrocita, hemoglobina, hematokrita i eritrocitnih indeksā. S ciljem diferenciranja uzroka, tj. mehanizma nastanka anemije, mogu se dodatno određivati ferogram (željezo, feritin, TIBC, UIBC), vrijednosti folne kiseline i vitamina B12, retikulocita, bilirubina, haptoglobina, laktat dehidrogenaze, a od pomoći mogu biti i periferni razmaz krvi te citološka punkcija koštane srži.
Liječenje. Osnovno liječenje podrazumijeva liječenje osnovne bolesti, a korekcija anemije najčešće se provodi transfuzijama koncentriranih eritrocita koje povećavaju dostavu kisika perifernim tkivima i smanjuju tkivnu hipoksiju. Današnje preporuke za transfuziju koncentriranih eritrocita kritično oboljelim osobama koje ne pokazuju znakove akutnoga krvarenja uključuju vrijednosti hemoglobina manje od 70 g/L, osim kod bolesnika s akutnim kardiovaskularnim oboljenjem (osobito akutni koronarni sindrom) i kod bolesnika koji se nalaze u ranoj fazi sepse kod kojih se ciljne vrijednosti hemoglobina kreću između 90 i 100 g/L. Terapijske metode alternativne transfuziji koncentriranih eritrocita podrazumijevaju primjenu lijekova koji stimuliraju eritrocitopoezu, terapiju željezom te primjenu krvnih supstituenata. Studije koje su provođene za sada nisu pokazale kliničke prednosti primjene eritropoetina, niti je njihova primjena dovela do smanjene potrebe za transfuzijom koncentriranih eritrocita kritično oboljelim bolesnicima, a bilježila se veća pojavnost tromboembolijskih incidenata, zbog čega je njegova primjena strogo ograničena (npr. bubrežni bolesnici i sl.). Primjena željeza kod ovih je bolesnika također kontroverzna jer željezo samo po sebi potiče rast i virulenciju mikroba, pa bi se njegovom primjenom poticao nastanak nazokomijalnih infekcija.
TROMBOCITOPENIJA U KRITIČNO OBOLJELIH BOLESNIKA
Definicija. Trombocitopenija je jedna od najčešćih hematoloških abnormalnosti koju nalazimo kod bolesnika u jedinici intenzivnoga liječenja sa širokom incidencijom od 10 do 60 %. Trombocitopenija se definira smanjenim brojem trombocita i to u vrijednosti ispod 150 x 109/L, a razlikujemo blagu (100 – 150 x 109/L), umjerenu (50 – 100 x 109/L) i tešku trombocitopeniju (< 50 x 109/L). Prisutnost trombocitopenije kod ovih bolesnika povećava rizik od krvarenja i potrebe za transfuzijskim liječenjem. Najčešći uzroci trombocitopenije kod kritično oboljelih bolesnika navedeni su u Tablici 3.19.
|
Tablica 3.19. Etiologija trombocitopenije u jedinici intenzivnoga liječenja
|
|
Česti uzroci
|
Manje česti uzroci
|
Rijetki uzroci
|
|
Sepsom inducirana trombocitopenija
Diseminirana intravaskularna koagulopatija
Dilucija (masivna transfuzija)
Mijelosupresivna kemoterapija
Mehanička cirkulatorna potpora
|
Heparinom inducirana trombocitopenija
Hemofagocitni sindrom
|
Lijekovima izazvana trombocitopenija
Trombotička trombocitopenična purpura
Imuna trombocitopenija
Posttransfuzijska purpura
Hematološka maligna oboljenja
|
Patogeneza. Trombocitopenija kod kritično oboljelih osoba može nastati iz nekoliko razloga: smanjena proizvodnja, pojačana sekvestracija (zarobljavanje), pojačana destrukcija i/ili povećana potrošnja.
Smanjena proizvodnja trombocita. Ovaj mehanizam u najmanjoj mjeri doprinosi razvoju trombocitopenije kod kritično oboljelih bolesnika s obzirom na to da proupalni citokini koji dominiraju kod ovih bolesnika i inhibiraju eritrocitopezu imaju suprotan učinak na megakariocite te potiču trombopoezu. Taj mehanizam nastanka tombocitopenije dominira kod osoba s bolesti koštane srži ili kod bolesnika nakon kemoterapije.
Pojačana sekvestracija trombocita. Stanice retikuloendotelnoga sustava jetre i slezene mogu biti mjesto pojačane sekvestracije trombocita, što se poglavito viđa u uvjetima hepatosplenomegalije i portalne hipertenzije, kao i kod bolesnika sa srpastom anemijom. Kod ostalih bolesnika ovaj mehanizam nema veću ulogu u nastanku trombocitopenije.
Pojačana razgradnja i/ili potrošnja trombocita predstavljaju osnovne mehanizme razvoja trombocitopenije kod kritično oboljelih bolesnika. Nekoliko je glavnih patofizioloških pokretača pojačane destrukcije i/ili potrošnje trombocita: trombin, antitijela, histoni, deficijencija ADAMTS13 proteina te aktivacija komplementa.
Aktivaciju i potrošnju trombocita posredovanu trombinom često nalazimo kod bolesnika s razvijenim sindromom sistemskoga upalnog odgovora (SIRS) kod kojega se uslijed aktivacije endotelnih stanica potaknute proupalnim citokinima aktivira i koagulacijski slijed, uslijed čega se pojačano stvara trombin koji ima sposobnost aktivacije trombocita. Aktivirani se trombociti međusobno povezuju u trombocitni čep (agregacija) zbog čega se oni pojačano troše.
Destrukcija trombocita posredovana antitijelima nešto je rjeđi uzrok trombocitopenije kod kritično oboljelih bolesnika. Najčešće se viđa kod bolesnika s razvijenom trombocitopenijom induciranom heparinom kod kojih se stvaraju protutijela na heparin-PF4 kompleks. Također, ovaj se mehanizam može naći i kod drugih trombocitopenija induciranih lijekovima (vankomicin, linezolid, ranitidin, antagonisti glikoproteinskih IIb/IIIa receptora). Trombocitopenija posredovana autoantitijelima može se vidjeti kod bolesnika s od ranije postojećim autoimunim bolestima (npr. sistemski eritematozni lupus).
Oslobađanje histona tijekom staničnoga oštećenja može pridonijeti nastanku trombocitopenije s obzirom na to da oni imaju sposobnost aktivacije trombocita, što je i dokazano na animalnim modelima (infuzija histona dovodi do brzoga pada vrijednosti trombocita). Također, kod bolesnika u jedinicama intenzivnoga liječenja pokazano je da serumske razine histona koreliraju s vrijednostima trombocita.
Aktivacija komplementa, bilo klasičnim, bilo alternativnim putem, povezana je i s pojačanom aktivacijom trombocita zbog čega se oni pojačano troše, a i sam konačni produkt ovoga puta, MAC kompleks (engl. membrane attack complex), može uzrokovati destrukciju trombocita.
Deficijencija ADAMTS13 proteina koja se može naći kod septičkih bolesnika također je povezana s pojačanom aktivacijom i potrošnjom trombocita uslijed akumulacije visokomolekularnoga von Willenbrandovog faktora (opisano u nastavku u dijelu o trombotičkoj trombocitopeničnoj purpuri).
Klinička slika. Kod većine se bolesnika trombocitopenija dijagnosticira na temelju rutinskih laboratorijskih kontrola. S druge strane, kod bolesnika se mogu uočavati znakovi hemoragijske dijateze, kao što su kožna krvarenja (ekhimoze, petehije, purpura), krvarenja oko ubodnih mjesta vaskularnih katetera, ili se mogu javiti jasna i manifestna krvarenja (epistaksa, hemoptiza, hematemeza, hematurija).
Dijagnostički pristup. ijagnoza se postavlja na temelju laboratorijskoga nalaza sniženoga broja trombocita, a obradu treba nadopuniti i drugim osnovnim koagulacijskim pretragama, kao što su protombinsko vrijeme, aktivirano parcijalno tromboplastinsko vrijeme, fibrinogen, antitrobin III te D-dimeri. Prema potrebi se obrada nadopunjava i drugim, specifičnim laboratorijskim i drugim pretragama. U procjeni mogućega uzroka trombocitopenije ključni su podaci o ranijim bolestima, odnosno ranijim patološkim nalazima trombocita ili koagulograma, kao i o kretnjama broja trombocita tijekom boravka u jedinici intenzivnoga liječenja (Tablica 3.20.).
|
Tablica 3.20. Dijagnostički pristup bolesniku s trombocitopenijom u JIL-u
|
|
Obrazac trombocitopenije
|
Moguća etiologija
|
Preporučena obrada
|
|
Trombociti niski po prijemu i takvi ostaju cijelo vrijeme, bez promjena u odnosu na tijek bolesti
|
Uzrok neovisan o kritičnoj bolesti: bolest koštane srži, hipersplenizam.
|
Ultrazvuk slezene.
Biopsija koštane srži.
|
|
Trombociti niski po prijemu i brzo se oporavljaju
|
Postoperativna trombocitopenija, stanje nakon masivne transfuzije.
|
Anamnestički podaci.
|
|
Trombociti padaju u prvim danima i oporavljaju se zajedno s poboljšanjem općega stanja
|
Bolesti i stanja u kojima dominira patofiziološki obrazac SIRS-a.
|
Klasični koagulogram (isključiti DIK).
|
|
Trombociti padaju u prvim danima i ostaju niski unatoč oporavku bolesnikova stanja
|
Jatorgene trombocitopenije (HIT, post-transfuzijska purpura, drugi lijekovi)
|
Testiranja na HIT antitijela.
Analiza lijekova koji se primjenjuju.
|
|
Trombociti padaju u prvim danima i ostaju niski uz pogoršanje stanja bolesnika
|
Septička koagulopatija, DIK, hemofagocitni sindrom.
|
Klasični koagulogram. Biopsija koštane srži (hemofagocitoza).
|
U diferencijalnoj dijagnozi trombocitopenije kod kritično oboljelih osoba bitan je i podatak o pridruženim trombotskim incidentima, kao i o težini trombocitopenije. Izrazito tešku trombocitopeniju (< 20 x 109/L) kod ovih bolesnika mogu uzrokovati: 1) teška afunkcija koštane srži (agresivna hematološka bolest, stanje nakon kemoterapije), 2) težak oblik diseminirane intravaskularne koagulopatije, 3) trombocitopenija posredovana antitijelima (autoimuna trombocitopenična purpura, poslijetransfuzijska purpura, trombocitopenija izazvana lijekovima, uključujući i HIT) te 4) hemofagocitni sindrom ili sindrom prekomjerne aktivacije makrofaga. Pojava tromboze kod bolesnika s trombocitopenijom može se javiti kod bolesnika s trombocitopenijom induciranom heparinom, diseminiranom intravaskularnom koagulopatijom te antifosfolipidnim sindromom.
Liječenje. Osnovu liječenja čini liječenje bolesti u podlozi. Korekcija trombocitopenije postiže se primjenom koncentrata trombocita. Oni se mogu primjenjivati profilaktički, terapijski i periproceduralno.
Profilaktička primjena koncentrata trombocita kod bolesnika koji ne krvare preporuča se kada se njihova vrijednosti spusti ispod 5 do 10 x 109/L. Primjenom jednog pool-a trombocita očekuje se njihov porast za 10 do 15 x 109/L.
Terapijska primjena koncentrata trombocita kod bolesnika s aktivnim krvarenjem primjenjuje se kada njihov broj padne ispod 50 x 109/L. Ako se radi o krvarenju i potrebi za primjenom masivne transfuzije, vodimo se načelom 1:2:1, što znači da se na jednu dozu eritrocita primjenjuju dvije doze svježe smrznute plazme i jedna doza trombocita. Kod bolesnika s intrakranijskim krvarenjem potrebno je osigurati broj trombocita iznad 100 x 109/L.
Periproceduralna primjena koncentrata trombocita. Kako bi se smanjio rizik od mogućega krvarenja tijekom invazivnih procedura, potrebno je osigurati odgovarajući broj trombocita. U Tablici 3.21. navedeni su zahvati i preporučene vrijednosti trombocita koje treba osigurati prije samoga zahvata.
|
Tablica 3.21. Periproceduralna primjena koncentrata trombocita
|
|
Zahvat, intervencija
|
Broj trombocita
|
|
Centralni venski kateter
|
20 x 109/L
|
|
Torakocenteza
|
50 x 109/L
|
|
Bronhoskopija s lavažom
|
20 x 109/L
|
|
Paracenteza
|
Nije nužna rutinska nadoknada
|
|
Biopsija koštane srži
|
Nije nužna rutinska nadoknada
|
|
Elektivna lumbalna punkcija
|
50 x 109/L
|
|
Hitna lumbalna punkcija
|
20 x 109/L
|
|
Kirurški zahvati (osim neurokirurških)
|
50 x 109/L
|
|
Neurokirurški zahvati
|
10 x 109/L
|
POSEBNI OBLICI TROMBOCITOPENIJE KOD KRITIČNO OBOLJELIH BOLESNIKA
Sepsom inducirana trombocitopenija jedna je od najčešćih trombocitopenija bolesnika u jedinici intenzivnoga liječenja. Može biti uzrokovana različitim mehanizmima koje susrećemo kod septičkih bolesnika: aktivacija i potrošnja trombocita inducirana trombinom, deplecija ADAMTS13 proteina, prekomjerna aktivacija makrofaga (hemofagocitoza), otpuštanje histona te aktivacija komplementa. Klinički, ovaj oblik trombocitopenije može proći asimptomatski ili se može prezentirati hemoragijskom dijatezom ili aktivnim krvarenjem. Pri dijagnostičkom postupku najbitnije je isključiti druge oblike trombocitopenije (koagulogram). Liječenje se provodi primjenom odgovarajućih antibiotika, klasičnim potpornim mjerama liječenja i, prema potrebi, transfuzijama trombocita prema opisanim načelima.
Trombotička trombocitopenična purpura (TTP) (Morbus Moschowitz) predstavlja multisistemsku bolest koju u punoj kliničkoj slici karakterizira pentada simptoma koja uključuje trombocitopeniju, mikroangiopatsku hemolitičku anemiju, febrilno stanje, neurološke manifestacije te akutno bubrežno oštećenje. Radi se o rijetkoj, ali potencijalno po život opasnoj bolesti ako ju se ne prepozna na vrijeme i ne započne s liječenjem. Incidencija bolesti iznosi 3,7 oboljelih na 100 000 stanovnika, a najčešće vrijeme manifestacije je treće i četvrto desetljeće života.
Etiopatogeneza. Glavno patofiziološko zbivanje kod takvih bolesnika izostanak je cijepanja ultravelikih multimera von Willenbrandova faktora (ULVWF) koji se normalno otpuštaju iz endotelnih stanica uslijed njegove aktivacije i vaskularnoga oštećenja, a u takvome obliku (nerazgrađeni) dovode do aktivacije i agregacije trombocita (potrošna trombocitopenija) te mikroangiopatske hemolitičke anemije. Izostanak odgovarajućega cijepanja ULVWF-a nastaje uslijed deficita ADAMTS13 metaloproteinaze koja posreduje navedeno cijepanje, što se može javiti kao kongenitalni ili stečeni poremećaj (idiopatsko stvaranje IgG autoantitijela na molekulu ADAMTS13). Navedene se promjene u najvećem broju slučajeva odvijaju u mikrovaskulaturi mozga i bubrega uslijed čega dolazi do ishemijske encefalopatije i akutnoga bubrežnog oštećenja, iako se promjene mogu odvijati i na drugim mjestima (srce, jetra, probavna cijev i sl.).
Klinička slika. Navedena pentada simptoma ne mora biti prisutna kod svih bolesnika što dodatno može otežati postavljanje dijagnoze poremećaja. Osim zahvaćanja središnjega živčanog sustava - što se može očitovati poremećajem stanja svijesti, konvulzijama i žarišnim deficitima, te bubrega - što se očituje oligoanurijom, hematurijom i bolovima u slabinama, bolest može zahvatiti i druge organe, osobito koronarne arterije - što se prezentira akutnom ishemijom miokarda (a to je i najčešći uzrok smrti takvih bolesnika), i mikrovaskulaturu visceralnih organa (akutni abdomen).
Dijagnoza. Sumnja na TTP temelji se na kliničkoj slici (febrilno stanje, neurološke manifestacije, oligoanurija) i laboratorijskim nalazima u kojima dominiraju trombocitopenija (vrijednost trombocita se obično kreće između 10 i 30 x 109/L) i mikroangiopatska hemolitička anemija (snižene vrijednosti hemoglobina, snižene vrijednosti haptoglobina, retikulocitoza, povećane vrijednosti laktat dehidrogenaze te hiperbilirubinemija) uz uredan koagulogram. Posljedično akutnom bubrežnom oštećenju dolazi do porasta ureje i kreatinina, a ovisno o njegovoj težini, i do metaboličke acidoze i/ili hiperkalijemije. Promjene na središnjem živčanom sustavu dokazuju se CT-om ili MR-om mozga. Konačna potvrda bolesti dokazuje se dokazom nedostatka ili smanjene aktivnosti ADAMTS13 proteina (< 5 %) i/ili potvrdom prisutnosti inhibitora ili antitijela IgG klase na ADAMTS13 (navedeno testiranje ne radi se rutinski u svim laboratorijima).
Liječenje. Osnovu liječenja čini terapijska plazmafereza koja omogućava uklanjanje antitijela na ADAMTS13, kao i kompleksa antitijelo-ADAMTS13. Taj je postupak stopu smrtnosti s 90 % smanjio na 10 %. Postupak je potrebno započeti što ranije, obično po shemi izmjene 1,5 volumena plazme kroz tri dana, a potom se nastavlja s izmjenom jednostrukoga volumena plazme do potpune remisije, odnosno oporavka broja trombocita (nakon postizanja remisije preporuča se još dva dana provođenja plazmafereze). Osim plazmafereze, indicirana je i primjena kortikosteroida (metilprednizolon), a u rezistentnim slučajevima indicirano je i liječenje rituksimabom (monoklonalno antitijelo usmjereno na CD20), a moguća je i primjena kaplacizumaba koji inhibira interakciju između ULVWF-a i trombocita. Primjena transfuzije trombocita kontraindicirana je kod ovih bolesnika (povećava rizik od trombotskih incidenata).
Autoimuna trombocitopenična purpura (ITP) predstavlja autoimuno oboljenje karakterizirano stvaranjem autoantitijela na trombocite, zbog čega se oni pojačano uklanjaju stanicama retikuloendotelnoga sustava i razvija se izolirana trombocitopenija. Bolest se javlja s učestalošću od 8 oboljelih na 100 000 stanovnika, češće žena. Najčešće se radi o idiopatskome oboljenju, a može se naći i sekundarno u sklopu različitih oboljenja (sistemski eritematozni lupus, hematološki malignomi, HIV-infekcija). Klinički se najčešće prezentira kao asimptomatski patološki laboratorijski nalaz, a može biti povezana i sa znacima hemoragijske dijateze ili aktivnim krvarenjem (rijetko). Dijagnoza se postavlja na temelju nalaza izolirane trombocitopenije i urednoga koagulograma te potvrđuje nalazom antitrombocitnih antitijela. Liječenje u uvjetima intenzivne skrbi podrazumijeva primjenu kortikosteroida (prednizon 1 mg/kg), a u slučaju slaboga odgovora ili obilnoga krvarenja, u obzir dolazi i primjena intravenskih imunoglobulina i visokih doza metilprednizolona. U uvjetima dugoročnoga liječenja u obzir dolazi splenektomija te imunosupresivno liječenje (ciklofofamid, azatiprin, rituksimab).
Hemolitičko uremični sindrom (HUS) naziv je za trombotičnu mikroangiopatiju koju, slično kao i TTP, karakterizira intravaskularna tromboza, potrošna trombocitopenija te mikroangiopatska hemolitička anemija. Za razliku od TTP-a, zahvaćenost mozga kod ovih bolesnika izuzetno je rijeka, a intravaskularna tromboza biva potaknuta raznim bakterijskim toksinima ili lijekovima uz očuvanu aktivnost ADMTS13. Klasično razlikujemo dva tipa ovoga sindroma: tipični i atipični HUS. Tipični HUS (90 %) obično nastaje kod djece nakon gastrointestinalne infekcije (E. colli, Shigella dysenteriae), potaknuta bakterijskim toksinima, dok atipični HUS (10 %) obično pogađa odrasle, a najčešće se razvija nakon respiratornih infekcija (S. pneumoniae) te nakon uzimanja nekih lijekova (oralni kontraceptivi, ciklosporin). Kliničkom slikom dominira akutna bubrežna ozljeda uz trombocitopeniju i hemolitičku anemiju te, ovisno o zahvaćenosti, i simptomi i znakovi na drugim organima. Dijagnoza se postavlja na temelju anamnestičkih podataka te kliničkih i laboratorijskih nalaza (koji uključuju i specifične imunološke pretrage. Osnovnu liječenja čini plazmafereza. Više o etiopatogenezi, kliničkoj slici, dijagnozi i liječenju HUS-a navedeno je u poglavlju o hematologiji.
Heparinom inducirana trombocitopenija (HIT) komplikacija je koja se javlja kod oko 5 % bolesnika liječenih klasičnim, nefrakcioniranim heparinom i kod manje od 1 % bolesnika liječenih niskomolekularnim heparinom, i to najčešće u vremenskom periodu od petoga do desetog dana nakon početka terapije. Ovisno o mehanizmu nastanka, razlikujemo dva oblika HIT-a: tip I (neimuni HIT) i tip II (imuni HIT). Neimuni HIT nastaje uslijed izravne interakcije heparina s površinom trombocita, što dovodi do aktivacije i agregacije trombocita, dok je imuni HIT imunološki posredovana bolest koju karakterizira nastanak autoantitijela usmjerenih na antigeni kompleks heparina i trombocitnoga faktora 4 (PF4), pri čemu se formira kompleks - kojega čine heparin, PF4 te autoantitijelo, koji je odgovaran za aktivaciju i agregaciju trombocita (potrošna trombocitopenija). Glavne kliničko-laboratorijske razlike između ta dva tipa bolesti prikazane su u Tablici 3.22. Aktivirani trombociti dovode do stvaranja trombocitnih čepova, a dolazi i do aktivacije endotelnih stanica, ekspresije tkivnoga faktora i posljedične aktivacije koagulacijske kaskade, što rezultira trombozom malih krvnih žila i tkivom ishemijom. Glavni dijagnostički kriteriji za HIT su: 1) bolesnik prima heparinsku terapiju ili ju je nedavno primao, 2) prisutnost trombocitopenije s ili bez tromboze te 3) laboratorijski dokazana HIT protutijela. Kod postavljanja sumnje na HIT potrebno je obustaviti primjenu heparina i zamijeniti ga drugim parenteralnim antikoagulantnim lijekom iz druge skupine (npr. fondaprinuks), a kako su spontana krvarenja kod HIT-a rijetka, a transfuzije trombocita mogu povećati rizik od trombotskih incidenata, one se mogu primjenjivati samo u slučaju životne ugroženosti zbog krvarenja.
|
Tablica 3.22. Karakteristike HIT-a
|
|
Karakteristike
|
HIT tip I
|
HIT tip II
|
|
Uzrok
|
Izravan kontakt s heparinom
|
Prisutnost autoantitijela
|
|
Incidencija
|
5 do 30 %
|
1 do 3 %
|
|
Vremensko pojavljivanje
|
Unutar četiri dana
|
Unutar pet do deset dana
|
|
Komplikacije
|
Nema
|
Trombotski incidenti
|
|
Oporavak
|
1 do 3 dana
|
5 do 7 dana
|
DISEMINIRANA INTRAVASKULARNA KOAGULOPATIJA
Definicija i etiologija. Diseminirana intravaskularna koagulopatija (DIK) nastaje kao posljedica nekontrolirane lokalne ili sistemske aktivacije koagulacijskoga sustava što rezultira potrošnjom faktora zgrušavanja, fibrinogena te trombocita. Brojne su bolesti i stanja koja se povezuju s nastankom DIK-a (stanja koja uvjetuju nastanak SIRS-a), a najčešće su to sepsa - kod koje se koagulacijski sustav aktivira djelovanjem bakterijskih produkata (lipopolisahardi), te traume, opekline, maligna oboljenja i opstetričke komplikacije kod kojih se koagulacijski sustav aktivira otpuštanjem i ekspresijom tkivnoga faktora. Kao posljedica pojačane aktivacije koagulacijskoga sustava, u prvoj fazi bolesti dolazi do nastanka tromboza u malim krvnim žilama što dovodi do tkivne ishemije, dok s razvojem bolesti i potrošnjom trombocita i koagulacijskih faktora bolesnici ulaze u drugu fazu bolesti u kojoj razvijaju hemoragijsku dijatezu i aktivna krvarenja.
Klinička slika i dijagnoza. U kliničkoj slici bolesnika s diseminiranom intravskularnom koagulopatijom nalazimo simptome i znakove osnovne bolesti, tj. bolesti u podlozi na koju se nadovezuju simptomi ishemijskih poremećaja u prvoj fazi bolesti te hemoragijskih manifestacija u drugoj fazi bolesti. Ishemijske promjene mogu zahvatiti praktički sve organe i tkiva, a najčešće su to mozak, srce, pluća, bubrezi i koža s pratećim kliničkim znacima (neurološki deficiti, stenokardija, dispneja, oligoanurija i sl.). U drugoj fazi bolesti obično najprije nalazimo spontana ili malim traumama izazvana krvarenja kože (petehije, ekhimoze, hematomi), ali se kasnije mogu razviti ozbiljna krvarenja (hematemeza, hemoptize, hematurija i sl.). Dijagnoza se postavlja na temelju kliničkoga te laboratorijskih nalaza. Temeljni laboratorijski nalazi u DIK-u su: trombocitopenija, produljeno protrombinsko vrijeme, produljeno aktivirano parcijalno tromboplastinsko vrijeme, snižene vrijednosti fibrinogena, snižene vrijednosti antitrombina III te povišene vrijednosti D-dimera. Često je prisutna i mikroangiopatska hemolitička anemija.
Liječenje podrazumijeva agresivno liječenje osnovne bolesti, odnosno bolesti u podlozi DIK-a, te susptituciju koagulacijskih faktora i trombocita. Transfuzije trombocita primjenjuju se s ciljem postizanja vrijednosti od 20 x 109/L odnosno 50 x 109/L za bolesnike s aktivnim krvarenjem. Primjenom jednoga pool-a trombocita, njihova se vrijednost podiže za 10 do 15 x 109/L. Vrijednosti fibribogena treba održavati većima od 0,8 do 1 g/L, što se osigurava primjenom krioprecipitata koji sadrži, osim fibrinogena, i faktore koagulacije VIII i XIII, ili primjenom koncentrata fibrinogena koji sadržava samo fibrinogen. Produljene vrijednosti PV-a i aPTV-a korigiraju se primjenom svježe smrznute plazme u kojoj nalazimo faktore zgrušavanja i vanjskoga i unutarnjeg puta. Ciljne vrijednosti PV-a i aPTV-a su do najviše 1,5 puta više od normalnoga raspona. Ako je vrijednost hemoglobina niža od 80 g/L, primjenjuje se i transfuzija koncentriranih eritrocita. Također, kod niskih vrijednosti antitrombina III primjenjuje se koncentrat antitrombina III. U slučaju perzistentnoga krvarenja, unatoč supstituciji, u terapiju se može uključiti kontinuirana infuzija klasičnoga heparina u dozi od 5 - 10 ij/kg/sat. Također, kod jakoga je krvarenja moguća i primjena antifibrinolitika kakva je traneksamična kiselina. Broj trombocita i koagulogram treba ponavljati svakih 4 do 6 sati, odnosno nakon završenoga davanja predviđenih krvnih preparata na temelju čega se i predviđa daljnja terapija.
ADRENALNA I TIREOIDNA DISFUNKCIJA U JEDINICI INTENZIVNOGA LIJEČENJA
Poremećaji štitne i nadbubrežne žlijezde koji mogu zahtijevati liječenje u jedinici intenzivnoga liječenja su akutna insuficijencija adrenokorteksa, tireotoksikoza i miksedem. Osim toga, kod kritično oboljelih bolesnika često nalazimo i pokazatelje sekundarne disfunkcije štitne i nadbubrežne žlijezde u vezi s osnovnim, kritičnim oboljenjem (npr. sepsa).
INSUFICIJENCIJA KORE NADUBREŽNE ŽLIJEZDE
Uvod. Nadbubrežna žlijezda ima značajnu ulogu u odgovoru organizma na stres. Kora nadbubrežne žlijezde luči glukokortikoide i mineralokortikoide koji utječu na dostupnost glukoze i održavanje izvanstaničnoga volumena, dok srž nadbubrežne žlijezde luči katekolamine koji potpomažu cirkulaciju. Smanjena ili potpuna afunkcija nadbubrežne žlijezde vodi prema hemodinamskoj nestabilnosti, volumnoj depleciji te poremećenom energetskom metabolizmu stanice. Adrenalna insuficijencija često ostaje neprepoznata i neprimijećena sve dok ne nastupi stres i potreba za pojačanom funkcijom adrenokorteksa. Tada može doći do napredovanja toga stanja što može dovesti bolesnika u teško, po život opasno stanje. Aktivnost nadbubrežne žlijezde u prvome redu ovisi o lučenju adrenokortikotropnoga hormona (ACTH) iz prednjega režnja hipofize (adenohipofiza) što je potaknuto stvaranjem i otpuštanjem adrenokortikotropnoga otpuštajućeg hormona (CRH) iz hipotalamusa. Prema tome, adrenalna insuficijencija može biti posljedica supresije na razini hipotalamus-hipofiza (sekundarna i tercijarna adrenokortikalna insuficijencija) ili supresije na razini same nadbubrežne žlijezde (primarna adrenokortikalna insuficijencija).
Kortizol (hidrokortizon) je glavni glukokortikoid koji stvara kora nadbubrežne žlijezde. U normalnim okolnostima količina dnevno stvorenoga kortizola za odrasle iznosi 15 do 25 mg/dan, a može rasti do 350 mg/dan u stanjima fiziološkoga stresa. Oko 90 % kortizola u plazmi vezano je na protein koji veže kortikosteroid (CBG, od engl. corticosteroid-binding globulin) te plazmatske albumine, dok se samo 10 % nalazi u nevezanom obliku kao slobodni kortizol koji je ujedno i biološki aktivan oblik hormona. Komercijalni testovi za određivanje plazmatskoga kortizola obično omogućavaju samo mjerenje slobodnoga i ukupnog kortizola. Kod tumačenja tih nalaza treba imati na umu da se kod akutno bolesnih osoba mogu naći smanjene vrijednosti proteina koji veže kortikosteroid (CBG) i do 50 % u odnosu na normalne vrijednosti, što povisuje koncentraciju slobodnoga kortizola.
Definicija, epidemiologija i patofiziologija. Adrenalna insuficijencija česta je pojava kod kritično oboljelih bolesnika. Ukupna prevalencija iznosi 10 do 20 %, s time da raste i do 60 % kod bolesnika sa sepsom i septičkim šokom. Adrenalna insuficijencija kod ovih bolesnika često je reverzibilna te se ovo stanje naziva kortikosteroidna insuficijencija udružena s kritičnim oboljenjem (CIRCI, od engl. critical illness-related corticosteroid insufficiency). Mehanizmi uključeni u nastanak CIRCI-a su kompleksni, a glavnu ulogu ima sistemski upalni odgovor (SIRS). Supresija hipotalamičko-hipofizne osi odgovorna je za više od 75 % svih uzroka adrenalne insuficijencije kod bolesnika s teškom sepsom i septičkim šokom (supresija je obično posredovana proupalnim citokinima, ali može biti uzrokovana i egzogenim steroidima).
Predisponirajući čimbenici. Sepsa i septički šok vodeći su uzroci adrenalne insuficijencije kod kritično oboljelih bolesnika. Ostale infekcije koje se često povezuju s tim stanjem su HIV-infekcija, sistemska gljivična infekcija te meningokokcemija. Neinfektivni uzroci adrenalne insuficijencije uključuju nagao prekid kronične steroidne terapije, adrenalnu hemoragiju uslijed diseminirane intravaskularne koagulopatije ili antikoagulantne terapije te lijekove koji mogu inhibirati sintezu kortizola (etomidat, ketokonazol) ili ubrzati metabolizam kortizola (fenitoin, rimfampicin).
Kliničke manifestacije. Glavna manifestacija adrenalne insuficijencije kod kritično oboljelih bolesnika je hipotenzija koja ne odgovara na volumnu resuscitaciju. Uz to nalazimo i tipičan elektrolitni poremećaj koji uključuje hiponatrijemiju i hiperkalijemiju.
Dijagnoza. Na adrenalnu insuficijenciju treba pomišljati kod svih kritično oboljelih bolesnika s hipotenzijom koju se ne može korigirati odgovarajućom volumnom resuscitacijom te tipičnim elektrolitnim disbalansom. Pri sumnji na adrenalnu insuficijenciju prvi je korak dijagnostičke evaluacije određivanje ukupnoga kortizola (tzv. random uzorak). Vrijednosti kortizola dobivene takvim uzorkovanjem više od 35 g/dl ukazuju na normalnu i zadovoljavajuću funkciju nadbubrežne žlijezde, dok vrijednosti niže od 10 g/dl ukazuju na jasnu insuficijenciju nadbubrežne žlijezde. Kod dobivenih vrijednosti između 10 i 35 g/dl preporuča se učiniti brzi ACTH stimulacijski test.
Brzi ACTH stimulacijski test. Ovaj test jedan je od najčešće primjenjivanih testova za dokazivanje insuficijencije adrenokorteksa u jedinicama intenzivnoga liječenja. Može se provoditi u bilo koje doba dana ili noći. Bolesniku se najprije izvadi krv iz koje se dobivaju vrijednosti ukupnoga kortizola prije testiranja, a potom mu se daje sintetički adrenokortikotropni hormon u dozi od 250 g. Nakon sat vremena ponovno se vrši uzorkovanje krvi te mjeri vrijednost ukupnoga kortizola. Ako dođe do porasta vrijednosti ukupnoga kortizola za više od 9 g/dl, test se smatra negativnim, dok porast manji od 9 g/dl označava test pozitivnim, odnosno potvrđuje dijagnozu adrenalne insuficijencije. Ipak, normalan odgovor bolesnika na primijenjeni ACTH (povećanje serumskoga kortizola za više od 9 g/dl) ne isključuje mogućnost sekundarne adrenokortikalne insuficijencije (hipotalamo-hipofizna disfunkcija).
Kortizol i septički šok. Kod bolesnika sa septičkim šokom vrijednosti ukupnoga kortizola u plazmi nisu neophodne za identifikaciju bolesnika koji bi mogao imati potencijalnu korist od primjene kortikosteroida. Kod takvih bolesnika kod kojih postoji hipotenzija refrakterna na odgovarajuću volumnu resuscitaciju svakako se preporuča intravenska primjena hidrokortizona.
Liječenje. Liječenje se sastoji od intravenske primjene hidrokortizona u dozi od 200 do 300 mg/dan (50 mg svakih šest sati ili 100 mg svakih osam sati). Dodavanje mineralokortikoida (npr. fludrokortizon 50 g/dan per os) je opcionalno s obzirom na to da hidrokortizon također ima mineralokortikoidne aktivnosti. Hidrokortizon se ukida nakon stabilizacije uzročnoga stanja koje je dovelo do razvoja adrenalne supresije. Pri septičkom šoku hidrokortizon se može ukinuti kada više nema potrebe za terapijom vazopresorima te po normalizaciji vrijednosti serumskih laktata. Preporuča se postupno snižavanje doze hidrokortizona (tijekom nekoliko dana) kako bi se prevenirao „rebound“ fenomen. Terapijska učinkovitost kortikosteroida prikazana je u Tablici 3.23.
|
Tablica 3.23. Terapijska učinkovitost kortikosteroida
|
|
Kortikosteroid
|
Ekvivalentna doza
|
Protuupalni učinak
|
Mineralokortikoidni učinak
|
|
Hidrokortizon
|
20 mg
|
+
|
++++
|
|
Prednizon
|
5 mg
|
++
|
+++
|
|
Metilprednizon
|
4 mg
|
+++
|
++
|
|
Deksametason
|
0,75 mg
|
++++
|
+
|
PROCJENA TIREOIDNE FUNKCIJE
Laboratorijski testovi tireoidne funkcije mogu biti abnormalni kod gotovo 90 % kritično oboljelih bolesnika. U većini su slučajeva oni posljedica netireoidne bolesti i nisu znak patološkoga poremećaja štitne žlijezde.
Tiroksin (T4) i trijodtironin (T3). Tiroksin je glavni hormon kojega luči štitna žlijezda, ali je glavni i aktivni oblik trijodtironin koji nastaje dejodinacijom tiroksina u perifernim tkivima. Oba hormona, i T3 i T4, imaju izraženu sklonost vezivanju (> 99 %) za proteine plazme, osobito za tzv. globulin koji veže tiroksin i samo je manje od 1 % hormona prisutno u nevezanom, slobodnom obliku koji je biološki aktivan oblik. S obzirom na potencijalne promjene u vrijednostima plazmatskih proteina u akutnim oboljenjima, mjerenje slobodnoga T4 (fT4) i T3 (fT3) pouzdanije je u procjeni tireoidne funkcije kod kritično oboljelih bolesnika. S obzirom na to da fT3 često nije moguće rutinski analizirati, najpouzdaniji pokazatelj tireoidne funkcije je fT4.
Tireoidni stimulirajući hormon (TSH). Plazmatske vrijednosti TSH-a bitne su za određivanje tireoidne funkcije te za identifikaciju poremećaja vrijednosti tireoidnih hormona bez prisutnosti tireoidne bolesti, kao i za diferenciranje primarne i sekundarne etiologije tireoidne bolesti. Plazmatske vrijednosti TSH-a pokazuju dnevne varijacije - najniže vrijednosti imaju kasno poslijepodne, dok se najviše vrijednosti bilježe jedan sat nakon spavanja. Vrijednosti TSH-a mogu imati velike dnevne varijacije (i do 40 %) što treba imati na umu kod interpretacije nalaza. Referentne vrijednosti iznose 0,3 - 4,5 mU/dL..
Razlikovanje primarnoga i sekundarnoga tireoidnog poremećaja. Zbog mehanizma negativne povratne sprege tireoidnih hormona na sekreciju TSH-a, plazmatske vrijednosti TSH-a mogu pomoći u razlikovanju primarnoga od sekundarnog poremećaja štitne žlijezde. Kod bolesnika s hipotireozom povišena vrijednost TSH-a ukazuje na primarni poremećaj (očuvan rad hipofize, poremećaj na razini same štitne žlijezde), dok snižena vrijednost TSH-a sugerira sekundarni poremećaj (disfunkcija hipotalamičko-hipofizne osi).
Netireoidni poremećaji. Plazmatske vrijednosti TSH-a normalne su u većini slučajeva kada su poremećaji tireoidnih hormona uzrokovani netireoidnom bolesti, rijetko može biti snižen (30 %), još rjeđe povišen (10 %). Izlučivanje TSH-a može biti suprimirano u stanjima sepse, egzogeno unesenih kortikosteroida te kod primjene dopamina, što treba uzeti u obzir kod interpretacije nalaza TSH-a. Akutne netireoidne bolesti povezane su s niskim vrijednostima fT3 kao posljedice poremećene konverzije T4 u T3 u perifernim tkivima. S pogoršanjem težine bolesti dolazi do smanjenja oba hormona (fT3 i fT4), što može biti prisutno kod 30 do 50 % bolesnika u intenzivnim jedinicama. Kod većine su tih bolesnika vrijednosti TSH-a normalne, ali treba imati na umu stanja koja mogu suprimirati izlučivanje TSH-a (sepsa, kortikosteroidi, dopamin).
Tireoidni poremećaji. Primarni poremećaj štitne žlijezde karakteriziraju recipročne promjene u vrijednostima fT4 i TSH-a (snižen fT4, povišen TSH), dok kod sekundarnoga poremećaja štitne žlijezde nalazimo promjene u vrijednostima fT4 i TSH-a u istome smjeru (snižene vrijednosti i fT4 i TSH-a). Interpretacija nalaza fT4 i TSH prikazana je u Tablici 3.24.
|
Tablica 3.24. Interpretacija nalaza fT4 i TSH-a
|
|
Poremećaj
|
fT4
|
TSH
|
|
Normalna vrijednost
|
0,8- 1 ,8 ng/dL
|
0,35 - 4,5 mU/ml
|
|
Netireoidna bolest
|
↓
|
Uredno ili ↓
|
|
Primarna hipotireoza
|
↓
|
↑
|
|
Sekundarna hipotireoza
|
↓
|
↓
|
|
Primarna hipertireoza
|
↑
|
↓
|
TIREOTOKSIKOZA
Tireotoksikoza je gotovo uvijek rezultat primarne hipertireoze. Među glavnim su njezinim uzrocima autoimuni tireoiditis te kronična terapija amiodaronom.
Kliničke manifestacije. Glavne značajke tireotoksikoze su uznemirenost, tahiaritmije te fini tremor. Starije osobe s hipertireozom češće su lošijega raspoloženja i letargične nego što su uznemirene, te se takvo stanje naziva apatična tireotoksikoza i često je udružena s pojavom fibrilacije atrija.
Tireoidna oluja. Tireoidna oluja naziv je za posebno težak klinički oblik hipertireoze koji može biti precipitiran akutnim oboljenjem ili kirurškim zahvatom. Stanje je praćeno hiperpireksijom, teškom agitacijom ili delirijem, tahikardijom te „high-output“ srčanim popuštanjem (srčano popuštanje s povišenim udarnim volumenom). Stanje može prerasti u komu, generalizirane epileptičke napadaje te dovesti do hemodinamske nestabilnosti, što može završiti i smrtnim ishodom.
Dijagnoza. Određivanje vrijednosti TSH-a predstavlja najosjetljiviji i najspecifičniji dijagnostički test za hipertireozu te se preporuča kao inicijalni test probira pri sumnji na hipertireozu. U tome slučaju vrijednosti TSH-a su snižene: manje od 0,01 mU/dL u srednje teškim oblicima i nemjerljivo niske u teškim oblicima. Normalna vrijednost TSH-a isključuje dijagnozu hipertireoze. Vrijednosti fT3 i fT4 su povišene.
Liječenje. U liječenju hipertireoze koriste se antagonisti beta receptora, antitireoidni lijekovi te jod. Liječenje tireotoksične oluje mora biti vođeno u jedinicama intenzivnoga liječenja.
Antagonisti beta receptora. Primjena ovih lijekova dovodi do smirivanja tahikardije, agitacije i tremora. Propranolol je najčešće korišten beta blokator u liječenju hipertireoze, no on nije selektivan te nije pogodan za liječenje bolesnika s astmom. Selektivniji beta blokatori, kao što su metoprolol ili esmolol, također mogu biti korisni. Propranolol je lijek izbora u liječenju simptoma tireoidne oluje.
Antitireoidni lijekovi. Dva se lijeka koriste u svrhu suzbijanja proizvodnje tiroksina: metimazol i propiltiouracil, a oba se daju peroralno. Metimazol se preferira u liječenju tireotoksikoze, dok se propiltiouracil preferira u liječenju tireoidne oluje. Rijetke, ali ozbiljne nuspojave koje se mogu razviti su kolestatski ikterus kod primjene metimazola te fulminantna hepatalna nekroza i agranulocitoza kod primjene propiltiouracila.
Jod. U teškim slučajevima hipertireoze jod se može dodati antitireoidnim lijekovima (blokira sintezu i otpuštanje T4). Lijek dolazi u obliku Lugolove otopine koja predstavlja saturiranu otopinu joda i kalija. Kod bolesnika alergičnih na jod moguća je primjena litija (300 mg peroralno svakih osam sati).
Dodatne mjere liječenja tireoidne oluje. Liječenje tireoidne oluje zahtijeva agresivnu volumnu resuscitaciju kako bi se nadoknadio gubitak tekućine povraćanjem, proljevom te znojenjem. Tireoidna oluja može ubrzati metabolizam glukokortikoida i dovesti do relativne adrenalne insuficijencije, pa je preporučena profilaktična terapija hidrokortizonom (300 mg intravenski bolusno kao doza zasićenja koju slijedi intravenska doza od 100 mg svakih osam sati).
HIPOTIREOIDIZAM I MIKSEDEM
Hipotireoidizam je kliničko stanje koje nastaje uslijed smanjene funkcije štitne žlijezde, a najčešće je uzrokovano kroničnim autoimunim tireoiditisom (Hashimotov tireoiditis). Najteži klinički oblici hipotireoidizma su miksedem i miksedemska koma.
Kliničke manifestacije uključuju suhoću kože, umor, mišićne grčeve, konstipaciju i poremećaj koncentracije te kognitivne smetnje. U najtežim oblicima razvijaju se efuzije i miksedem. Efuzije (izljevi u tjelesne šupljine) nastaju kao posljedica povećane kapilarne propusnosti i posljedične transudacije (pleuralni izljevi, perikardijalni izljev, ascites). Uslijed povećane kapilarne propusnosti dolazi i do intradermalne akumulacije proteina i vode, što se naziva miksedemom. U najtežim slučajevima bolesnici postaju soporozni i komatozni s izraženim edemom cijeloga tijela te brojnim izljevima (miksedemska koma).
Dijagnoza se postavlja na osnovi laboratorijskih nalaza. Vrijednosti fT3 mogu biti uredne, dok su vrijednosti fT4 redovno snižene. TSH je povišen kod primarnoga poremećaja štitne žlijezde, dok je snižen kod sekundarnoga i tercijarnog oblika poremećaja.
Liječenje blagoga do umjerenog poremećaja temelji se na primjeni levotiroksina koji se daje peroralno u dozi od 50 do 200 mcg/dan. Inicijalna doza je 50 mcg/dan i može se povisivati za 25 do 50 mcg svaka dva do tri tjedna. Pri teškim oblicima može se davati i intravenski pripravak tiroksina (prvi dan 350 mcg, drugi dan 100 mcg, od trećega pa nadalje 50 mcg).
POREMEĆAJI ACIDOBAZNE RAVNOTEŽE
Uvod. Poremećaji acidobazne ravnoteže podrazumijevaju promjene koncentracije vodikovih iona koje dovode do poremećaja pH vrijednosti izvanstanične i unutarstanične tekućine što može imati negativan utjecaj na fiziološke homeostatske mehanizme, s obzirom na to da je većina enzima i enzimatskih sustava optimalno djelotvorna pri pH vrijednostima između 7,35 i 7,45. Dakle, otklon pH vrijednosti prema vrijednostima nižima od 7,35 (acidoza) ili višima od 7,45 (alkaloza) dovodi do teških metaboličkih i homeostatskih mehanizama koji u konačnici mogu završiti smrtnim ishodom, zbog čega se poremećaji acidobazne ravnoteže smatraju hitnim stanjima u internoj medicini. U nastavku će biti opisani osnovni koncepti acidobazne ravnoteže te njezini glavni poremećaji.
FIZIOLOGIJA I OSNOVNI POJMOVI ACIDOBAZNE RAVNOTEŽE
Homeostaza vodikovih iona i pH vrijednost. Normalna koncentracija vodikovih iona u organizmu izrazito je niska i iznosi oko 40 nmol/L (4 x 10-9 mol/L) pa se zbog lakšega izražavanja tih vrijednosti u kliničkoj praksi njihova koncentracija izražava kao pH vrijednost. pH vrijednost predstavlja negativan logaritam koncentracije vodikovih iona, zbog čega je vrijednost pH obrnuto razmjerna koncentraciji vodikovih iona (odnos između pH vrijednosti i koncentracije vodikovih iona prikazan je u Tablici 3.25.). Pri tumačenju vrijednosti acidobazne ravnoteže koristi se uzorak arterijske krvi u kojoj normalna pH vrijednosti iznosi 7,35 do 7,45, pri čemu se vrijednosti koncentracije vodikovih iona kreću između 36 i 44 nmol/L. Svako povećanje koncentracije vodikovih iona dovodi do snižavanja vrijednosti pH i razvoja acidoze, što znači da krv postaje kiselija, dok svako smanjenje koncentracije vodikovih iona dovodi do povećanja vrijednosti pH i razvoja alkaloze, odnosno krv postaje lužnatija. Na koncentraciju vodikovih iona u organizmu utječe količina kiselina koje se unesu u organizam hranom (obično je to između 70 i 100 nmol/L) te količina kiselina koje nastaju u organizmu pri različitim biokemijskim procesima. S obzirom na to da, kako je već navedeno, većina enzima i enzimatskih sustava može djelovati u uvjetima uskoga raspona pH vrijednosti (7,35 - 7,45), organizam posjeduje različite mehanizme kojima nastoji neutralizirati svaki otklon od tih vrijednosti, pri čemu najznačajniju ulogu imaju kemijski puferski sustavi - pluća i bubrezi. Najznačajniji je kemijski puferski sustav u kliničkoj praksi hidrogenkarbonatni sustav.
|
Tablica 3.25. Korelacije između vrijednosti pH i koncentracije vodikovih iona
|
|
pH
|
[H+] nmol/L
|
|
6,9
|
126
|
|
7,0
|
100
|
|
7,1
|
79
|
|
7,2
|
63
|
|
7,3
|
50
|
|
7,4
|
40
|
|
7,5
|
32
|
|
7,6
|
25
|
Hidrogenkarbonatni sustav predstavlja najznačajniji kemijski puferski sustav u organizmu koji utječe na pH vrijednost. Kao i drugi kemijski puferski sustavi, učinak ostvaruje reverzibilnim vezanjem vodikovih iona što utječe na njihovu koncentraciju i vrijednost pH. Temelj ovoga sustava čini ugljična kiselina koja nastaje spajanjem vodikovoga i bikarbonatnog iona, a može disocirati na vodu i ugljični dioksid prema sljedećoj formuli:
H+ + HCO3- ↔ H2CO3 ↔ H2O + CO2.
Za uspješnost ovoga sustava potrebni su enzim karboanhidraza, koji ubrzava ove reakcije, te odgovarajuća funkcija pluća koja osigurava eliminaciju ugljičnoga dioksida iz organizma. Dakle, u uvjetima povećanja koncentracije vodikovih iona oni se vežu s bikarbonatnim ionima pri čemu nastaje ugljična kiselina koja disocira na vodu i ugljični dioksid koji se plućima izbacuje iz organizma te tako dolazi do odstranjenja viška vodikovih iona i održavanja uredne pH vrijednosti.
Pluća i alveolarna ventilacija. Kako je već opisano, veličina alveolarne ventilacije značajno utječe na koncentraciju vodikovih iona, odnosno pH vrijednost. Smanjenjem alveolarne ventilacije smanjuje se eliminacija ugljičnoga dioksida te se proporcionalno povećava njegova koncentracija u krvi. Zbog toga prethodno opisana reakcija ide obrnutim slijedom, odnosno povećana koncentracija ugljičnoga dioksida u krvi spaja se s vodom, pri čemu će nastati ugljična kiselina koja disocira na vodik i bikarbonatni ion. To će rezultirati povećanjem koncentracije vodikovih iona, odnosno smanjenjem pH vrijednosti i razvojem acidoze. U tom će se slučaju povećati i koncentracija bikarbonatnih iona, ali s obzirom na njihovu ukupnu koncentraciju, koja je znatno veća od koncentracije vodikovih iona, to povećanje neće doći do izražaja. Isto tako, u suprotnim okolnostima, pri povećanoj alveolarnoj ventilaciji, ugljični dioksid eliminira se brže nego što se stvara, pa je i njegova koncentracija u krvi niža. Ona se nadoknađuje povećanim stvaranjem ugljične kiseline iz vodikovih i bikarbonatnih iona, zbog čega se smanjuje koncentracija vodikovih iona te dolazi do porasta vrijednosti pH, odnosno razvija se alkaloza. Prema tome, u slučaju povećanja koncentracije vodikovih iona, oni će izravno poticati centar za disanje i povećati alveolarnu ventilaciju kako bi se smanjila njihova koncentracija, dok će u slučaju smanjene koncentracije vodikovih iona centar za disanje biti inhibiran, odnosno doći će do smanjenja alveolarne ventilacije s ciljem povećanja koncentracije vodikovih iona.
Bubrezi u regulaciji pH vrijednosti. Bubrezi u regulaciji vrijednosti pH sudjeluju pomoću dva osnovna mehanizma: regulacijom sekrecije vodikovih iona te regulacijom reapsorpcije i/ili stvaranja novih bikarbonatnih iona. U uvjetima povećanja koncentracije vodikovih iona u krvi (acidoza) bubrezi se prilagođavaju povećanom sekrecijom vodikovih iona te povećanom reapsorpcijom bikarbonatnih iona, što se zbiva u gotovo svim dijelovima sustava kanalića (osim u silaznom i uzlaznom kraku Henleove petlje), a pojačava se i stvaranje bikarbonatnih iona koji se potom otpuštaju u krv. Bubrežni mehanizmi regulacije pH vrijednosti ne djeluju trenutno, kao kemijski puferski sustav i plućni mehanizmi (veličina alveolarne ventilacije), nego im je za potpuni učinak potrebno nekoliko sati ili dana (Slika 3.17.).
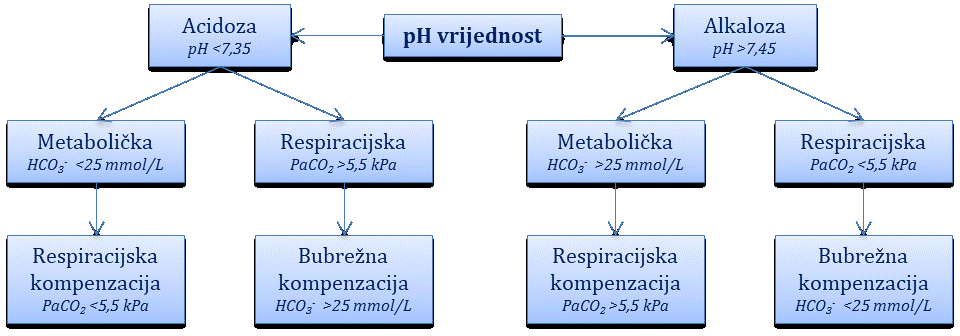
Slika 3.17. Shematski prikaz poremećaja acidobazne ravnoteže i njezinih kompenzacijskih mehanizama
Anionski manjak i suvišak baza. Za potpuno razumijevanje tumačenja nalaza acidobaznoga sustava potrebno je definirati i pojam anionskoga manjka. U normalnim okolnostima, prema načelu elektronegativnosti, koncentracije aniona i kationa u plazmi moraju biti jednake i razlike između njihovih koncentracije ne postoje. Ipak, kako se u klasičnim laboratorijskim uvjetima i kliničkoj praksi ne određuju svi kationi i anioni, nego samo oni značajniji kao što su natrijevi (kation) te klorni i bikarbonatni (anioni), dobiva se uvjetna razlika između njihove koncentracije. Prema tome, anionski manjak (anionski zjap, anionski procjep, engl. anion gap) predstavlja razliku između izmjerenih kationa (koncentracija natrija) i aniona (koncentracija klora i bikarbonata), a računa se prema formuli: Na+ - (Cl- + HCO3-). Normalna vrijednost anionskoga manjka iznosi između 3 i 11 mEq/L. Poznavanje ovih vrijednosti od koristi je pri diferenciranju uzroka poremećaja acidobaznoga statusa, što će biti kasnije opisano. Suvišak baza (engl. base excess) laboratorijski je pojam koji označava količinu jake baze ili jake kiseline koju je potrebno dodati uzorku krvi s poremećenom vrijednosti pH kako bi došlo do njezine normalizacije. Normalne vrijednosti suviška baza su između +2 i -2, suvišak baza negativniji od -2 upućuje na acidozu, a pozitivniji od +2 na alkalozu.
Hlapljive i nehlapljive kiseline. Za razumijevanje nastanka poremećaja acidobazne ravnoteže potrebno je definirati i pojmove hlapljivih i nehlapljivih kiselina. Nehlapljive kiseline su one koje ne mogu poput ugljične kiseline disocirati na vodu i ugljični dioksid koji se eliminira iz organizma disanjem, nego je njihovo izlučivanje strogo vezano uz bubrege koji predstavljaju glavni način njihove eliminacije.
METABOLIČKA ACIDOZA
Definicija. Metabolička acidoza predstavlja najčešći poremećaj acidobazne ravnoteže koji nastaje uslijed povećanoga nakupljanja organskih, nehlapljivih kiselina u organizmu (pojačana proizvodnja i/ili smanjeno izlučivanje) ili uslijed povećanoga gubitka iona bikarbonata. Glavni laboratorijski nalazi u metaboličkoj acidozi uključuju pH manji od 7,35 te snižene vrijednosti bikarbonata (< 25 mmol/L). Mjerenje anionskoga manjka omogućava razlikovanje metaboličke acidoze uzrokovane nakupljanjem organskih, nehlapljivih kiselina, gdje je anionski manjak povećan, od metaboličke acidoze uzrokovane povećanim gubitkom bikarbonatnih iona, gdje je on normalan, jer se svaki izgubljen bikarbonatni ion nadoknađuje ionom klora (zbog toga se takve acidoze nazivaju i hiperkloremičnima).
Metabolička acidoza s povećanim anionskim manjkom (> 16 mmol/L) nastaje uslijed pojačane proizvodnje ili smanjenoga izlučivanja organskih, nehlapljivih kiselina. Najčešći klinički oblici ove skupine metaboličkih acidoza su laktacidoza, dijabetička ketoacidoza, alkoholna ketoacidoza, uremijska acidoza te egzogena acidoza.
Laktacidoza je jedan od najčešćih kliničkih oblika metaboličke acidoze koji nastaje uslijed nakupljanja laktata, završnih produkata anaerobne glikolize. U normalnim se prilikama laktati metaboliziraju u jetri Krebsovim ciklusom, no u slučaju njihova povećanog stvaranja taj metabolički put postaje insuficijentan te dolazi do nakupljanja laktata u krvi (laktacidoza se javlja se pri vrijednostima laktata u krvi višima od 5 mmol/L). S obzirom na način nastanka, razlikujemo dva tipa laktacidoze: tip A koji nastaje uslijed sistemske tkivne hipoksije i posljedične aktivacije anaerobne glikolize kao puta stvaranja energije, pri čemu se u suvišku stvaraju laktati te tip B koji nastaje uslijed smanjenoga kapaciteta jetre da metabolizira nastale laktate, što dovodi do njihova nakupljanja u krvi (Tablica 3.26.).
|
Tablica 3.26. Najčešći uzroci laktacidoze
|
|
Laktacidoza tip A
|
Laktacidoza tip B
|
|
Šok (kardiogeni, hipovolemični, distributivni);
Trovanje ugljičnim monoksidom ili cijanidima;
Težak fizički napor (prekomjerna mišićna aktivnost);
Kardiorespiratorni arest i reanimacija.
|
Zatajivanje jetre i bubrega;
Deficit tiamina (bitan kofaktor u metabolizmu laktata);
Lijekovi (metformin, salcilati, izoniazid);
Propilen glikol (otapalo nekih lijekova za i.v. primjenu).
|
Ketoacidoza predstavlja oblik metaboličke acidoze koji nastaje uslijed povećanoga nakupljanja ketonskih tijela (aceton, aceto-octena kiselina, β-hidroksimaslačna kiselina) u stanjima pojačane razgradnje masti s ciljem osiguranja energetskih potreba, što se događa kada stanice nemaju dostupnih ugljikohidrata koje bi koristile kao primarni izvor energije. To se najčešće događa kod bolesnika sa šećernom bolesti (dijabetička ketoacidoza), alkoholičara (alkoholna ketoacidoza) i bolesnika koji gladuju.
Uremijska acidoza predstavlja oblik metaboličke acidoze koji nastaje uslijed oštećenja bubrežne funkcije i smanjene mogućnosti izlučivanja nehlapljivih organskih kiselina. Javlja se kada glomerularna filtracija postaje manja od 20 - 30 mL/min. Pri toj glomerularnoj filtraciji smanjuje se i sekrecija vodikovih iona te se smanjuje stvaranje biokarbonatnih iona, što dodatno pridonosi razvoju acidoze.
Egzogena metabolička acidoza nastaje uslijed povećanoga unosa organskih kiselina u organizam, što se ponajprije događa kod posebnih oblika trovanja (metanol, etilenglikol, salicilati, propilenglikol).
Metabolička acidoza s normalnim anionskim manjkom (< 16 mmol/L) najčešće nastaje uslijed povećanoga gubitka iona bikarbonata gastrointestinalnim putem ili uslijed poremećaja renalne acidifikacije mokraće (nemogućnost reapsorpcije bikarbonata, nezadovoljavajuća sekrecija vodika), a rjeđe može nastati i u stanjima povećanja koncentracije klora u plazmi.
Gastrointestinalni gubici bikarbonata. Fiziološki, bikarbonati se u probavnom sustavu najviše luče putem sekreta tankoga crijeva i gušterače, stoga se i njihov pojačani gubitak susreće u stanjima obilnih proljeva ili pojačane drenaže pankreatičkoga sadržaja (nazogastrična sukcija). Hiperkloremija nastaje kao posljedica transporta bikarbonata jer se za svaki izlučeni ion bikarbonata apsorbira jedan ion klora (HCO3-/Cl- kontratransport). Zbog pojačane apsorpcije klora ne dolazi do poremećaja po načelu elektronegativnosti i anionski manjak ostaje uredan.
Renalna tubularna acidoza glavni je bubrežni uzrok razvoja metaboličke acidoze s normalnim anionskim manjkom, a na to pomišljamo kod bolesnika s metaboličkom acidozom, urednim anionskim manjkom i hiperkloremijom, uz normalnu glomerularnu filtraciju te odsutnost proljeva i nazogastrične sukcije. Poremećaj uključuje poremećaj reapsorpcije bikarbonata i sekrecije vodika što rezultira smanjenom acidifikacijom urina. Razlikujemo proksimalnu tubularnu acidozu koja nastaje uslijed nemogućnosti reapsorpcije bikarbonata u proksimalnim tubulima i distalnu tubularnu acidozu koja nastaje kao posljedica oštećene sekrecije vodikovih iona u distalnom tubulu (detaljnije opisano u poglavlju o razvojnim i nasljednim poremećajima bubrega).
Ostali uzroci. Ovaj oblik metaboličke acidoze može se susresti i kod bolesnika kod kojih se vrši brza primjena velike količine infuzijskih otopina koje ne sadrže bikarbonate (npr. 0,9 %-tni NaCl), jer dolazi do dilucije bikarbonata uz razvoj hiperkloremije, te pri povećanom unosu amnikokiselina koje sadržavaju kloride (parenteralna prehrana).
Klinička slika. Simptomi i znakovi metaboličke acidoze prekriveni su manifestacijama osnovne bolesti. Glavni klinički znak predstavlja hiperventilacija, odnosno Kussmaulovo disanje (duboko, šumno i brzo disanje) koje predstavlja respiracijsku kompenzaciju acidoze. Acidemija rezultira i razvojem mišićne slabosti (koja može negativno utjecati na respiracijski rad), slabljenjem srčane kontraktilnosti (hipotenzija) te poremećajem središnjega živčanog sustava (poremećaji stanja svijesti). Zbog pomaka vodika u stanice u zamjenu za izlazak kalija, moguća je hiperkalijemija i nastanak malignih poremećaja srčanoga ritma.
Dijagnoza se postavlja na osnovi anamnestičkih podataka, kliničke slike i kliničkoga nalaza te nalaza plinskih analiza i acidobaznoga statusa arterijske krvi. Metaboličku acidozu karakterizira snižen pH (< 7,35) te snižena vrijednost bikarbonata (< 25 mmol/L). U početnoj fazi uslijed hiperventilacije može nastati respiratorna kompenzacija koju karakteriziraju uredna vrijednost pH, sniženi bikarbonati te snižena vrijednost parcijalnoga tlaka ugljičnoga dioksida (ova je faza privremena te će nakon nekoga vremena doći će do pada vrijednosti pH). U daljnjoj etiološkoj diferencijaciji analizira se vrijednost anionskoga manjka i vrijednosti klora.
Metabolička acidoza koja nastaje uslijed opterećenja organizma organskim kiselinama (pojačana endogena proizvodnja, pojačani egzogeni unos, smanjeno izlučivanje) praćena je povećanim anionskim manjkom jer se potrošeni bikarbonati ne nadoknađuju drugim anionima.
U slučaju metaboličke acidoze koja nastaje uslijed pojačanoga gubitka bikarbonata, bilo putem probavnoga sustava, bilo bubrega, svaki izgubljeni ion bikarbonata nadoknađuje se ionom klora (zbog specifičnoga načina transporta), zbog čega se neutralizira anionski manjak nastao gubitkom bikarbonata, ali se razvija i hiperkloremija pa se često takve acidoze nazivaju hiperkloremičnima. Razlikovanje uzroka hiperkloremijske metaboličke acidoze (događa li se gubitak bikarbonata putem probavnoga sustava ili putem bubrega) moguće je mjerenjem anionskoga manjka u urinu (anionski manjak negativan je kod gubitka bikarbonata probavnim sustavom, dok je pozitivan kod bubrežnoga gubitka).
Daljnja etiološka diferencijacija metaboličke acidoze temelji se na amnestičkim podacima (npr. pojačan unos alkohola, uzimanje metformina kod bolesnika s oštećenom funkcijom bubrega, sindrom proljeva i sl.) i drugim laboratorijskim nalazima.
Liječenje metaboličke acidoze podrazumijeva liječenje osnovne bolesti i primjenu potpornih mjera koje osiguravaju odgovarajuću tkivnu perfuziju i fiziološke kompenzacijske mehanizme (respiracija, diureza). Intravenska primjena bikarbonata opravdana je samo kod teške acidoze s vrijednostima pH nižima od 7,0. Količina bikarbonata koju treba nadoknaditi računa se prema dolje navedenoj formuli, od čega se polovica daje kroz prva tri do četiri sata, a ostatak treba nadoknaditi ovisno o kontrolnim laboratorijskim nalazima. U najtežim oblicima i u slučajevima slaboga odgovora na konzervativno liječenje indicirano je liječenje hemodijalizom.
HCO3- deficit = 0,5 x tjelesna težina (kg) x (24 - HCO3-)
Formula za izračun deficita bikarbonata
Prognoza bolesnika s metaboličkom acidozom u prvom redu ovisi o vrijednosti pH. Smrtnost bolesnika s metaboličkom acidozom čiji je pH niži od 6,9 iznimno je visoka, a ovisi i o uzročnoj bolesti u podlozi.
METABOLIČKA ALKALOZA
Definicija. Metabolička alkaloza označava poremećaj acidobazne ravnoteže koji se očituje povišenom vrijednosti pH arterijske krvi uz povećanu koncentraciju bikarbonata (> 25 mmol/L) u odsutnosti poremećaja ventilacije, odnosno hiperkapnije.
Etiopatogeneza. Dva su osnovna mehanizma koji dovode do razvoja metaboličke alkaloze: 1) prisutnost bolesti i stanja koji potiču nastanak metaboličke alkaloze (stanja povezana s povećanim gubitkom vodika i posljedičnim pojačanim stvaranjem bikarbonata ili stanja povezana s povećanim unosom bikarbonata) te 2) prisutnost bolesti i stanja koja podržavaju stanje metaboličke alkaloze (stanja povezana s smanjenom bubrežnom sposobnosti izlučivanja bikarbonata) – Tablica 3.27.
|
Tablica 3.27. Temeljni etiopatogenetski mehanizmi metaboličke alkaloze
|
|
Bolesti i stanja koji potiču nastanak metaboličke alkaloze
|
Bolesti i stanja koja podržavaju stanje metaboličke alkaloze
|
|
Pojačani gubitak vodika probavnim sustavom;
Pojačani gubitak vodika bubrezima;
Unutarstanični pomak vodika;
Povećani unos bikarbonata u organizam.
|
Hipovolemija;
Hipervolemija sa smanjenom bubrežnom perfuzijom;
Primarni hiperaldosteronizam;
Hipokloremija i hipokalijemija.
|
Dakle, da bi nastala metabolička alkaloza, moraju zadovoljena biti dva osnovna uvjeta: prisutnost pojačanoga stvaranja bikarbonata, što se događa kompenzacijski uslijed gubitka vodika iz plazme, ili uslijed povećanoga unosa bikarbonata u organizam te manjkavosti bubrežne sposobnosti izlučivanja bikarbonata, s obzirom na to da u fiziološkim uvjetima povećana koncentracija bikarbonata u plazmi rezultira brzim pojačanim izlučivanjem iz organizma smanjenjem njegove tubularne reapsorpcije.
Bolesti i stanja koji potiču nastanak metaboličke alkaloze ona su stanja kod kojih dolazi do povećanoga stvaranja bikarbonata kao odgovora na gubitak vodika ili uslijed povećanoga unosa bikarbonata u organizam. Povećano stvaranje bikarbonata uslijed gubitka iona vodika uvjetovano je kemijskom reakcijom: vodikov ion nastaje disocijacijom vode pri čemu uz njega nastaje i hidroksilni ion koji se ne gubi zajedno s vodikom, nego se spaja s ugljičnim dioksidiom pri čemu nastaje bikarbonat. Najčešća klinička stanja koja dovode do ove situacije su: 1) gubitak vodikovih iona putem probavnoga sustava, 2) gubitak vodikovih iona putem bubrega, 3) unutarstanični pomak vodika u zamjenu za kalij u stanjima teške hipokalijemije, 4) prekomjeran unos bikarbonata te 5) gubitak tekućine koja sadrži malo ili nimalo bikarbonata (tzv. kontrakcijska alkaloza).
Gubitak vodikovih iona putem probavnoga sustava najčešći je uzrok razvoja metaboličke alkaloze. On nastaje u stanjima prekomjerna povraćanja i nazogastrične sukcije kada se gubi velika količina vodika i klora putem želučane kiseline (HCl), kao i u slučaju proljeva s povećanim gubitkom klorida, što se vidi u nekim situacijama kao što su urođena kloridna dijareja ili u prisutnosti viloznih adenoma.
Gubitak vodikovih iona putem bubrega javlja se kao posljedica pojačane mineralokortikoidne aktivnosti (primarni hiperaldosteronizam) uslijed pojačanoga zadržavanja natrija i vode u zamjenu za vodik i kalij, primjene diuretika Henleove petlje ili tiazida koji potiču bubrežno izlučivanje natrija, kalija i vodika te pri nekim genetskim poremećajima obilježenima poremećajem ionskoga transporta (Bartterov i Gitelmanov sindrom).
Povećan unos bikarbonata u organizam rijetko dovodi do razvoja metaboličke alkaloze, osobito u uvjetima očuvane bubrežne sposobnosti njegova izlučivanja. Obično je povezana s primjenom veće količine natrijeva bikarbonata u terapijske svrhe kroz kraće vrijeme ili primjenom većih doza krvnih pripravaka u kojima nalazimo citrate koji se metaboliziraju u bikarbonate, uz prisutnost prethodno navedenih uzroka smanjene bubrežne sposobnosti izlučivanja bikarbonata.
Kontrakcijska alkaloza podrazumijeva gubitak tekućine koja sadrži malo ili nimalo bikarbonata posljedično čemu se povisuje njegova koncentracija u preostalom volumenu. To se najčešće susreće kod intravenske primjene većih doza diuretika Henleove petlje u liječenju hipervolemije.
Bolesti i stanja koja podržavaju stanje metaboličke alkaloze. Kako je već navedeno, u fiziološkim uvjetima svako povećanje koncentracije bikarbonata u plazmi rezultira povećanim izlučivanjem (smanjenje reapsorpcije) bikarbonata što onemogućava razvoj metaboličke alkaloze. Prema tome, da bi se metabolička alkaloza razvila, potrebna je prisutnost bolesti i stanja koja smanjuju bubrežnu sposobnost izlučivanja bikarbonata. Najčešće se radi o prisutnosti sljedećih čimbenika: poremećaji volumnoga statusa (stanje hipovolemije ili stanje hipervolemije s neodgovarajućom perfuzijom bubrega), akutna ili kronična bolest bubrega (smanjena glomerularna filtracija), primarni hiperaldosteronizam te prisutnost hipokloremije i hipokalijemije (smanjena reapsorpcija uvjetovana specifičnim transportnim mehanizmima). Hipokloremija i hipokalijemija česte su u metaboličkoj alkalozi s obzirom na to da se uz vodik putem bubrega često gube i kalij i kloridi.
Klinička slika. Metabolička alkaloza je u svojoj osnovi najčešće asimptomatska bolest, a često u kliničkoj slici dominiraju simptomi i znakovi osnovne bolesti. Rijetko metabolička alkaloza može biti povezana s mišićnim grčevima, tetanijom i parestezijama (za razliku od respiracijske alkaloze gdje su oni česti) ili može uzrokovati uznemirenost, dezorijentiranost, epileptičke napadaje ili komu. Metaboličku alkalozu mogu često pratiti i manifestacije hipokalijemije s kojom je povezana.
Dijagnoza se postavlja na temelju kliničke slike, anamnestičkih podataka i nalaza plinske analize i acidobaznoga statusa arterijske krvi. Klasično, u ABS-u nalazimo povišene vrijednosti pH (> 7,45), kao i povećanu koncentraciju bikarbonata (> 25 mmol/L). Kao respiratorni kompenzacijski odgovor (hipoventilacija), nalazimo i povišene vrijednosti parcijalnoga tlaka ugljičnoga dioksida (vrijednost PaO2 povisuje se za oko 0,7 mmHg za svaki porast koncentracije HCO3- od 1 mEq/L). Česti su nalazi uz metaboličku alkalozu i hipokalijemija i hipokloremija. Mjerenje koncentracije klorida u urinu potpomaže etiološku diferencijaciju metaboličke alkaloze te omogućava predviđanje odgovora na primjenu klorida (kloridno osjetljiva i kloridno neosjetljiva) – Tablica 3.28.
|
Tablica 3.28. Vrste metaboličkih alkaloza s obzirom na vrijednost klorida u urinu
|
|
Kategorija
|
[Cl-] urin
|
Najčešći uzroci
|
Liječenje
|
|
Metabolička alkaloza osjetljiva na kloride
|
< 15 mEq/L
|
Gubitak volumena (diuretici);
Povraćanje, NG sukcija;
Hipokalijemija, hipokloremija
|
Povoljan odgovor na primjenu infuzija koje sadrže kloride
|
|
Metabolička alkaloza neosjetljiva na kloride
|
> 25 mEq/L
|
Višak mineralokortikoida;
Povećan unos alkalija;
Bartterov sindrom.
|
Bez odgovora na primjenu infuzija koje sadrže kloride
|
Liječenje metaboličke alkaloze usmjereno je na zbrinjavanje uzročne bolesti koja se nalazi u podlozi. Umjerena metabolička alkaloza dobro se tolerira te je specifično liječenje indicirano kod pH vrijednosti viših od 7,6.
Liječenje metaboličke alkaloze osjetljive na kloride podrazumijeva primjenu infuzija fiziološke otopine (0,9 % NaCl) prema uputama navedenim u nastavku ako se radi o bolesnicima s hipovolemijom, dok se kod bolesnika s hipervolemijom u terapiju uključuje diuretik acetazolamid (5 - 10 mg/kg intravenski ili peroralno) koji inhibicijom karboanhidraze pojačava lučenje bikarbonata putem bubrega.
Deficit klorida (mEq) = 0,2 x tjelesna težina (kg) x (100 - koncentracija Cl- u plazmi)
Potreban volumen (L) = procijenjeni deficit Cl- / 154
Formule za izračun nadoknade klorida u metaboličkoj alkalozi
Liječenje metaboličke alkaloze neosjetljive na kloride podrazumijeva djelovanje na uzrok, a to je najčešće hiperaldosteronizam, zbog čega se najčešće i primjenjuju antagonisti aldosterona (spironolakton ili eplerenon).
Dodatnu terapijsku korist pruža nadoknada kalija i ispravak hipokalijemije, primjena blokatora H2 receptora ili inhibitora protonske pumpe, a u najtežim oblicima indicirano je i liječenje hemodijalizom uz primjenu kloridnih dijalizatnih otopina koje sadrže malo bikarbonata. Kod vitalno ugroženih bolesnika opravdana je i primjena klorovodične kiseline (HCl), odnosno vodika, prema navedenim uputama.
Deficit vodika (mEq) = 0,5 x tjelesna težina (kg) x (plazmatska koncentracija HCO3- - 30)
Potreban volumen (L) = procijenjeni deficit H+ / 100
Maksimalna brzina primjene 0,2 mEq/kg/h
Formule za izračun nadoknade vodika u metaboličkoj alkalozi
RESPIRATORNA ACIDOZA
Definicija. Respiratorna acidoza predstavlja poremećaj acidobazne ravnoteže koji nastaje uslijed alveolarne hipoventilacije i posljedične retencije ugljičnoga dioksida (hiperkapnija). U načelu razlikujemo akutnu i kroničnu respiracijsku acidozu koje se razlikuju prema vrijednosti bikarbonata. Kroničnu respiratornu acidozu karakterizira bubrežna kompenzacija nastaloga respiracijskog poremećaja u vidu povećane reapsorpcije i stvaranja bikarbonata zbog čega su oni povišeni, a događa se kroz tri do četiri dana od nastanka poremećaja.
Etiopatogeneza. Respiratorna acidoza nastaje uslijed alveolarne hipoventilacije zbog čega se u krvi nakuplja ugljični dioksid, odnosno razvija se hiperkapnija. Ugljični dioksid u suvišku spaja se s vodom pri čemu nastaje ugljična kiselina koja potom disocira na vodik i bikarbonat. Tako nastaje povećana koncentracija vodikovih iona koji dovode do pada pH vrijednosti. Respiratorna acidoza nastaje kao posljedica akutne ili kronične respiratorne insuficijencije (Tablica 3.29.).
|
Tablica 3.29. Etiologija respiratorne acidoze
|
|
Bolesti i poremećaji alveokapilarne membrane i intersticija
Pneumonija, kardiogeni edem pluća, intersticijske bolesti, difuzna alveolarna hemoragija
Bolesti i poremećaji dišnih puteva
Kronična opstruktivna plućna bolest, astma
Bolesti i poremećaji stijenke prsnoga koša
Kifoskloioza, pektus infundibulum, nestabilni prsni koš
Bolesti i poremećaji živaca i respiratornih mišića
Polineuropatije, mijastenija gravis, amiotrofična lateralna skleroza
Bolesti i poremećaji centra za disanje
Ishemija ili ozljeda mozga, utjecaj lijekova
|
Glavni je kompenzacijski mehanizam respiratorne acidoze bubrežni odgovor u vidu pojačane reapsorpcije i stvaranja bikarbonata, zbog čega se povisuje njihova koncentracija (> 25 mmol/L). On postaje vidljiv za 6 do 12 sati, a potpuno se izražava za tri do četiri dana.
Klinička slika. Akutnu respiratornu acidozu u prvom redu prate neurološke manifestacije, kao što su anksioznost, dezorijentiranost, konfuzija i glavobolja, a kasnije se razvijaju sopor i koma. Česte su i kardiovaskularne manifestacije u vidu razvoja arterijske hipertenzije ili hipotenzije uz poremećaje srčanoga ritma (paroksizmalne supraventrikularne i ventrikularne aritmije). Poremećaju srčanoga ritma pogoduju i povišene vrijednosti kalija koje prate acidozu. Kronična respiratorna acidoza obično je bez simptoma, a dijagnosticira se na temelju patoloških laboratorijskih nalaza.
Dijagnoza se postavlja na osnovi kliničke slike, anamnestičkih podataka i laboratorijskih nalaza. Plinske analize ukazuju na hipoksemiju (PaO2 < 10 kPa) i hiperkapniju (PaCO2 > 5 kPa) uz sniženu pH vrijednost. Ako se radi o akutnoj respiracijskoj acidozi, uz sniženi pH nalazimo snižene ili uredne bikarbonate, dok su kod kronične respiracijske acidoze bikarbonati povišeni, a pH uredan ili blago snižen. Ostala dijagnostička obrada ovisi o sumnji na etiologiju (rendgenogram srca i pluća, kompjuterizirana tomografija mozga i sl.).
Liječenje se sastoji od ispravljanja respiratornoga poremećaja i korekcije alveolarne ventilacije. U prvom se redu sastoji od medikamentozne simptomatske terapije (npr. bronhodilatatori) i oksigenoterapije s ili bez primjene neinvazivne mehaničke ventilacije. Primjenu kisika treba ograničiti na niske koncentracije jer umjerena hiperkapnija djeluje stimulativno na centar za disanje, stoga davanje kisika u visokim koncentracijama može djelovati inhibitorno na centar za disanje. U najtežim oblicima indicirana je intubacija i invazivna mehanička ventilacija. Primjena bikarbonata s ciljem ispravljanja acidoze kod ovih je bolesnika kontraindicirana.
RESPIRATORNA ALKALOZA
Definicija. Respiratorna alkaloza predstavlja poremećaj aciobazne ravnoteže koji primarno nastaje uslijed povećane alveolarne ventilacije kojom se pojačano odstranjuje ugljični dioksid što dovodi do njegova sniženja u krvi i posljedičnoga povišenja pH vrijednosti. U odnosu na aktivaciju kompenzatornih mehanizama (sniženje vrijednosti bikarbonata), razlikujemo akutnu i kroničnu respiratornu alkalozu. Kompenzacijski odgovor na akutnu respiratornu alkalozu podrazumijeva sniženje bikarbonata i to 1 - 2 mmol/L za svako sniženje PaCO2 od 1,3 kPa, dok je pri kroničnoj respiracijskoj alkalozi ono veće i iznosi i 2 - 5 mmol/L.
Etiologija. Respiracijska alkaloza nastaje uslijed centralne ili hipoksične stimulacije respiracije koja dovodi do posljedične hiperventilacije. U Tablici 3.30. su prikazana najčešća stanja i bolesti koje dovode do respiratorne alkaloze.
|
Tablica 3.30. Etiologija respiratorne alkaloze
|
|
Bolesti i poremećaji središnjega živčanog sustava
Inzult, infekcije, tumori, traume, anksioznost, psihoza, bol
Utjecaj lijekova
Salicilati, nikotin, progesteron, katekolamini
Bolesti i poremećaji respiratornoga sustava
Pneumonija, plućni edem, plućna embolija, astma, KOPB
Ostala stanja i bolesti
Trudnoća, sepsa, ciroza jetre, teška anemija, hipertireoza
|
Klinička slika i dijagnoza. Akutnu respiratornu alkalozu prate omaglica, smetenost, centralne i periferne parestezije, grčevi, tahipneja te u najtežim slučajevima karpopedalni spazmi i sinkopa. Kronična respiratorna alkaloza je asimptomatska. Dijagnoza se postavlja na temelju laboratorijskih nalaza u kojima nalazimo povišene vrijednosti pH, snižene vrijednosti PaCO2 te normalne ili snižene vrijednosti bikarbonata.
Liječenje se sastoji od uklanjanja uzroka hiperventilacije. U slučaju karpopedalnoga spazma i teške tetanije, u obzir dolazi primjena 10 %-tnog kalcijeva glukonata ili karbonata. Od pomoći može biti i disanje u papirnatu vreću s ciljem smanjenja respiracijskoga odstranjenja ugljičnoga dioksida (ponovno se udiše izdahnuti ugljični dioksid).
INTERPRETACIJA NALAZA PLINSKIH ANALIZA I ACIOBAZNOG STATUSA
Brza interpretacija nalaza plinske analize arterijske krvi i acidobaznoga statusa ključna je postavljanje dijagnoze poremećaja acidobazne ravnoteže. Kao i svi laboratorijski nalazi, i ovi se nalazi moraju tumačiti u skladu s kliničkim stanjem bolesnika, s obzirom na to da ono može upućivati na prirodu bolesti i uzrok nastaloga poremećaja. Nalaz ABS-a najjednostavnije tumačimo kroz analizu tri osnovna parametra: pH vrijednost, vrijednost PaCO2 te vrijednost bikarbonata.
Prvi korak – procjena pH vrijednosti. Normalna pH vrijednost kreće se između 7,35 i 7,45. Ukoliko je pH niži od 7,35 - bolesnik je u acidozi, a ukoliko je viši od 7,45 - bolesnik je u alkalozi. pH vrijednost je pokazatelj aktualnoga stanja acidobazne ravnoteže, bez obzira je li ona posljedica kompenzacije ili ne.
Drugi korak – procjena vrijednosti PaCO2. Normalne vrijednosti PaCO2 kreću se između 4 i 6 kPa te su pokazatelj alveolarne ventilacije. Visoke vrijednosti PaCO2 (hiperkapnija) ukazuju na smanjenu alveolarnu ventilaciju te u kombinaciji sa sniženom pH vrijednosti ukazuju na respiracijsku acidozu, dok snižene vrijednosti PaCO2 (hipokapnija) ukazuju na pojačanu alveolarnu ventilaciju te u kombinaciji s povišenom pH vrijednosti ukazuju na respiracijsku alkalozu. Nasuprot tome, acidoza praćena hipokapnijom, a alkaloza hiperkapijom predstavljaju respiracijsku kompenzaciju metaboličkoga poremećaja.
Treći korak – procjena vrijednosti bikarbonata. Normalne vrijednosti bikarbonata kreću se između 20 i 25 mmol/L. Snižene vrijednosti bikarbonata u kombinaciji sa sniženim vrijednostima pH ukazuju na metaboličku acidozu, dok povišene vrijednosti bikarbonata u kombinaciji s povišenim vrijednostima pH ukazuju na metaboličku alkalozu. Nasuprot tome, ako je acidoza praćena povišenjem bikarbonata, a alkaloza sniženjem bikarbonata, posrijedi je metabolička kompenzacija respiracijskoga poremećaja.
NAJZNAČAJNIJI ELEKTROLITSKI POREMEĆAJI
Uvod. Među najznačajnije elektrolitske poremećaje ubrajamo poremećaje koncentracije natrija (hiponatrijemija, hipernatrijemija), kalija (hipokalijemija, hiperkalijemija), kalcija (hipokalcijemija, hiperkalcijemija), fosfora (hipofosfatemija, hiperfosfatemija) i magnezija (hipomagnezijemija, hipermagnezijemija).
POREMEĆAJI KONCENTRACIJE NATRIJA
Fiziologija. Natrij predstavlja jednu od najvažnijih osmotski aktivnih čestica u organizmu, čija je koncentracija usko povezana s količinom i raspodjelom tekućine u organizmu. Natrij predstavlja i najvažniji izvanstanični kation čije se normalne vrijednosti u plazmi kreću između 136 i 145 mmol/L. Homeostaza natrija i vode regulirana je putem nekoliko mehanizama, a najznačajniji su: 1) osmotičko izlučivanje antidiuretskoga hormona (smanjena osmolalnost plazme rezultira supresijom lučenja antidiuretskoga hormona što je uvjetovano osmoreceptorima u hipotalamusu), 2) osjet žeđi i pojačan unos vode u organizam (porast osmolalnosti plazme rezultira aktivacijom centra za žeđ) te 3) neosmotičko izlučivanje antidiuretskoga hormona (pojačano lučenje antidiuretskoga hormona kao odgovor na smanjenje volumena ili krvnoga tlaka). Prema tome, jednu od najvažnijih uloga ima antidiuretski hormon (ili arginin-vazopresin) koji se stvara u supraoptičkim i paraventrikularnim jezgrama hipotalamusa, a skladišti se u neurohipofizi, odakle se i luči u cirkulaciju, na što imaju utjecaj osmoreceptori u hipotalamusu (registriraju pad osmolalnosti plazme) te baroreceptori u karotidnim tjelešcima (registriraju pad krvnoga tlaka). U bubrezima antidiuretski hormon djeluje na distalne tubule gdje potiče ekspresiju proteina koji se naziva akvaporin 2, preko kojega se vrši resorpcija vode nazad u peritubularne kapilare.
HIPONATRIJEMIJA
Definicija. Hiponatrijemija se definira kao stanje smanjenja serumske koncentracije natrija, i to na vrijednost nižu od 135 mmol/L, i predstavlja jedan od najčešćih elektrolitnih disbalansa u kliničkoj praksi. Iako se može javiti u svakoj životnoj dobi, hiponatrijemija je znatno učestalija kod starijih osoba (u jednoj je studiji otkriveno da je 7 % osoba iz opće populacije u dobi iznad 65 godina i bez akutnih oboljenja imalo hiponatrijemiju), a česta je i u populaciji hospitaliziranih bolesnika (hiponatrijemiju se može naći kod 15 do 30 % hospitaliziranih bolesnika). S obzirom na navedeno, blaga i prolazna hiponatrijemija (vrijednosti natrija između 130 i 135 mmol/L) predstavlja česti elektrolitski otklon u kliničkoj praksi i ne zahtijeva daljnju obradu i liječenje.
Podjela. Klinička podjela hiponatrijemije zasniva se na temelju vrijednosti natrija, na temelju vremena razvoja te na temelju kliničkih manifestacija. S obzirom na vrijednost natrija, razlikujemo blagu hiponatrijemiju (130 - 135 mmol/L), umjerenu hiponatrijemiju (125 - 129 mmol/L) i tešku hiponatrijemiju (< 125 mmol/L). Na temelju vremena razvoja razlikujemo akutnu hiponatrijemiju (nastala unutar posljednjih 48 sati) te kroničnu hiponatrijemiju (nastala u vremenskom periodu duljem od 48 sati), a s obzirom na izraženost kliničkih manifestacija, razlikujemo srednje tešku hiponatrijemiju (mučnina, konfuzija, glavobolja) te tešku hiponatrijemiju (poremećaj stanja svijesti, kardiorespiratorni urušaj, neurološki ispadi).
Etiopatogeneza. Uzroci hiponatrijemije su brojni i različiti, a kako su izravno povezani s osmolalnošću plazme, s obzirom na uzrok hiponatrijemiju dijelimo u tri velike skupine: izotonična hiponatrijemija, hipertonična hiponatrijemija i hipotonična hiponatrijemija. Osim toga, pri tumačenju sniženih vrijednosti natrija u serumu u obzir treba uzeti i lažnu hiponatrijemiju.
Lažna hiponatrijemija predstavlja niske vrijednosti natrija u serumu koje nastaju kao posljedica neispravnoga uzorkovanja krvi za krvne pretrage. Najčešće se to događa uslijed uzorkovanja krvi za pretrage proksimalno od mjesta primjene infuzijskih otopina ili uslijed uzorkovanja krvi iz centralnoga venskog katetera bez eliminacije zaostale krvi u kraku katetera (prije uzorkovanja krvi iz katetera špricom se mora eliminirati zaostala krv u tzv. mrtvom prostoru katetera).
Izotonična (izoosmolarna) hiponatrijemija hiponatrijemija označava niske vrijednosti natrija u serumu koji je izotoničan, tj. koji je uredne osmolalnosti (280 - 295 mOsm/kg). Ova vrsta također predstavlja jedan oblik lažne hiponatrijemije koji se nalazi kod bolesnika koji imaju izraženu hiperproteinemiju ili hiperlipidemiju, a povezana je laboratorijskom tehnikom određivanja vrijednosti natrija (plamena fotometrija) te se naziva pseudohiponatrijemijom. To se sve rjeđe viđa u kliničkoj praksi zbog korištenja novih laboratorijskih metoda kod kojih ne bilježimo ovu interferenciju.
Hipertonična (hiperosmolarna) hiponatrijemija hiponatrijemija označava niske vrijednosti natrija u serumu koji je hipertoničan, odnosno ima povišene vrijednosti osmolalnosti (> 295 mOsm/kg). Ovaj oblik hiponatrijemije je dilucijski. Do njega dolazi u stanjima kada se u serumu nalazi povećana količina osmotski aktivnih čestica (hiperglikemija, primjena infuzija manitola), što dovodi do povlačenja vode iz intersticija u krvne žile (osmoza) zbog čega dolazi do razrjeđenja natrija. Najčešći uzrok hipertonične hiponatrijemije u kliničkoj praksi je hiperglikemija. Pri takvim se stanjima koristimo matematičkom formulom za izračun korigirane vrijednosti natrija.
Formula za korigiranje natrijemije uz hiperglikemju
Hipotonična (hipoosmolarna) hiponatrijemija označava niske vrijednosti natrija u serumu koji je hipotoničan, odnosno ima snižene vrijednosti osmolalnosti (< 280 mOsm/kg). Ovisno o volumnome stanju bolesnika, razlikujemo tri podvrste takve hiponatrijemije: hipovolemijska, euvolemijska i hipervolemijska hipotonična hiponatrijemija.
Hipovolemijska hipotonična hiponatrijemija nastaje u stanjima volumne deplecije koja može nastati uslijed bubrežnih ili izvanbubrežnih gubitaka tekućine (Tablica 3.31.), što dovodi do pojačanoga lučenja antidiuretskoga hormona koji nastoji resorbirati tekućinu iz distalnih tubula. To rezultira retencijom vode i padom vrijednosti natrija uslijed razrjeđenja (dilucijska hiponatrijemija). Utvrđivanje uzroka ovih hiponatrijemija temelji se na dobro uzetoj anamnezi, kao i na određivanju vrijednosti natrija u urinu: ako je razina natrija u urinu niža od 20 mmol/L, vjerojatni uzrok gubitka tekućine je izvanbubrežni, dok je kod razine više od 20 mmol/L vjerojatni uzrok gubitak tekućine preko bubrega.
|
Tablica 3.31. Najčešći uzroci hipovolemijske hipotonične hiponatrijemije
|
|
Gubitak tekućine izvan bubrega
|
Gubitak tekućine putem bubrega
|
|
Povraćanje, proljev, krvarenje;
Prekomjerno znojenje;
Gubitak tekućine u treći prostor (peritonitis, opekline)
|
Nefropatije s gubitkom soli;
Diuretici (tiazidi), osmotska diureza (glukoza, manitol);
Manjak mineralokortikoida
|
Hipervolemijska hipotonična hiponatrijemija nastaje kod bolesti i stanja praćenih retencijom tekućine i nastankom edema i izljeva. Mehanizam nastanka hiponatrijemije i kod ovih je bolesnika dilucijski. Ova se vrsta hiponatrijemije viđa kod bolesnika sa srčanim popuštanjem, jetrenom insuficijencijom te akutnim ili kroničnim poremećajem bubrežne funkcije (nefritički sindrom, nefrotski sindrom). Točna etiologija se utvrđuje na temelju anamneze, fizikalnoga pregleda i drugih pretraga (laboratorij, slikovne metode) koji ukazuju na neko od navedenih kliničkih stanja.
Euvolemijska hipotonična hiponatrijemija rijedak je oblik hiponatrijemije koji nastaje u uvjetima pojačanoga gubitka natrija u odnosu na vodu. Najčešća stanja u kojima nalazimo ovu vrstu hiponatrijemije su primarna polidipsija, smanjen unos soli, hipotireoza, insuficijencija nadbubrežne žlijezde te blaži oblici sindroma neprimjerenoga lučenja antidiuretskoga hormona (SIADH). Razlikovanje ovih stanja temelji se na nalazu osmolalnosti urina, vrijednosti hormona štitne žlijezde i testiranja funkcije nadbubrežne žlijezde (prikazano shematski).
Klinička slika. S obzirom na kliničku sliku, razlikujemo akutnu i kroničnu hiponatrijemiju te srednje tešku i tešku hiponatrijemiju. Akutna hiponatrijemija nastaje tijekom vremenskoga perioda kraćeg od 48 sati, što je praćeno visokim rizikom od nastanka edema mozga s posljedičnim simptomima kao što su poremećaj svijesti, neurološki ispadi te kardiorespiratorna insuficijencija, što se smatra kliničkom slikom teške hiponatrijemije. U uvjetima postupnoga razvoja hiponatrijemije (> 48 sati) govorimo o kroničnoj hiponatrijemiji u kojoj je rizik od nastanka edema mozga znatno niži zbog razvoja adaptacijskih mehanizama moždanoga tkiva te kod takvih bolesnika ne nalazimo nikakve simptome ili su oni blaže izraženi (glavobolja, mučnina, blaga konfuzija).
Dijagnoza. Inicijalna dijagnoza hiponatrijemije postavlja se na osnovi kliničke slike i sniženih vrijednosti natrija u serumu. Kako je navedeno, blaga i prolazna hiponatrijemija (130 - 135 mmol/L) česta je u kliničkoj praksi i ne zahtijeva daljnju dijagnostičku obradu. Daljnju dijagnostičku obradu zahtijevaju teži i kronični oblici hiponatrijemija, a ona se temelji na kliničkim znakovima i laboratorijskim nalazima (Slika 3.18.).
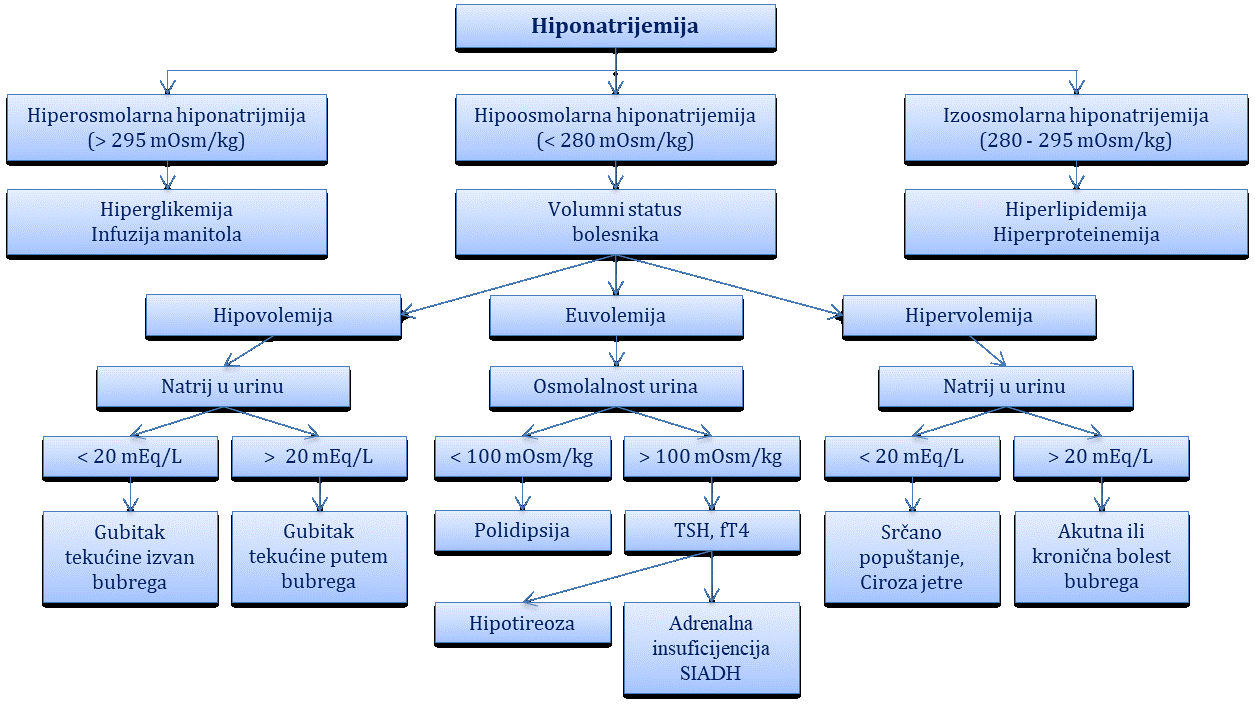
Slika 3.18. Shematski prikaz dijagnostičke obrade bolesnika s hiponatrijemom
Liječenje. Terapijski pristup bolesniku s hiponatrijemijom u prvome redu ovisi o težini kliničke slike, kao i o samim vrijednostima natrija u serumu. Temelj liječenja čini uklanjanje ili liječenje uzročne bolesti koja je dovela do hiponatrijemije uz istodobnu supstituciju natrija u obliku 3 %-tne otopine natrijeva klorida. Današnji stav u pogledu brzine nadoknade natrija nešto se razlikuje od prijašnjih preporuka. Kod bolesnika s teškim simptomima hiponatrijemije rizik od razvoja edema mozga viši je od rizika za razvoj demijelinizacijskoga sindroma povezanoga sa supstitucijskim liječenjem (kasnije opisano) te je kod ovih bolesnika preporučeno agresivnije liječenje nego je to bilo ranije, dok se kod asimptomatskih bolesnika i bolesnika sa srednje teškom kliničkom slikom bilježi viši rizik od razvoja demijelinizacijskoga sindroma u odnosu na razvoj edema mozga, pa se kod njih ne preporuča agresivna supstitucija natrija.
Terapija bolesnika s teškom hiponatrijemijom temelji se na nadoknadi natrija koja uključuje trenutnu primjenu 150 mL 3 %-tnoga NaCl-a kroz 20 minuta nakon čega se ponovno uzorkuje krv za provjeru vrijednosti natrija uz istovremeno ponavljanje infuzije 150 mL 3 %-tnoga NaCl-a kroz sljedećih 20 minuta. Daljnje liječenje ovisi o tome je li postignuto povećanje vrijednosti natrija za više od 5 mmol/L unutar prvoga sata liječenja.
Ako je unutar prvoga sata došlo do povišenja vrijednosti natrija za više od 5 mmol/L, prestaje se s primjenom 3%-tnoga NaCl-a te se nastavlja s malim volumenom 0,9 %-tnoga NaCl-a uz preporuku da se vrijednost natrija ne povisi za više od 10 mmol/L tijekom prva 24 sata liječenja i dodatnih 8 mmol/L tijekom svaka sljedeća 24 sata dok serumska koncentracija natrija ne dosegne vrijednost od 130 mmol/L. Vrijednosti natrija kod ovih bolesnika treba provjeravati svakih šest do dvanaest sati.
Ako unutar prvoga sata nije došlo do povišenja vrijednosti natrija za više od 5 mmol/L, nastavlja se infuzija 3 %-tnim NaCl-om umjerenom brzinom sve dok se ne postigne neki od sljedećih ciljeva: povišenje natrija za maksimalno 10 mmol/L u prvih 24 sata liječenja, kliničko poboljšanje simptoma te dosegnuta koncentracija natrija od 130 mmo/L. Dok je bolesnik na infuziji 3 %-tnim NaCl-om kontrolu kalija treba raditi svaka četiri sata. Prema tome, brzinu primjene 3 %-tnoga NaCl-a treba individualno prilagođavati sukladno postizanju opisanih ciljeva.
Terapija bolesnika sa srednje teškom hiponatrijemijom temelji se na etiološkom liječenju i nadoknadi natrija, a preporuke ovise o vremenu nastanka i težini hiponatrijemije. Ako se radi o dokumentiranoj hiponatrijemiji nastaloj u periodu kraćem od 48 sati (akutna hiponatrijemija), primjena 3 %-tnoga NaCl-a opravdana je samo kada se radi o sniženju vrijednosti natrija za više od 10 mmol/L u odnosu na ranije izmjerene vrijednosti. Ako nemamo jasan dokaz da se radi o akutnoj hiponatrijemiji (nemamo laboratorijski nalaz vrijednosti natrija u proteklih 48 sati), kao i ako se radi o akutnoj hiponatrijemiji kod koje je pad vrijednosti natrija manji od 10 mmol/L, liječenje ovisi o volumnom statusu. Kod hipovolemičnih bolesnika primjenjuje se otopina 0,9 %-tnoga NaCl-a u dozi od 0,5 - 1 ml/kg/h, dok se kod hipervolemičnih i normovolemičnih bolesnika primjenjuje restrikcija unosa tekućine. Korekcija vrijednosti natrija ne smije biti veća od 10 mmol/L u prva 24 sata liječenja.
Demijelinizacijski sindrom ili središnja pontina mijelinoliza teška je komplikacija brze nadoknade natrija kod bolesnika s hiponatrijemijom. Vjeruje se da nastaje uslijed brzoga povlačenja vode iz moždanoga tkiva uslijed čega dolazi do pucanja veze aksona s mijelinskim ovojnicama. Klinički se prezentira pogoršanjem stanja svijesti te neurološkim ispadima, a može se potvrditi na temelju nalaza MR mozga. Kako bi se spriječio nastanak ove komplikacije, korekcija natrija ne bi smjela biti veća od 10 mmol/L u prva 24 sata, odnosno veća od 18 mmol/L u prva 48 sata liječenja. Ako dođe do prekoračenja tih preporučenih vrijednosti, preporuča se odmah prekinuti sve aktivne terapijske mjere korekcije hiponatrijemije uz primjenu tekućine bez elektrolita (otopine glukoze) u dozi do 10 ml/kg tijekom jednoga sata. Daljnji nastavak liječenja ovisi o kontrolnim laboratorijskim vrijednostima.
HIPERNATRIJEMIJA
Definicija. Hipernatrijemija se definira kao stanje povišene serumske koncentracije natrija, i to u vrijednosti iznad 146 mmol/L. Ona se daleko rjeđe susreće od hiponatrijemije i uvijek je povezana s nekim patološkim stanjem. Procijenjena prevalencija hipernatrijemije među hospitaliziranim bolesnicima iznosi 0,5 do 2 %.
Etiopatogeneza. Ovisno o etiologiji, razlikujemo tri oblika hipernatrijemije: hipovolumna, hipervolumna i euvolumna hipernatrijemija, a osnovu nastanka hipernatrijemije čini prekomjeran gubitak volumena i/ili prekomjeran unos soli. Najčešći su uzroci gubitak vode kojega ne prati proporcionalan gubitak natrija (uremija, diuretska terapija, osmotska diureza, opekline, prekomjerno znojenje), prekomjeran unos soli (hipertone infuzije natrijeva klorida, primjena hipertonih pripravaka za parenteralnu prehranu, namjeran ili slučajan pojačan unos soli) te centralni ili nefrogeni dijabetes inspidus. U kliničkoj su praksi dva najčešća uzroka hipernatrijemije nedovoljan unos tekućine te prekomjerna primjena diuretika Henleove petlje. Značajna hipernatrijemija povećava osmotski tlak plazme što može dovesti do povlačenja tekućine iz moždanoga tkiva, pri čemu se smanjuje njegov volumen i to može dovesti do oštećenja moždanih vena i posljedičnoga krvarenja (intracerebralno, subarahnoidalno).
Klinička slika i dijagnoza. Hipernatrijemija se u prvome redu očituje pojačanim osjetom žeđi i neurološkim manifestacijama. Najprije se javljaju umor, smetenost i glavobolja, a kasnije hiperrefleksija, epileptički napadaji te na kraju koma i kardiorespiratorna insuficijencija. Dijagnoza se postavlja na temelju laboratorijskoga nalaza povišenih vrijednosti natrija u serumu. U svrhu diferenciranja uzroka preporuča se odrediti osmolalnost urina jer osmolarnost urina viša od 700 mOsm/kg može ukazivati na dijabetes inspidus kao mogući uzrok.
Liječenje. Osnovu liječenja hipernatrijemije čini primjena tekućine. Bolesnicima koji su pri svijesti i suradljivi savjetuje se obilnija peroralna rehidracija (pijenje čiste vode), dok se u ostalim slučajevima primjenjuje intravenska nadoknada tekućine. Primjena tekućine mora biti polagana kako bi se izbjegla nagla korekcija vrijednosti natrija praćena opasnošću od razvoja edema mozga (brzina korekcije natrija ne smije prelaziti 0,5 mmol/L/h). Količinu vode koju treba nadoknaditi izračunavamo matematički (prikazano u Tablici 3.32.), a samu nadoknadu vršimo primjenom hipotonih infuzijskih otopina, kao što su otopina 5 %-tne glukoze ili 0,45 %-tnoga NaCl-a. Polovicu izračunatoga manjka vode primjenjujemo brzo, kroz nekoliko sati, dok se druga polovica primjenjuje polagano kroz sljedećih 24 do 48 sati.
|
Tablica 3.32. Izračun deficita tekućine kod bolesnika s hipernatrijemijom koji treba nadoknaditi
|
|
Manjak vode (L) = željena vrijednost ukupne vode – stvarna vrijednost ukupne vode;
Željena vrijednost ukupne vode (L) = vrijednost natrija x stvarna vrijednost ukupne vode/140;
Stvarna vrijednost ukupne vode (L) = 0,6 x tjelesna masa (kg).
|
POREMEĆAJI KONCENTRACIJE KALIJA
Fiziologija. Kalij je glavni unutarstanični kation te se 98 % njegove ukupne količine u tijelu nalazi unutar stanica, dok se samo 2 % nalazi u izvanstaničnoj tekućini. S obzirom na to da plazma čini oko 20 % ukupne izvanstanične tekućine, vrijednost kalija u plazmi čini samo oko 0,4 % ukupne vrijednosti kalija u tijelu, a ta se vrijednost kreće između 3,5 i 5,5 mmol/L. Glavni način lučenja kalija iz organizma je putem bubrega i mokraće, dok se manje količine mogu lučiti i putem stolice i znojenja. Na vrijednosti kalija u plazmi, osim omjera unesenoga i izlučenog kalija, utječu i drugi čimbenici koji mogu dovesti do unutarstaničnoga pomaka kalija, kao što su: acidoza (suvišak vodikovih iona dovodi do njihova pojačanoga unosa u stanice u zamjenu za kalij), inzulin (poticanje utoka kalija u hepatocite i stanice skeletnih mišića), aldosteron (pojačana ekskrecija kalija putem bubrega) te katekolamini i njihovi agonisti (stimulacija beta adrenergičkih receptora dovodi do učinka na kalij istovjetnoga učinku inzulina). Glavni poremećaji vrijednosti kalija u plazmi su hipokalijemija i hiperkalijemija.
HIPOKALIJEMIJA
Definicija. Hipokalijemija se definira kao snižena vrijednost kalija u plazmi, i to u vrijednostima manjim od 3, 5 mmol/L. Zajedno s hiponatrijemijom ubraja se među najčešće elektrolitske poremećaje s učestalošću većom od 20 % kod hospitaliziranih bolesnika.
Etiologija. Hipokalijemija može nastati uslijed tri osnovna mehanizma: 1) unutarstanični pomak kalija pri čemu se smanjuje koncentracija kalija u plazmi, ali ukupna količina kalija u tijelu ostaje nepromijenjena, 2) smanjen unos kalija u organizam te 3) pojačan gubitak kalija iz organizma kada se osim vrijednosti kalija u plazmi smanjuje i njegova ukupna količina u tijelu. U kontekstu laboratorijskoga nalaza hipokalijemije treba misliti i na pojavu pseudohipokalijemije.
Pseudohipokalijemija opisuje se kod bolesnika s akutnom leukemijom i izraženom leukocitozom (> 50 x 109/L), a nastaje uslijed pojačane utilizacije kalija u maligne stanice kao posljedica njihove pojačane metaboličke aktivnosti što se događa u vremenu nakon uzorkovanja krvi. Da bi se spriječila ta pojava, uzorak treba dostaviti u laboratorij što prije kako bi se krv u najkraćem roku uputila u daljnju laboratorijsku obradu.
Unutarstanični pomak kalija čest je uzrok nastanka hipokalijemije. Najčešći uzroci ove pojave su: 1) alkaloza (nedostatak vodikovih iona u plazmi nadoknađuju se njegovim lučenjem iz stanica u zamjenu za ione kalija), 2) terapijska primjena inzulina (inzulin potiče utilizaciju kalija u hepatocite i stanice skeletne muskulature) te 3) pojačana stimulacija beta adrenergičkih receptora (terapijska primjena beta agonista, pojačano endogeno oslobađanje katekolamina u stanjima stresa), a rijetko uzroci mogu biti i anabolička stanja, hipotermija te trovanje teofilinom, solima barija te klorokinom.
Smanjen unos kalija rijedak je uzrok hipokalijemije, a javlja se kod bolesnika s maldigestijom i malapsorpcijom. Najčešće se viđa kod bolesnika s anoreksijom nervozom, neodgovarajućom ishranom i produženim gladovanjem.
Pojačani gubitak kalija može nastati putem probavnoga sustava, mokraćnoga sustava i kože. Probavni gubici kalija mogu nastati kod bolesnika s proljevom, povraćanjem ili u prisutnosti crijevne ili žučne fistule. Gubici kalija putem kože nastaju kod prekomjernoga znojenja ili u prisutnosti opsežnih opeklina. Pojačan gubitak kalija putem bubrega i mokraće najčešće nastaje uslijed primjene diuretika (tiazidi, diuretici Henleove petelje) i drugih lijekova (penicilini, aminoglikozidi i amfotericin B potiču sekreciju kalija u distalnim tubulima), hipomagnezijemije (nedovoljno poznat mehanizam), endokrinih poremećaja (hiperreninemija i hiperaldosteronizam) te drugih specifičnih poremećaja (distalna i proksimalna tubularna acidoza, Liddleov sindrom, Bartterov sindrom, Gitelmanov sindrom i dr).
Klinička slika kod bolesnika s hipokalijemijom može biti različita. Jedan dio bolesnika nema nikakvih simptoma, dok kod drugih nalazimo znakove neuromišićne slabosti (motorička slabost) i psihičkih promjena (depresija, letargija, kognitivne smetnje), a kod težih oblika (vrijednosti kalija manje od 2,5 mmol/L) možemo naći i paralitički ileus te poremećaje srčanoga ritma. U kliničkoj slici mogu dominirati i simptomi i znakovi osnovne bolesti koja se nalazi u podlozi.
Dijagnoza hipokalijemije postavlja se na osnovu laboratorijskoga nalaza snižene vrijednosti kalija u plazmi. Kod bolesnika s izraženom hipokalijemijom možemo naći i promjene u elektrokardiogramu u smislu inverzije T-vala, produljenja QT-intervala te pojave U-vala (ove promjene nisu specifične za hipokalijemiju te se mogu naći i kod nekih drugih poremećaja elektrolita). U cilju diferenciranja uzroka hipokalijemije, od koristi su nam anamneza i fizikalni pregled koji mogu upućivati na uzročnu bolest te određivanje vrijednosti kalija u urinu s ciljem razlučivanja gubitka kalija putem bubrega od gubitka kalija drugim putevima (kod gubitka kalija putem bubrega u prvom, jutranjem uzorku urina nalazimo vrijednosti kalija više od 20 mmol/L).
Liječenje se sastoji od djelovanja na uzrok (etiološko liječenje) te nadoknade kalija. U blažim oblicima (vrijednosti kalija iznad 3 mmol/L) nadoknada se može vršiti preparatima kalija za peroralnu primjenu, kao što su kalij-citrat, kalij-jodid ili kalij-klorid u dozi koja osigurava dnevnu nadoknadu kalija od 40 do 140 mmol (pojedinačna doza kalija ne smije biti veća od 40 mmol/L). U težim oblicima (vrijednosti kalija manje od 2,9 mmol/L) nadoknada se vrši parenteralnim putem, a doza kalija koju treba nadoknaditi računa se prema formuli navedenoj ispod teksta. Parenteralna nadoknada kalija vrši se primjenom 7,45 %-tne otopine kalijevoga klorida (1 ml otopine sadrži 74,5 mg kalijeva klorida, odnosno 1 mmol kalija i 1 mmol klorida) koja se primjenjuje razrijeđena u otopini elektrolita (fiziološka, Ringerova otopina) ili ugljikohidrata (5 %-tna glukoza) sporom intravenskom infuzijom (preporučena brzina nadoknade kalija ne smije prelaziti 20 mmol/h). Kod bolesnika s centralnim venskim kateterom koji se nalazi položen duboko u desno srce brza infuzija kalija može dovesti do fatalne kardioplegije (potreban je oprez).
Deficit kalija (mmol) = (4,5 mmol/L – izmjerena vrijednost kalija mmol/L) x tjelesna masa (kg) x 0,4
Formula za izračun deficita kalija koji se treba nadoknaditi pri hipokalijemiji
HIPERKALIJEMIJA
Definicija. Hiperkalijemija se definira kao povišena vrijednost kalija u plazmi, i to u vrijednostima višima od 5,5 mmol/L, a zbog svoga potencijalno aritmogenog učinka i povezanosti s malignim srčanim aritmijama, ubraja se u hitna stanja koja nalažu trenutno i neodgodivo liječenje.
Etiologija. Hiperkalijemija može nastati uslijed prekomjernoga unosa kalija u organizam, poremećaja redistribucije kalija (pomak kalija iz stanica u ekstracelularnu tekućinu) te smanjenoga izlučivanja kalija putem bubrega i mokraće. Kao i kod hipokalijemije, i u slučaju hiperkalijemije treba misliti na moguću pojavu lažne hiperkalijemije (pseudohiperkalijemija).
Pseudohiperkalijemija predstavlja situaciju u kojoj se hiperkalijemija bilježi u uzroku krvi (ex vivo), dok je koncentracija kalija u plazmi u organizmu (in vivo) uredna. To može nastati kao posljedica neodgovarajućega uzorkovanja i transporta krvnoga uzorka (traumatska hemoliza) ili u prisutnosti leukocitoze ili trombocitoze uslijed pojačanoga otpuštanja kalija iz stanica u epruveti.
Prekomjeran unos kalija rijetko će dovesti do hiperkalijemije ako je funkcija bubrega očuvana. Hiperkalijemija uslijed prekomjernoga unosa kalija obično se javlja kod bolesnika s oštećenom funkcijom bubrega ili bolesnika koji uzimaju antagoniste aldosterona (spironolakton, eplerenon). Također, terapijska primjena kalija (supstitucija) može biti izvor prekomjernoga unosa kalija u organizam.
Poremećaj redistribucije kalija podrazumijeva pomak kalija iz stanica u ekstracelularnu tekućinu, a time i u plazmu. To se najčešće viđa pri sljedećim stanjima: sindrom lize tumora (uništenjem tumorskih stanica dolazi do pojačanoga otpuštanja kalija u krvotok), primjena lijekova (digitalis i sukcinil-kolin potiču izlazak kalija iz stanica, dok beta blokatori priječe ulazak kalija u stanice), manjak inzulina (inzulin potiče pomak kalija u hepatocite i stanice skeletne muskulature) te acidoza (povećana koncentracija vodika u plazmi rezultira njegovim pojačanim unosom u stanice u zamjenu za kalij koji izlazi iz stanica).
Smanjeno izlučivanje kalija putem bubrega također je bitan etiološki čimbenik u razvoju hiperkalijemije, a ono može nastati uslijed akutnoga ili kroničnog oštećenja bubrežne funkcije ili hipoaldosteronizma (smanjeno stvaranje ili rezistencija na aldosteron).
Klinička slika. U blažoj hiperkalijemiji (vrijednosti kalija do 6 mmol/L) dominiraju probavne tegobe (bol u trbuhu, mučnina i povraćanje) te neuromišićni simptomi (parestezije, pareza, plegija), dok se kod težih oblika (vrijednosti kalija preko 6 mmol/L) mogu očekivati i poremećaji srčanoga ritma u obliku fatalnih, malignih poremećaja ritma (ventrikularna tahikardija, ventrikularna fibrilacija, asistolija). Hiperkalijemija predstavlja značajno viši rizik od razvoja ovih aritmija u odnosu na hipokalijemiju koja kao samostalni rizični čimbenik rijetko uzrokuje poremećaje srčanoga ritma.
Dijagnoza hiperkalijemije postavlja se na osnovi povišenih laboratorijskih vrijednosti razine kalija. Pri višim vrijednostima kalija moguće su i promjene u elektrokardiogramu koje često prate navedeni slijed: pojava šiljastoga i visokog P-vala (6 mmol/L) kojega slijedi razvoj PR-prolongacije (8 mmol/L) s napredovanjem u kompletni AV-blok (10 mmol/L) i ventrikularnu fibrilaciju ili asistoliju (14 mmol/L).
Liječenje hiperkalijemije provodi se na nekoliko razina, a ovisi o vrijednosti kalija: antagonizacija učinka kalija, promicanje pomaka kalija u stanice te poticanje ekskrecije kalija. Kod bolesnika s hiperkalijemijom do 6,5 mmol/L primjenjuju se samo mjere poticanja izlučivanja kalija i/ili promocije unutarstaničnoga pomaka kalija, dok se kod bolesnika s vrijednostima kalija preko 6,5 mmol/L ili kod pojave elektrokardiografskih znakova hiperkalijemije primjenjuju sva tri oblika liječenja.
Antagonizacija učinka kalija podrazumijeva stabilizaciju membrane kardiocita i sprečavanje nastanka srčanih aritmija, a ostvaruje se primjenom parenteralnoga kalcija (osim kod bolesnika kod kojih je hiperkalijemija posljedica intoksikacije digitalisom, kod njih je primjena kalcija kontraindicirana). U tu se svrhu najčešće primjenjuju kalcijev glukonat (10 ml 10 %-tne otopine kroz deset minuta) ili kalcijev glukonat (10 ml 10 %-tne otopine kroz deset minuta), s time da kalcijev klorid predstavlja bolji izbor s obzirom na to da u istoj količini sadrži više iona kalcija. Učinak ovih lijekova nastupa trenutno, a traje od 30 do 60 minuta te se prema potrebi ponavlja njihova primjena.
Promocija unutarstaničnog pomaka kalija ne dovodi do smanjenja ukupne količine kalija u organizmu, ali smanjuje njegove negativne učinke na srce i druge organe. Ovaj učinak može se postići primjenom inzulina ili β2 agonista, a nekadašnje preporuke o primjeni bikarbonata danas nisu važeće (učinak nastupa nakon dužega vremena, a dovodi i do stvaranja kompleksa s kalcijem što nije poželjno kod ovih bolesnika). Inzulin potiče unutrastanični pomak kalija, a u ove svrhe primjenjuje se brzodjelujući inzulin (inzulin aspart) zajedno s otopinom glukoze (12 jedinica inzulina u 500 ml 5 %-tne glukoze) kako bi se prevenirao nastanak hipoglikemije (kod bolesnika s hiperglikemijom primjena otopine glukoze nije potrebna). Učinak inzulina na sniženje vrijednosti kalija vidi se kroz 60 minuta. Inhalacijska primjena slabutamola (10 - 20 mg tijekom deset minuta) može biti korisna terapijska mjera koja se koristi kao nadopuna ostalima. Učinak slabutamola na sniženje vrijednosti kalija očekuje se kroz 90 minuta.
Poticanje izlučivanja kalija edina je metoda kojom se smanjuje ukupna količina kalija u organizmu. Ona se ostvaruje primjenom diuretika Henleove petlje (20 - 40 mg furosemida), a u najtežim oblicima indicirano je i liječenje hemodijalizom (ako se hiperkalijemija ne može riješiti primjenom prethodno navedenih metoda liječenja).
Ostale metode liječenja. Kod bolesnika s kroničnom bolesti bubrega kod kojih se očekuje razvoj hiperkalijemije primjenjuju se peroralni izmjenjivači kationa, kao što su polistreni. Najčešće se primjenjuje polistiren sulfonat koji uklanja kalij preko crijevne sluznice uz dodatak sorbitola (laksativ) kako bi se osigurao njegov prolazak kroz crijevo. U slučaju razvoja kompletnoga AV-bloka, indicirana je privremena elektrostimulacija.
POREMEĆAJI KONCENTRACIJE KALCIJA
Fiziologija. Kalcij je najzastupljeniji elektrolit u ljudskom organizmu i prosječna odrasla osoba sadrži i do 1000 grama kalcija, od čega se 99 % nalazi u koštanom tkivu, dok se ostatak nalazi u tkivima i ekstracelularnoj tekućini, uključujući i plazmu. U plazmi se kalcij nalazi u dva oblika: jednu polovicu čini ionizirani kalcij koji je ujedno i biološki aktivan, a druga je polovica biološki neaktivna i u najvećem dijelu dolazi vezana za proteine, a manjim dijelom dolazi u kompleksu s fosfatima ili sulfatima. Zbog toga sniženje vrijednosti proteina u plazmi rezultira sniženjem ukupne vrijednosti kalcija, dok to ne utječe na sniženje ioniziranoga kalcija, stoga se u uvjetima hipoproteinemije vrijednost kalcija procjenjuje prema vrijednosti ioniziranoga kalcija. Kalcij se unosi putem probavnoga sustava, dijelom se apsorbira iz tankoga crijeva pasivnim transportom, a dijelom aktivnim uz pomoć vitamina D. Kalcij osim u izgradnji kostiju sudjeluje i u neuromišićnoj transmisiji, mišićnoj kontrakciji i koagulacijskom sustavu. Na homeostazu kalcija u najvećoj mjeri utječu paratireoidni hormon i vitamin D (detaljno opisano u poglavlju Poremećaji koštanoga metabolizma).
HIPOKALCIJEMIJA
Definicija i etiologija. Hipokalcijemija se definira sniženim vrijednostima ioniziranoga kalcija, i to u vrijednosti nižoj od 2,0 mmol/L. Fiziološki odgovor organizma na smanjenje vrijednosti kalcija u plazmi pojačana je sinteza i lučenje paratireoidnoga hormona (PTH) i vitamina D, stoga će i razvoj hipokalcijemije najčešće biti uvjetovan smanjenim stvaranjem ili rezistencijom na paratireoidni hormon ili vitamin D. Osim toga, hipokalcijemija može nastati i kod bolesnika s hipomagnezijemijom, sepsom, akutnim pankreatitisom, rabdomiolizom, kao i uz primjenu nekih lijekova (kalcitonin, bisfosfonati, fenobarbiton, foskarnet i dr.) – Tablica 3.33.
|
Tablica 3.33. Etiologija hipokalcijemije
|
|
Hipokalcijemija uz hiperfosfatemiju
|
Hipokalcijemija bez hiperfosfatemije
|
|
Hipoparatireoidoza
Pseudohipoparatireidoza
Kronična bolest bubrega
Rabdomioliza
|
Poremećaji metabolizma vitamina D (manjak, rezistencija)
Hipomagenzijemija
Akutni pankreatitis
Sepsa, sindrom toksičnoga šoka
|
Klinička slika. Hipokalcijemija je kod većine bolesnika asimptomatska, a klinička slika se postupno razvija. Simptomi i znakovi nastaju kao posljedica poremećaja membranskoga potencijala neuromišićnih stanica (mišićni grčevi, tetanija, generalizirane konvulzije, laringospazam) te kardiomiocita (srčane aritmije). Klasični znakovi kod fizikalnoga pregleda su Chvostekov i Trousseauov znak. Chvostekov znak podrazumijeva grčenje perokularnoga i perioralnog mišića u odgovoru na mehaničko podraživanje facijalisa (lupkanje prstom), a Trousseauov znak podrazumijeva razvoj karpalnoga spazma nakon podražaja u vidu napuhivanja manžete tlakomjera oko nadlaktice tijekom nekoliko minuta.
Dijagnoza se postavlja na osnovi kliničke slike i kliničkoga pregleda, laboratorijskoga nalaza sniženih vrijednosti ioniziranoga kalcija u plazmi, a u svrhu diferenciranja uzroka preporuča se i određivanje vrijednosti fosfora.
Liječenje hipokalcijemije u prvome je redu etiološko, a nadoknada kalcija vrši se samo kod bolesnika s razvijenim simptomima hipokalcijemije. Nadoknada kalcija vrši se njegovom parenteralnom primjenom u vidu kalcijeva klorida ili kalcijeva glukonata (Tablica 3.34.). Nadoknada se vrši primjenom kalcija u obliku intravenskoga bolusa (200 mg elementarnoga kalcija u 100 mL izotonične otopine tijekom deset minuta), a zatim se nastavlja u obliku kontinuirane infuzije u dozi od 1 - 2 mg/kg/h tijekom šest do dvanaest sati. Tijekom prvih nekoliko sati vrijednosti kalcija prate se svakih sat vremena.
|
Tablica 3.34. Otopine kalcija za parenteralnu nadoknadu
|
|
Otopina kalcija
|
Sadržaj kalcija
|
Volumen
|
Osmolalnost
|
|
10 % kalcij klorid
|
27 mg/mL
|
10 mL
|
2000 mOsm/kg
|
|
10 % kalcij glukonat
|
9 mg/L
|
10 mL
|
680 mOsm/kg
|
HIPERKALCIJEMIJA
Definicija i etiologija. Hiperkalcijemija se definira kao povišena vrijednost ioniziranoga kalcija, i to u vrijednosti višoj od 2,6 mmol/L. Uzroke hiperkalcijemije dijelimo u dvije skupine prema ovisnosti o paratireoidnom hormonu (Tablica 3.35.). Najčešći uzrok predstavlja hiperparatireoidizam koji dovodi do neprimjerenoga lučenja PTH hormona koji svojim učincima dovodi do povećanja plazmatske koncentracije kalcija. Obiteljska hipokalciurična hiperkalcijemija predstavlja rijetko autosmono-dominantno stanje koje nastaje uslijed mutacije receptora osjetljivih na kalcij koje nalazimo na paratireoidnim žlijezdama posljedično čemu one ne mogu registrirati stvarnu ekstracelularnu koncentraciju kalcija te dovode do prekomjernoga lučenja PTH hormona. Hiperkalcijemija neovisna o PTH-u najčešće je posljedica paraneoplastičkoga sindroma (tumori koji luče biološke tvari nalik PTH hormonu ili tvari nalik čimbeniku aktivacije osteoklasta).
|
Tablica 3.35. Najčešći uzroci hiperkalcijemije
|
|
Hiperkalcijemija ovisna o PTH-u
|
Hiperkalcijemija neovisna o PTH-u
|
|
Primarna hiperparatireoidoza
Obiteljska hipokalciurična hiperkalcijemija
Terapija litijem
Sekundarna i tercijarna hiperparatireoidoza
|
Maligne bolesti (paraneoplastični sindrom)
Lijekovi i intoksikacije (vitamin A i D, tiazidi, litij)
Endokrine bolesti (adrenalna insuficijencija, akromegalija)
Imobilizacija, granulomatozne bolesti, Pagetova bolest
|
Klinička slika. Kliničke manfestacije hiperkalcijemije dijelimo u četiri skupine: gastrointestinalne (mučnina, povraćanje, konstipacija, ileus, pankreatitis), kardiovaskularne (hipovolemija, hipotenzija, skraćeni QT-interval), renalne (poliurija, nefrokalcinoza) te neurološke (konfuzija, slabost, poremećaji svijesti).
Dijagnoza se potvrđuje laboratorijskim nalazom povišene vrijednosti ioniziranoga kalcija, a daljnja obrada sa svrhom traženja uzroka podrazumijeva određivanje vrijednosti PTH hormona, vitamina D i druge specifične pretrage.
Liječenje hiperkalcijemije indicirano je kod bolesnika s kliničkim manifestacijama hiperkalcijemije, kao i kod asimptomatskih bolesnika ako vrijednosti ioniziranoga kalcija prelaze 3,5 mmol/L. U liječenju se primjenjuju infuzije fiziološke otopine, furosemid, kalcitonin, bisfosfonati, kortikosteroidi te hemodijaliza.
Osnovu liječenja čini infuzija izotone otopine natrijevoga klorida te primjena furosemida, dok se ostale mjere (smanjenje resorpcije kosti) primjenjuju u slučaju slaboga kliničkog odgovora na navedene lijekove. Lijekovi koji se primjenjuju u liječenju hiperkalcijemije navedeni su u Tablici 3.36.
|
Tablica 3.36. Liječenje hiperkalcijemije
|
|
Lijek
|
Doza
|
Napomena
|
|
Izotonična otopina NaCl-a
|
200 - 500 ml/h,
Održavati diurezu 150 ml/h
|
Smanjuje vrijednost kalcija, nedostatno kao jedina terapija
|
|
Furosemid
|
40 - 80 mg iv svaka 2 sata,
Održavati diurezu 150 ml/h
|
Potiče izlučivanje kalcija urinom, moguć razvoj hipovolemije
|
|
Kalcitonin
|
4 jedinice/kg sc ili im,
Ponavljati svakih 12 sati
|
Danas se ne preporuča zbog nuspojava i razvoja tahifilaksije
|
|
Bisfosfonati
|
Zoledronat (4 - 8 mg iv/15 min)
Pamidronat (90 mg iv/2h
|
Lijekovi prvog izbora, učinak vidljiv tek za dva dana
|
|
Kortikosteroidi
|
Prednizon (20 - 100 mg po/dan)
Hidrokortizon (200 - 400 mg iv/dan)
|
Koristan kod limfoma i mijeloma, učinak vidljiv kroz četiri dana
|
POREMEĆAJI KONCENTRACIJE FOSFATA
Fiziologija. Fosfati zajedno s kalcijem predstavljaju osnovne minerale koji ulaze u sastav koštanoga matriksa, a osim toga sudjeluju i u energetskim staničnim procesima. Fosfati se u organizam unose hranom u obliku fosfora te se u najvećem dijelu apsorbiraju iz tankoga crijeva pasivnom difuzijom, dok se manji dio apsorbira aktivnim transportom uz pomoć vitamina D. Glavnu ulogu u regulaciji koncentracije fosfata u krvi imaju paratireoidni hormon te bubrezi. Paratireoidni hormon djeluje na bubrege tako da smanjuje reapsorpciju fosfata u proksimalnim tubulima čime se povećava njihovo izlučivanje iz organizma. Također, na vrijednosti fosfata utječe i vitamin D jer smanjenje koncentracije fosfata u krvi potiče sintezu aktivnoga oblika vitamina D koji potom djeluje na povećanje crijevne apsorpcije fosfata i regulacije hipofosfatemije.
HIPOFOSFATEMIJA
Definicija i etiologija. Hipofosfatemija označava stanje snižene vrijednosti fosfata u krvi, i to u vrijednosti nižoj od 2,5 mg/dL (ili 0,8 mmol/L). Smatra se da je hipofosfatemija relativno čest elektrolitski poremećaj u kliničkoj praksi, iako je njegovu stvarnu učestalost teško procijeniti s obzirom na njihovo rijetko određivanje. Učestalost hipofosfatemije kod bolesnika u jedinicama intenzivnoga liječenja kreće se i do 30 %. Hipofosfatemija najčešće nastaje kao posljedica unutarstaničnoga pomaka, ali može biti uzrokovana i povećanim bubrežnim izlučivanjem te smanjenom apsorpcijom iz probavnoga sustava.
Unutarstanični pomak fosfata najčešći je uzrok hipofosfatemije u kliničkoj praksi, a može se javiti u sljedećim stanjima: 1) pojačan unos glukoze nakon gladovanja ili stanje hiperglikemije uz početak primjene inzulina (pojačan unos glukoze u stanice praćen je istodobnim povlačenjem i ulaskom fosfata u stanice); 2) respiratorna alkaloza (alkaloza povećava unutarstanični pH koji dovodi do ubrzane glikolize što uvjetuje pojačanu utilizaciju glukoze iz krvi u stanice, a s njom i fosfata); 3) stimulacija β-adrenergičkih receptora (aktivacijom β receptora pojačava se utok fosfata u stanice, a klinički se to najčešće viđa kod bolesnika koji uzimaju visoke doze bronhodilatatora iz skupine β agonista) te 4) sistemska upala (u stanjima upale povećano je iskorištavanje fosfata u aktiviranim neutrofilima).
Smanjena crijevna apsorpcija fosfata vidi se kod bolesnika s malapsorpcijskim sindromom, manjkom vitamina D te pri uzimanju antacida koji vežu fosfate (aluminij-hidroksid, kalcij-acetat, kalcij-fosfat), dok se povećano bubrežno izlučivanje fosfata najčešće vidi kod bolesnika s hiperparatireoidizmom i bubrežnim tubulopatijama, a može se javiti i kod bolesnika s hipokalijemijom i hipomagnezijemijom.
Klinička slika i dijagnoza. Kliničke manifestacije hipofosfatemije su nespecifične i teže se prepoznaju, a povezane su sa staničnom hipoenergozom budući da fosfati sudjeluju u staničnim procesima koji osiguravaju izvor energije za stanične potrebe. Najčešće kliničke manifestacije su: mišićna slabost (kod bolesnika u jedinici intenzivnoga liječenja ona može biti povezana sa slabošću respiratornih mišića i težim odvajanjem od mehaničke ventilacije), sindrom srčanoga popuštanja i snižena ejekcijska frakcija (oslabljena kontraktilnost miokarda) te znakovi smanjene funkcije središnjega živčanog sustava (konfuzija, parestezije, delirij, koma). Dijagnoza se potvrđuje laboratorijskim mjerenjem vrijednosti fosfata u krvi, a diferencijacija uzroka temelji se na anamnezi, kliničkoj slici i kliničkom nalazu, a od pomoći nam je i laboratorijski izračun frakcijskoga izlučivanja fosfata mokraćom (kod nebubrežnih uzroka frakcija izlučivanja fosfata mokraćom je snižena, tj. manja od 5 %, jer su bubrezi u stanju odgovoriti na hipofosfatemiju smanjenim izlučivanjem fosfata, dok je ona kod bubrežnih uzroka povišena, više od 20 %).
Liječenje. Intravenska nadoknada fosfata indicirana je kod bolesnika s teškom hiposfatemijom (< 1 mg/dL), kao i kod bolesnika sa specifičnim kliničkim manifestacijama (npr. sindrom srčanoga popuštanja). Ona se postiže primjenom otopine natrij-fosfata ili kalijevoga fosfata prema dozi prikazanoj u Tablici 3.37. Dozu održavanja čini peroralna supstitucija fosfata u dozi od 1200 mg/dan ili u određenim slučajevima (malapsorpcija) intravenska supstitucija u dozi od 800 mg/dan.
|
Tablica 3.37. Liječenje hipofosfatemije
|
|
Vrijednosti fosfata
|
40 - 60 kg
|
61 - 80 kg
|
81 - 120 kg
|
|
< 1 mg/dL
|
30 mmol
|
40 mmol
|
50 mmol
|
|
1,1 - 1,7 mg/dL
|
20 mmol
|
30 mmol
|
40 mmol
|
|
1,8 - 2,5 mg/dL
|
10 mmol
|
15 mmol
|
20 mmol
|
|
Napomena: 1 ml natrij-fosfata ili 1 ml kalij fosfata sadrži 3 mmol ili 93 mg fosfata.
|
HIPERFOSFATEMIJA
Definicija i etiologija. Hiperfosfatemija se definira kao stanje povišenih vrijednosti fosfata u krvi, i to u vrijednostima višima od 4,5 mg/dL. Ona može nastati kao posljedica povećane apsorpcije iz probavnoga sustava (prekomjeran unos mlijeka bogatog fosfatima, hipervitaminoza D), povećanoga oslobađanja iz stanica (sindrom lize tumora, rabdomioliza, crijevna ishemija, acidoza) ili smanjenoga izlučivanja putem bubrega (hipoparatireoidizam, kronična bolest bubrega).
Klinička slika i dijagnoza. Kliničke manifestacije uključuju stvaranje netopljivih kompleksa s kalcijem koji se potom odlažu u meka tkiva te posljedične hipokalcijemije (neuromišićna slabost, tetanija, produljenje QT-intervala). Dijagnoza se potvrđuje laboratorijskim mjerenjem vrijednosti fosfata.
Liječenje hiperfosfatemije uključuje smanjen unos hrane bogate fosfatima, primjenu kelatora fosfata koji na sebe vežu fosfate u probavnoj cijevi i sprečavaju njegovu apsorpciju (sukralfatni antacidi) te peroralnu primjenu kalcija (kalcijev acetat). Kod težih oblika hiperfosfatemije indicirana je obilnija intravenska hidracija uz primjenu acetazolamida (4 x 500 mg). Kod najtežih oblika indicirano je liječenje hemodijalizom.
POREMEĆAJI KONCENTRACIJE MAGNEZIJA
Fiziologija. Magnezij predstavlja glavni intracelularni kation koji sudjeluje u staničnim energetskim procesima (procesima proizvodnje energije neophodne za stanični rad), a djeluje i na proces neurotransmisije (koči oslobađanje acetilkolina) te antagonizira učinak kalcija na staničnoj razini. Ukupna količina magnezija u organizmu iznosi 24 mg, od čega je polovica pohranjena u koštanom tkivu, dok drugu polovicu nalazimo u skeletnom mišićnom tkivu i jetri, a samo se oko 1 % ukupne količine nalazi u plazmi. Dvije trećine magnezija u plazmi nalazi se u ioniziranom (aktivnom) obliku, dok se jedna trećina nalazi vezana na proteine, nešto manje na fosfate ili sulfate. Magnezij se iz probavnoga sustava apsorbira uz pomoć aktivnoga oblika vitamina D, dok se njegovo izlučivanje vrši putem bubrega uvjetovano tubularnom reapsorpcijom.
HIPOMAGNEZIJEMIJA
Definicija i etiologija. Hipomagnezijemija označava stanje smanjene koncentracije magnezija u plazmi koja se definira vrijednostima ispod 0,7 mmol/L (ili 1,4 mEq/L). Učestalost hipomagnezijemije kod hospitaliziranih bolesnika procjenjuje se na oko 10 %, dok je kod kritično oboljelih osoba viša te može iznositi i do 60 %. Hipomagnezijemija može nastati uslijed smanjenoga unosa, redistribucije ili povećanoga gubitka (Tablica 3.38.).
|
Tablica 3.38. Etiologija hipomagnezijemije
|
|
Smanjeni unos
|
Redistribucija
|
Povećan gubitak
|
|
Proteinsko-kalorijska malnutricija
Totalna parenteralna prehrana
Alkoholizam
Infuzijske otopine bez magnezija
|
Porast cirkulirajućih katekolamina
Primjena simpatomimetika
Sistemska acidoza
Sindrom ponovnoga hranjenja
|
Probavni (proljev, povraćanje, fistule, zlouporaba laksativa)
Bubrežni (diuretici, poliurična faza akutnoga bubrežnog oštećenja)
|
Klinička slika i dijagnoza. Kliničke manifestacije su nespecifične, a najčešće su povezane s poremećajem srčanoga ritma (polimorfna ventrikularna tahikardija, torsades de pointes) te neurološkim poremećajima (tremor, parestezije, poremećaji stanja svijesti). Dijagnoza se postavlja laboratorijskim određivanjem vrijednosti magnezija u plazmi (< 0,7 mmol/L) ili u 24-satnom urinu (< 12 mmol).
Liječenje hipomagnezijemije čini supstitucijska terapija koja se može provoditi peroralno ili parenteralno (kod bolesnika s malapsorpcijskim sindromom). Najčešći peroralni oblici su magnezijev oksid, magnezijev klorid i magnezijev glukonat, dok se za parenteralnu nadoknadu koriste 12,5 %-tna i 50 %-tna otopina magnezijeva sulfata (50 %-tna otopina prije primjene se mora razrijediti s fiziološkom otopinom) – Tablica 3.39.
|
Tablica 3.39. Preparati za liječenje hipomagnezijemije
|
|
Preparat
|
Sadržaj magnezija
|
|
Peroralni preparati:
|
|
Magnezijev oksid (400 mg tbl)
|
241 mg (19,8 mEq)
|
|
Magnezijev oksid (140 mg tbl)
|
85 mg (6,9 mEq)
|
|
Magnezijev glukonat (500 mg tbl)
|
27 mg (2,3 mEq)
|
|
Parenteralni preparati:
|
|
Magnezijev sulfat 12,5%
|
500 mg/dL (4 mEq/L)
|
|
Magnezijev sulfat 50%
|
120 mg/dL (1 mEq/L)
|
U liječenju bolesnika s blagom i asimptomatskom hipomagnezijemom pretpostavljen deficit magnezija iznosi 1 do 2 mEq/kg, a s pretpostavkom da se 50 % supstituiranoga magnezija može izgubiti putem urina, primjenjuje se dvostruko viša doza magnezija od procijenjenoga deficita. Preporučeni režim nadoknade uključuje dozu od 1 mEq/kg tijekom prva 24 sata, a potom 0,5 mEq/kg/dan kroz sljedećih tri do pet dana.
Kod bolesnika s teškom hipomagnezijemijom nadoknada se vrši prema sljedećoj shemi: 1) 6 g magnezijeva sulfata dodaje se u 250 ili 500 ml fiziološke otopine koja se infundira kroz tri sata; 2) nastaviti infuziju 5 g magnezijeva sulfata u 250 ili 500 ml fiziološke otopine kroz sljedećih šest sati te 3) nastaviti s 5 g magnezijeva sulfata u 250 ili 500 ml fiziološke otopine tijekom 12 sati u sljedećih pet dana.
U slučaju ventrikularnih aritmija ili epileptičkih napadaja nadoknada magnezija vrši se prema sljedećoj shemi: 1) 2 g magnezijeva sulfata primjenjuje se kao intravenski bolus tijekom 2 - 5 minuta; 2) nadoknada se nastavlja s 5 g magnezijeva sulfata u 250 ili 500 ml fiziološke otopine tijekom sljedećih šest sati te 3) nastaviti s 5 g magnezijeva sulfata u 250 ili 500 ml fiziološke otopine svakih 12 sati kroz sljedećih pet dana.
Doza održavanja magnezija kod odraslih osoba kreće se u dozi od 5 mg/kg/dan.
HIPERMAGNEZIJEMIJA
Definicija i etiologija. Hipermagnezijemija podrazumijeva stanje povišenih vrijednosti magnezija u plazmi, i to u vrijednosti većoj od 1,05 mmol/L (ili 2,1 mEq/L). Ovaj elektrolitni poremećaj javlja se kod manje od 5 % hospitaliziranih bolesnika i većinom je povezan s oštećenom bubrežnom funkcijom. Najčešći uzroci hipermagnezijemije su povećan unos (laksativi i antacidi na bazi magnezija), akutno ili kronično oštećenje bubrežne funkcije te drugi, rjeđi uzroci (adrenalna insuficijencija, obiteljska hiperkalciurična hiperkalcijemija, primarna parahipertireoza, sindrom lize tumora i dr.).
Klinička slika i dijagnoza. Hipermagnezijemija je najčešće povezana s neuromišićnim i aritmogenim poremećajima, a ovisi o koncentraciji magnezija: hiporefleksija (> 4 mEq/L), PR prolongacija (> 5 mEq/L), potpuni atrioventrikularni blok (> 10 mEq/L) te srčani arest (> 13 mEq/L). Ove su promjene prvenstveno posljedica antagonizma učinka kalcija na kardiovaskularni sustav. Dijagnoza se potvrđuje laboratorijskim mjerenjem vrijednosti magnezija u krvi.
Liječenje. Osnovu liječenja čini hitna hemodijaliza, a primjena kalcijeva glukonata (1 g iv tijekom 2 do 3 minute) koristi se samo kao prijelazno rješenje za antagonizam učinaka magnezija na kardiocite. Kao mjera liječenja primjenjuje se i agresivna volumna nadoknada uz primjenu diuretika Henleove petlje.
SINDROM VIŠEORGANSKOGA ZATAJENJA
Definicija. Sindrom višeorganskoga zatajenja (MODS, od engl. multiple organ dysfunction syndrome) naziv je za klinički sindrom karakteriziran istodobnim poremećajem funkcije dvaju ili više organskih sustava koji se razvija kao posljedica različitih bolesti i stanja praćenih razvojem sistemskoga upalnog odgovora organizma (SIRS, od engl. systemic inflammatory response syndrome). Radi se o jednome od najtežih oboljenja u jedinici intenzivnoga liječenja i jednome od vodećih neposrednih uzroka smrtni kritično oboljelih osoba (50 – 80 %). Sindrom višestrukoga organskog zatajenja najčešća je dijagnoza kod bolesnika koji borave u jedinici intenzivnoga liječenja u vremenskom periodu duljem od 21 dana.
Etiopatogeneza. Sindrom višeorganskoga zatajenja može nastati uslijed bilo kojega uzroka koji može rezultirati razvojem SIRS-a: infekcija, upala, trauma ili ishemija (Tablica 3.40.). SIRS u svojoj osnovi predstavlja prekomjernu aktivaciju upalne kaskade koja uključuje elemente stanične i humoralne imunosti kao odgovora na neki početni događaj (noksu) i koja, ako se ne zaustavi, dovodi do oštećenja više organa i organskih sustava. Svako djelovanje nokse (upala, infekcija, trauma, ishemija) dovodi do lokalnoga oslobađanja proupalnih citokina iz efektorskih stanica (tkivni makrofagi, monociti, mastociti, aktivirani trombociti, aktivirane endotelne stanice), što dovodi do razvoja lokalne upalne reakcije. Jedan dio tih citokina dospijeva i u sistemsku cirkulaciju pri čemu uzrokuje sistemski upalni odgovor s ciljem pojačanja imunološke reakcije na početnu noksu. U ovoj se fazi osim proupalnih citokina pojavljuju i protuupalni citokini kojima se nastoji održati stanje homeostaze, odnosno koji ograničavaju i suprimiraju sistemski upalni odgovor. Ako dođe do prevlasti učinka proupalnih citokina (jaka noksa ili njezino produljeno djelovanje) razvit će se SIRS, odnosno nastat će značajna sistemska upalna reakcija s posljedičnom višeorganskom disfunkcijom.
|
Tablica 3.40. Etiologija sindroma višeorganskoga zatajenja
|
|
Sepsa i septički šok
Politrauma i traumatski šok
Opekline
Pankreatitis
Aspiracijska pneumonija
Masivna hemoragija i masivna transfuzija
Ishemijsko-reperfuzijska lezija
Mikrovaskularna tromboza
Intoksikacija salicilatima
|
Proupalni citokini. Kako je navedeno, osnovni događaj u nastanku SIRS-a lokalna je proizvodnja proupalnih citokina. Prvi citokini koji nastaju su TNF-α te IL-1 (nastaju u roku od jednoga sata od djelovanja nokse), a oni dalje aktiviraju nuklearni faktor-κB (NF-κB) koji djeluje kao stanični promotor stvaranja drugih proupalnih citokina kao što su IL-6, IL-8 te INF-γ. Osim toga, TNF-α i IL-1 odgovorni su i za nastanak vrućice, oslobađanje hormona stresa (kortizol, noradrenalin, vazopresin) te aktivaciju sustava renin-angiotenzin. Ostali citokini posreduju oslobađanje reaktanata akutne faze, kao što su C-reaktivni protein koji nastaje u jetri i prokalcitonin koji nastaje iz upalnih stanica. Svi skupa djeluju tako da dovode do aktivacije imunoloških stanica, komponenata komplementa, kao i koagulacijske kaskade koji u konačnici dovode do oštećenja tkiva i organa.
Aktivacija koagulacijske kaskade. Kako je navedeno, veliku ulogu u patogenezi sindroma višeorganskoga zatajenja ima i aktivacija koagulacijske kaskade. TNF-α i IL-1 izravno aktiviraju endotelne stanice koje potom eksprimiraju tkivni faktor kojime započinje koagulacijska kaskada. Osim toga, TNF-α i IL-1 imaju i antifibrinolitički učinak što se očituje kroz pojačanu proizvodnju PAI-1. Navedeni događaji rezultiraju nastankom mikrovaskularne tromboze, ishemije te razvojem potrošne koagulopatije.
Protuupalni citokini. Proizvodnja protuupalnih citokina javlja se kako bi se uspostavila ravnoteža između ove dvije skupine citokina i kako bi se spriječio razvoj SIRS-a. Glavni protuupalni citokini su IL-4 i IL-10, a njihov učinak opisuje se kao sindrom sistemskoga protuupalnog odgovora (CARS, od engl. counter inflammatory response syndrome) (Slika 3.19.). IL-4 i IL-10 taj učinak temeljno ostvaruju kočenjem stvaranja TNF-α, IL-1, IL-6 i IL-8, a smatra se da su i odgovori na nastanak antagonista receptora za TNF-α i IL-1.

Slika 3.19. Shematski prikaz patogeneze sindroma višeorganskoga zatajenja
Klinička slika. Sindrom višeorganskoga zatajenja klinički karakteriziraju simptomi i znakovi osnove bolesti ili stanja koju nalazimo u podlozi (noksa), prisutnost kliničkih kriterija SIRS-a te jasna klinička ili laboratorijska očitovanja poremećaja dva ili više organskih sustava. Klinički kriteriji SIRS-a su: 1) tjelesna temperatura viša od 38℃ ili niža od 36℃; 2) srčana frekvencija viša od 90/min; 3) respiratorna frekvencija veća od 20/min ili PaCO2 manji od 4,3 kPa te 4) broj leukocita veći od 12000/µL ili manji od 4000/µL ili pojava više od 10 % nezrelih oblika leukocita u diferencijalnoj krvnoj slici. Najčešći klinički i laboratorijski pokazatelji sindroma višeorganskoga zatajenja prikazani su u Tablici 3.41.
|
Tablica 3.41. Najčešće kliničke manifestacije sindroma višeorganskoga zatajenja
|
|
Organski sustav
|
Kliničke manifestacije
|
Laboratorijski nalazi
|
|
Kardiovaskularni sustav
|
Tahikardija, hipotenzija
Stenokardija, dispneja
Poremećaji srčanoga ritma
|
Porast kardioselektivnih enzima
Porast NTproBNP-a
|
|
Respiratorni sustav
|
Dispneja, tahipneja
Centralna cijanoza
Disanje pomoćnom muskulaturom
|
Hipoksemija
Hiperkapnija
Respiracijska acidoza
|
|
Neurološki sustav
|
Poremećaj stanja svijesti
Epiletični napadaji
Žarišni neurološki deficit (rjeđe)
|
Hipo/hipernatrijemija
Hiperosmolarnost seruma
Hiperamonijemija
|
|
Uropoetski sustav
|
Smanjenje satne diureze
Oligurija (< 400 ml/dan)
Anurija (< 100 ml/dan)
|
Porast ureje i kreatinina
Metabolička acidoza
Hiperkalijemija
|
|
Gastrointestinalni sustav
|
Hipoperistaltika, distenzija trbuha
Retencija želučanog sadržaja
Krvarenje
|
Porast laktat dehidrogenaze
Porast vrijednost ureje
|
|
Hepatobilijarni sustav
|
Ikterus, subikterus
Znaci hemoragijske dijateze
Encefalopatija
|
Hiperbilirubinemija
Porast kolestatskih biljega
Produljen PV, snižena kolinesteraza
|
|
Hematološki sustav
|
Izrazita bljedoća (anemija)
Hemoragijska dijateza (petehije)
Manifestna krvarenja
|
Trombocitopenija, anemija
Produljen PV, aPTV
Snižen fibrinogen, AT III (DIK)
|
Dijagnoza sindroma višeorganskoga zatajenja postavlja se na osnovi anamnestičkih podataka (bolest u podlozi) te kliničkih i laboratorijskih nalaza. Ovisno o kliničkom stanju i kliničkim indikacijama, dijagnostička se obrada može proširiti specifičnim pretragama (RTG srca i pluća i ehokardiografija u evaluaciji kardiorespiratornoga sustava; CT mozga kod sumnje na intrakranijsko zbivanje; nativni RTG snimak abdomena, UZV ili CT abdomena kod sumnje na akutno intraabdominalno zbivanje; gastroskopija kod sumnje ili manifestnoga krvarenja iz probavnoga sustava i sl.).
Liječenje se sastoji od liječenja uzročne bolesti ili stanja koje nalazimo u podlozi te potpornih i simptomatskih mjera koje ovise o zahvaćenosti pojedinih organa, odnosno organskih sustava: 1) kardiovaskularni sustav (volumna nadoknada, liječenje inotropima i/ili vazoaktivnim lijekovima, zbrinjavanje poremećaja srčanoga ritma); 2) respiratorni sustav (oksigenoterapija, neinvazivna ili invazivna mehanička ventilacija); 3) neurološki sustav (antiedematozna terapija, sedacija u svrhu neuroprotekcije i suzbijanja napada); 4) uropoetski sustav (stimulacija diureze volumenom i diureticima, metode kontinuirane hemodijalize, prilagodba doza lijekova); 5) gastrointestinalni sustav (primjena prokinetika, gastroprotekcija inhibitorima protonske pumpe, mehanička dekompresija nazogastričnom ili rektalnom sondom); 6) hepatobilijarni sustav (primjena albumina, svježe smrznute plazme, vitamina K, primjena laksativa kod hiperamonijemije, prilagodba doze lijekova, u najtežim oblicima metode albuminske dijalize), hematološki sustav (transfuzije koncentriranih eritrocita, trombocita, svježe smrznute plazme, krioprecipitata i sl.). Detaljnije je o navedenim mjerama liječenja pisano je u pojedinim dijelovima teksta.
Prognoza. Unatoč metodama nadzora i terapije u jedinici intenzivnoga liječenja, sindrom višeorganskoga zatajenja povezan je s visokom stopom smrtnosti. Tako kod istodobnoga zatajenja dva organska sustava stopa smrtnosti iznosi 60 %, kod zatajenja tri organska sustava 80 %, dok je kod zatajenja četiri ili više organska sustava stopa smrtnosti gotovo 100 %-tna.
AKUTNO OTROVANJE (INTOKSIKACIJE)
Akutno otrovanje predstavlja patološko stanje koje nastaje kao posljedica izlaganja ili unosa otrova u organizam, što se očituje poremećajem jednoga ili više organskih sustava. Otrov ili toksin je naziv za svaku kemijsku tvar koja može dovesti do poremećaja stanične građe ili funkcije, uvjetovano njegovim fizikalnim i/ili kemijskim svojstvima ili njegovoj dozi. Prema načinu nastanka, akutna otrovanja mogu biti namjerna ili slučajna. Namjerna trovanja najčešće su posljedica pokušaja suicida, što se najčešće pokušava prekomjernim uzimanjem lijekova. Osim lijekova, ostali uzroci akutnoga otrovanja mogu biti kiseline i lužine, alkoholi (etilni i metilni alkohol, glikol), ugljični monoksid, teški metali (olovo, litij) te druga kemijska sredstva (insekticidi, herbicidi, rodenticidi) i dr. Akutna otrovanja čine oko 5 % prijema u jedinicu intenzivnoga liječenja, a procijenjena ukupna stopa smrtnosti takvih bolesnika iznosi oko 0,05 do 0,1 %. U nastavku teksta bit će opisan klinički pristup bolesniku s akutnim otrovanjem te najčešći oblici akutnoga otrovanja.
KLINIČKI PRISTUP BOLESNIKU S AKUTNIM OTROVANJEM
Opći klinički pristup akutno otrovanome bolesniku sastoji se od sljedećih koraka: 1) procjena i stabilizacija vitalnih parametara; 2) identifikacija otrova; 3) sprečavanje apsorpcije otrova; 4) poticanje eliminacije otrova te 5) primjena specifičnih antidota.
Procjena i stabilizacija vitalnih parametara osnovni je korak u pristupu akutno otrovanome bolesniku. Klinički pregled i inicijalna procjena temelje se na metodi ABCDE pregleda koji obuhvaća procjenu ugroženosti dišnoga puta, nezadovoljavajućega disanja, neodgovarajuće cirkulacije te brzu neurološku procjenu. Svaki poremećaj uočen tijekom pregleda mora se odmah rješavati i tek se onda prelazi na sljedeći korak u procjeni. Ako se radi o bolesniku u kardijalnom arestu, započinje se s mjerama kardiopulmonalne reanimacije.
Osiguranje dišnoga puta postiže se postavljanjem bolesnika u stabilan bočni položaj ili primjenom pomagala kao što su orofaringealni ili nazofarinegalni tubus, primjenom supraglotičkoga pomagala (laringealna maska, I-gel) ili endotrahealnom intubacijom. Izbor metode ponajprije ovisi o bolesnikovom stanju svijesti. Ako je bolesnik somnolentan ili soporozan, često je dostatan stabilan bočni položaj za održavanje dišnoga puta, dok je kod komatoznih bolesnika apsolutno indicirana primjena nekoga od navedenih pomagala.
Metode potpomognutoga disanja obuhvaćaju primjenu kisika (oksigenoterapija), manualnu ventilaciju samoširećim balonom (ambu-balon) ili primjenom ventilatora (mehanička ventilacija). One su indicirane samo kada bolesnik ima nezadovoljavajuće disanje i nakon osiguranja prohodnosti dišnoga puta. Procjena dostatnosti respiratorne funkcije počiva na promatranju bolesnika (cijanoza, frekvencija disanja), pulsnoj oksimetriji te plinskoj analizi arterijske krvi.
Hemodinamska stabilizacija postiže se intravenskom nadoknadom tekućine te primjenom vazoaktivnih lijekova (inotropi, vazopresori) prema potrebi. Procjenu hemodinamike vršimo mjerenjem krvnoga tlaka, praćenjem kapilarnoga punjenja te određivanjem vrijednosti laktata koji predstavljaju najpouzdaniji parametar tkivne perfuzije. Hemodinamska nestabilnost praćena je slabom tkivnom perfuzijom te prelaskom staničnoga metabolizma s aerobnoga na anaerobni put pri čemu nastaju laktati.
Brza neurološka procjena ima veliku diferencijalno-dijagnostičku ulogu, osobito kod bolesnika s poremećenim stanjem svijesti kod kojih se sumnja na akutno intrakranijsko zbivanje. Kod bolesnika se procjenjuje stanje svijesti (Glasgow coma scale, AVPU metoda), promatraju izgled i reaktivnost zjenica, uočavaju znakovi lateralizacije ili patoloških refleksa, odnosno odsutnost refleska (arefleksija).
Inicijalni pristup bolesniku sa sumnjom na akutno trovanje podrazumijeva i osiguranje venskih puteva, kateterizaciju mokraćnoga mjehura, postavljanje nazogastrične sonde (ako nije kontraindicirano) te osnovno praćenje (elektrokardiogram, krvni tlak, pulsna oksimetrija).
Identifikacija otrova. Točne podatke o vrsti, dozi i vremenu unosa otrova u organizam ponekad je nemoguće dobiti. Pri tome se služimo anamnestičkim podacima, najčešće od drugih ukućana ili osoba koje su bile na mjestu događaja (npr. ekipa hitne pomoći) gdje se mogu naći ostaci otrova, pakiranja i sl. Drugi je način identifikacije otrova laboratorijska toksikološka analiza koja se sastoji od metoda probira, potvrde i kvantifikacije toksične supstance pri čemu se najčešće uzorkuju krv i urin.
Sprječavanje apsorpcije otrova podrazumijeva metode kojima se nastoji spriječiti ili odgoditi apsorpcija toksične supstance s mjesta primjene u cirkulaciju. Najčešći postupci koji se primjenjuju s tom svrhom su oni koji se odnose na sprečavanje apsorpcije otrova iz probavnoga sustava: primjena aktivnoga ugljena, lavaža želuca, irigacija debeloga crijeva te primjena emetika i/ili laksativa.
Primjena aktivnog ugljena jedna je od najrasprostranjenijih i najstarijih metoda sprečavanja apsorpcije peroralno unesene otrovne supstance. Njegov se učinak temelji na sposobnosti adsorpcije određenih toksina iz probavnoga sustava na svoju površinu, a njegova je učinkovitost najjača kada se primijeni u najkraćemu mogućem roku od unosa otrova (najbolje unutar sat vremena). Ako je bolesnik pri svijesti, otopljeni ugljen treba popiti, a ako se radi o bolesniku bez svijesti, može se dati preko nazogastrične sonde (u uvjetima osiguranoga dišnog puta). Aktivni se ugljen uglavnom primjenjuje u jednoj dozi (4 do 7 tableta od 150 mg rastopiti u jedan do dva decilitra vode), iako je u nekim situacijama opravdana višestruka primjena (otrovanje karbamezipinom, dapsonom, teofilinom, fenobarbitalom i kininom).
Lavaža želuca označava postupak ispiranja želuca kojim se nastoji odstraniti peroralno unesena toksična supstanca kako bi se spriječila njezina daljnja apsorpcija. Lavaža želuca izvodi se putem sonde koja se plasira preko usta i jednjaka u želudac i kroz koju se preko lijevka na vanjskom kraju ulijeva oko 200 mL mlake vode nakon čega se lijevak spušta ispod razine želuca uslijed čega se tekućina i sadržaj iz želuca vraćaju van (princip spojenih posuda). Postupak se ponavlja sve dok iz želuca ne izlazi čista voda koju smo i ulili. Na kraju lavaže obično se preko uvedene sonde primjenjuje i aktivni ugljen. Postupak ima smisla provoditi samo ako se bolesnik javi unutar četiri sata od ingestije otrovne supstance, a osnovni je preduvjet očuvano stanje svijesti i refleksi gutanja i kašljanja, a ako se postupak provodi kod bolesnika bez svijesti ili u odsutnosti refleksa gutanja i kašljanja, bolesnicima se najprije mora zaštiti dišni put (endotrahealna intubacija) kako bi se spriječila aspiracija i aspiracijska pneumonija. Lavaža želuca kontraindicirana je nakon unosa kiselina i lužina, soli teških metala, benzina, petroleja ili otapala za boje.
Irigacija debelog crijeva u svrhu sprečavanja apsorpcije unesene otrovne supstance rijetko se izvodi, a vodi se istim načelima kao i lavaža želuca. Pri ispiranju debeloga crijeva obično se koristi otopina polietilen-glikola.
Primjena emetika i/ili laksativa u svrhu sprečavanja apsorpcije otrova iz probavnoga sustava, iako nekad često korištena (npr. primjena sirupa ipekakuane), danas nema veći značaj i ne preporuča se.
Poticanje eliminacije otrova odnosi se na metode kojima se nastoje eliminirati prethodno apsorbirane toksične supstance koje su ušle u sistemsku cirkulaciju, a najznačajnije su forsiranje diureze, alkalizacija ili acidifikacija urina te liječenje hemodijalizom.
Forsirana diureza ubrzava odstranjenje toksičnih supstanci koje se izlučuju iz organizma procesom glomerularne filtracije. Forsirana diureza postiže se pojačanom primjenom infuzijskih otopina, a opravdana je i primjena diuretika, osobito diuretika Henleove petlje.
Alkalizacija i acidifikacija urina također su metode koje pospješuju izlučivanje određenih toksičnih suspstanci, a postižu se promjenom stupnja ionizacije i topljivosti masti u urinu. Alkalizacija urina postiže se peroralnom primjenom natrijevoga hidrogenkarbonata, a acidifikacija primjenom citrata.
Liječenje hemodijalizom indicirano je za odstranjivanje toksičnih supstanci koje se mogu eliminirati procesom difuzije i/ili konvekcije, kada se radi o neposrednoj životnoj ugroženosti. Metoda hemoperfuzije s drvenim ugljenom danas se uglavnom rijetko provodi, a rezervirana je poglavito za eliminaciju toksičnih supstanci koje karakterizira izrazita liposolubilnost.
Primjena specifičnih antidota (protuotrova) predstavlja najznačajniji postupak u liječenju akutno otrovanih bolesnika. Antidot svojim djelovanjem poništava i neutralizira učinak toksične supstance u potpunosti te tako omogućava brzu rezoluciju kliničke slike trovanja. Neki od najčešćih i najpoznatiji antidota su acetilcistein za paracetamol, nalokson za opijate, flumazenil za benzodiazepine, atropin za organofosfate i dr. Primjena specifičnih antidota detaljnije je opisana u opisima najčešćih oblika akutnoga otrovanja.
NAJČEŠĆI OBLICI AKUTNOGA OTROVANJA
Najčešći oblici akutnoga otrovanja su otrovanja lijekovima i sredstvima ovisnosti, kiselinama i lužinama, alkoholom, ugljičnim monoksidom, organofosfatnim insekticidima te gljivama.
Akutno otrovanje lijekovima najčešći je oblik akutnoga otrovanja u kliničkoj praksi. Najčešće se radi o lijekovima s učinkom na središnji živčani sustav (benzodiazepini, triciklički antidepresivi, inhibitori monoaminoksidaze, karbamazepin), a moguće je i drugim lijekovima (beta blokatori, blokatori kalcijskih kanala, nesteroidni protuupalni lijekovi, paracetamol, varfarin). U daljnjem tekstu nabrojani su najčešći oblici akutnoga otrovanja lijekovima, no u slučaju bilo kakvoga otrovanja lijekovima, na svim uputama proizvođača nalaze se i detaljni opisi postupanja u takvim situacijama.
Benzodiazepini. Klinička slika predoziranja benzodiazepinima u prvome redu podrazumijeva depresiju središnjega živčanog sustava zbog čega se javlja pospanost i somnolencija, dok su teži poremećaji stanja svijesti (sopor, koma), kao i depresija centra za disanje rijetki i obično se javljaju kod bolesnika koji su uzimali i druge depresore središnjega živčanog sustava ili alkohol. Vitalni su znaci kod ovih bolesnika obično očuvani. Liječenje je kod većine bolesnika simptomatsko (hidracija, opservacija), a kod težih oblika indicirana je primjena antidota – flumazenil, kompetitivni benzodiazepinski antagonist koji se daje intravenski u dozi od 0,2 mg, a može se ponavljati u vremenskim intervalima od nekoliko minuta do ukupne doze od 1 mg. Kada je potrebno, moguća je i kontinuirana primjena putem infuzije u dozi od 0,1 do 0,4 mg/sat (infuziju treba prekidati svakih šest sati da bi se provjerilo treba li dalje nastavljati infuziju ili je došlo do potpunoga oporavaka stanja svijesti). Flumazenil je kontraindiciran kod bolesnika s epilepsijom zbog mogućega epileptogenog učinka. U slučaju značajne ugroženosti disanja indicirana je intubacija i mehanička ventilacija.
Triciklički antidepresivi. Predoziranje tricikličkim antidepresivima, osim izazivanja učinka na središnji živčani sustav (sedacija, zbunjenost, halucinacije, epileptički napadaji), može uzrokovati i poremećaje srčanoga ritma (bradikardni i tahikardni poremećaji srčanoga ritma) te ispoljiti antikolinergične učinke (midrijaza, paralitički ileus, retencija urina, hipertermija). Zbog potencijalno opasnih kliničkih manifestacija, predoziranje ovim lijekovima zahtijeva praćenje u jedinici intenzivnoga liječenja. Liječenje je simptomatsko: volumna nadoknada, respiratorna resuscitacija, liječenje srčanih aritmija, kupiranje epileptičkih napadaja i sl.
Inhibitori monoaminooksidaze. Predoziranje ovim lijekovima klinički se manifestira simptomima i znacima pojačane katekolaminske neurotransmisije: hipertenzija, tahikardija, tremor, znojenje, psihomotorna agitiranost, epileptički napadaji i sl. Liječenje je simptomatsko s naglaskom na ranoj i agresivnoj dekontaminaciji probavnoga sustava: ispiranje želuca i primjena aktivnoga ugljena. Primjena aktivnoga ugljena preporučena je u dva navrata: u prvom navratu primjenjuje se otopina koja sadrži 50 g aktivnoga ugljena u 400 mL vode (5 mL/kg), dok se u drugom navratu nakon šest sati primjenjuje otopina koja sadrži 20 g aktivnog ugljena u 400 mL vode (5 mL/kg).
Karbamazepin. Umjereno predoziranje karbamazepinom očituje se pospanošću, ataksijom, nistagmusom, nerazgovjetnim govorom, a česte su i pojave halucinacija, dok se kod teškoga predoziranja razvija teški poremećaj svijesti (koma), epileptički napadaji, respiratorna insuficijencija te hemodinamska nestabilnost. Liječenje se sastoji od simptomatskih mjera s obzirom na to da ne postoji antidot, a naglasak je, kao i kod otrovanja inhibitorima monoaminooksidaze, na agresivnoj dekontaminaciji probavnoga sustava.
Beta blokatori. Predoziranje beta blokatorima praćeno je razvojem teške bradikardije, poremećaja atrio-ventrikularnoga provođenja te hipokontraktilnošću što rezultira nastankom slike kardiogenoga šoka. Osim toga, mogu biti prisutni i poremećaji stanja svijesti, epileptički napadaji, bronhospazam i hipoglikemija. Liječenje je u prvom redu simptomatsko (volumna nadoknada, atropin, koncentrirana glukoza, diazepam). U slučaju izostanka oporavka nakon primjene tih mjera, primjenjuje se glukagon (povisuje unutarstaničnu razinu cAMP-a čime se povećava srčana frekvencija), a nekada može biti indicirana i privremena srčana elektrostimulacija.
Blokatori kalcijskih kanala. Glavne posljedice predoziranja blokatorima kalcijskih kanala su hipotenzija i bradikardija koje se nastoji korigirati nadoknadom volumena i primjenom atropina, a kod tvrdokorne bradikardije primjenjuje se glukagon.
Nesteroidini antireumatici. Predoziranje nesteroidnim protuupalnim lijekovima najčešće se prezentira probavnim smetnjama (mučnina, povraćanje, bol u trbuhu), a u težim se oblicima javljaju i simptomi središnjega živčanog sustava (vrtoglavica, glavobolja, somnolencija, koma, epileptički napadaji) te metabolička acidoza i akutno bubrežno oštećenje. Specifičnih antidota nema te se liječenje provodi simptomatskim mjerama. Preporučena je lavaža želuca uz opetovanu primjenu aktivnoga ugljena u kombinaciji s laksativima.
Paracetamol. Predoziranje paracetamolom (acetaminofen) jedno je od najčešćih uzroka akutne medikamentozne lezije jetre, a detaljno je opisana u poglavlju „Oštećenje jetre uzrokovano lijekovima i toksinima“.
Varfarin. Predoziranje peroralnim antikoagulantnim lijekom varfarinom (antagonist vitamina K) danas se sve češće susreće zbog njegove široke primjene u kliničkoj praksi (prevencija tromboembolijskih incidenata). Kliničke manifestacije predoziranja varfarinom povezane su s hemoragijskom dijatezom i pojavom krvarenja iz bilo kojega organa (hemoptiza, hematemeza, melena, epistaksa, intrakranijska hemoragija i sl.). Glavni laboratorijski pokazatelj predoziranja varfarinom produljeno je protrombinsko vrijeme (PV), odnosno povećan INR. Liječenje ovisi o vrijednosti INR-a i prisutnosti krvarenja, kako je to navedeno u Tablici 3.42., a temelji se na primjeni odgodi uzimanja varfarina, primjeni vitamina K (puni učinak se postiže za 6 do 12 sati) te u najtežim oblicima na primjeni svježe smrznute plazme.
|
Tablica 3.42. Liječenje predoziranja varfarinom
|
|
Klinički scenarij
|
Liječenje
|
|
Bez krvarenja, INR > 4
|
Pričekati 24 sata, ponoviti INR, prilagoditi dozu.
|
|
Bez krvarenja, INR > 6
|
Pričekati 24 do 48 sati, ponoviti INR, prilagoditi dozu.
|
|
Bez krvarenja, INR > 8
|
Primijeniti 1 do2 mg vitamina K, pričekati 48 sati, ponoviti INR, prilagoditi dozu.
|
|
Manje krvarenje
|
Primijeniti 1 do2 mg vitamina K, pričekati 48 sati, ponoviti INR, prilagoditi dozu.
|
|
Teško krvarenje
|
Primijeniti 5 do 10 mg vitamina K, primijeniti svježe smrznutu plazmu (10 ml/kg).
|
|
Opetovano krvarenje
|
Primijeniti 10 mg vitamina K 3 do 4 puta na dan uz svježe smrznutu plazmu po potrebi.
|
Akutna otrovanja sredstvima ovisnosti uključuju predoziranje kokainom, opijatima i opioidima, amfetaminom te ekstazijem (MDMA, 3,4-metilendioksimetamfetamin).
Kokain. Predoziranje kokainom može potencijalno imati fatalne ishode, s obzirom na njegove simpatomimetičke učinke posredovane pojačanim otpuštanjem noradrenalina. Osim njegovih učinaka na središnji živčani sustav, bolesnici imaju tremor, tuže se na bolove u prsima, dolazi do razvoja tahikardnih poremećaja srčanoga ritma, hipertenzije, a moguća je i pojava epileptičkoga napadaja. Prvi korak u liječenju čini intravenska primjena diazepama (5 - 10 mg), a kod teških hipertenzija moguća je i primjena fentolamina. Primjena beta blokatora kod tih je bolesnika kontraindicirana jer je ona posljedica povećane koncentracije noradrenalina pa bi se blokiranjem beta receptora razvila prekomjerna stimulacija alfa adrenergičkih receptora što bi moglo dovesti do izražene koronarne vazokonstrikcije i ishemije miokarda.
Opijati i opioidi. Predoziranje opijatima (ekstrakti opijumskoga maka) i opioidima (sintetski opijati) očituje se poremećajem stanje svijesti (somnolencija, sopor, koma), bradikardijom, bradipnejom, hipotermijom, retencijom urina i hipoperistaltikom. Zjenice su karakteristično uske, sitne i točkaste što se može vidjeti i kod akutnoga intrakranijskog zbivanja u području ponsa. Zbrinjavanje ovih bolesnika temelji se na zbrinjavanju osnovnih, vitalnih funkcija (disanje, cirkulacija) te primjeni antidota – naloksona. Nalokson se obično primjenjuje intravenski u dozi od 0,2 do 1 mg do ukupne doze od 5 do 10 mg. Terapijski cilj kod ovih bolesnika nije postizanje pune razine svijesti nego uspostavljanje samostalnoga i dostatnog disanja. Iznimno se nalokson može primijeniti i intramuskularno ili subkutano. U slučaju potrebe nalokson se može primijeniti i u obliku kontinuirane infuzije i to najčešće u dozi koja čini jednu trećine doze koja je bila potreba za uspostavu ponovnoga disanja tijekom jednoga sata (primjena u fiziološkoj otopini). U liječenju se primjenjuju i ostale nužne simptomatske metode liječenja.
Amfetamini i ecstasy. Predoziranje ovim sredstvima dovodi do karakterističnih simpatomimetičkih kliničkih očitovanja kao što su preznojavanje, tremor, tahikardija, bolovi i opresije u prsištu, hipertenzija, hiperpireksija i sl. Zbog mogućnosti razvija malignih srčanih aritmija, bolesnike je potrebno nadzirati u akutnoj fazi. Liječenje je isključivo simptomatsko uz napomenu da se izbjegava primjena beta blokatora.
Akutno otrovanje kiselinama i lužinama nekada je bio jedan od najčešćih načina pokušaja suicida (ingestija kiselina ili lužina), dok se ono danas rjeđe susreće (slabija dostupnost u slobodnoj prodaji), i to obično kao slučajna intoksikacija. Najčešće kiseline koje se povezuju s ovim načinom otrovanja su klorovodična kiselina, sumporna kiselina, fosforna kiselina i octena kiselina (esenc), dok su najčešće lužine natrijev hidroksid i natrijev hipoklorit. Takva su otrovanja u prvom redu povezana s teškim ozljedama usne šupljine, orofarinksa, jednjaka i želuca pri čemu kiseline izazivaju koagulacijsku nekrozu, dok lužine izazivaju kolikvacijsku nekrozu te nose visoki rizik od nastanka potencijalno smrtonosnih komplikacija (perforacija jednjaka ili želuca s razvojem medijastinitisa ili peritonitisa, akutni respiratorni distres sindrom, metabolička acidoza ili alkaloza, razvoj šoka). Proces nekroze nije trenutan nego se razvija kroz tri do četiri dana, što i označava kritičan period.
Klinička slika. Težina kliničke slike ponajprije ovisi o vrsti (jačini) kaustika i unesene količine. Klinička se slika razvija vrlo brzo nakon ingestije kaustika, a uključuje jaku i žareću bol u prsima i trbuhu, mučninu i povraćanje često uz razvoj krvarenja (hematemeza). Promjene na orofarinksu i hipofarinksu dovode do stridora i promuklosti, a moguć je razvoj i aspiracijskoga penumonitisa s razvojem akutnoga respiratornog distres sindroma. Kod slabijih kaustika kliničke manifestacije ne moraju biti tako dramatične. Ako bolesnici prežive, postoji visoka vjerojatnost nastanka poslijeupalnih striktura organa probavne cijevi.
Dijagnoza se postavlja na osnovi kliničke slike i kliničkoga nalaza te anamnestičkih podataka. Kod svih bolesnika indicirana je klasična laboratorijska dijagnostika s ciljem pravovremenoga uočavanja komplikacija. Endoskopsku obradu treba učiniti što ranije (obično unutar dva do četiri sata od ingestije) uz izbjegavanje insuflacije prevelike količine zraka kako bi se smanjio rizik od rupture. Ovisno o promjenama sluznice, razlikujemo četiri stupnja korozivnoga oštećenja jednjaka i želuca (Tablica 3.43.). Endoskopske preglede treba izbjegavati u vremenskom periodu između 5. i 15. dana od ingestije jer je tada najveća opasnost od nastanka perforacije. U dijagnostičkom postupku indicirana je i radiografska snimka srca i pluća te abdomena s ciljem uvoda u zahvaćenost plućnoga parenhima, kao i procjene perforacije jednjaka ili želuca (pneumomedijastinum, pneumoperitoneum).
|
Tablica 3.43. Endoskopski nalaz korozivnih oštećenja organa probavne cijevi
|
|
Stupanj
|
Izgled i rizik od strikture
|
|
Prvi stupanj (I)
|
Hiperemija sluznice; dekvamacija površinskoga epitela. Mali rizik, strikture rijetke.
|
|
Drugi stupanj (II)
|
Hiperemija sluznice; nastanak bula, eksudati sluznice. Rizik od strikture iznosi 15 - 30%.
|
|
Treći A stupanj (IIIA)
|
Hiperemija sluznice; u cijelosti gubitak epitela jednjaka (segmentalno). Rizik od strikture iznosi do 100 %.
|
|
Treći B stupanj (IIIB)
|
Hiperemija sluznice; u cijelosti gubitak epitela jednjaka (difuzno). Rizik od strikture iznosi do 100 %.
|
Liječenje. Osnovni korak u liječenju ovih bolesnika je postizanje hemodinamske i respiratorne stabilizacije: oksigenoterapija, prema potrebi intubacija i mehanička ventilacija, volumna nadoknada, primjena vazopresora i sl. Izazivanje povraćanja i lavaža želuca kod ovih je bolesnika strogo indicirana, kao i izazivanje neutralizacije (primjena kiseline kod ingestije lužine i obrnuto) jer je proces neutralizacije egzoterman proces pri čemu se oslobađa toplinska energija koja dodatno može uzrokovati oštećenja. Primjenjuju se i ostale simptomatske mjere kao što je analgezija, gastroprotekcija i primjena antibiotika, dok je primjena kortikosteroida opravdana u cilju smanjenja rizika od nastanka strikture, ali mora se davati s oprezom i ne u prvim danima. Unatoč poduzetim mjerama liječenja, smrtnost ovih bolesnika kreće se i do 70 %.
Osim ingestijom, kiseline i lužine mogu biti unesene preko kože (opekline) ili inhalacijom njihovih para što dovodi prvenstveno do oštećenja sluznice dišnih puteva te razvoja pneumonitisa. U najtežim slučajevima razvija se akutni respiratorni distres sindrom. Liječenje se sastoji od respiratorne potpore (oksigenoterapija, mehanička ventilacija) te primjene kortikosteroida.
Akutno otrovanje alkoholima. U kliničkoj praksi najčešće se susreće akutno otrovanje etilnim alkoholima, a moguća su i trovanja metilnim alkoholom i etilen glikolom.
Etilni alkohol (etanol). Akutno otrovanje etilnim alkoholom najčešće nastaje uslijed prekomjernoga unosa alkoholnih pića koja sadrže različit postotak etanola. Metabolizam etilnoga alkohola opisan je u poglavlju „Alkoholna bolest jetre“. Klinička slika akutnoga otrovanja etilnim alkoholom podrazumijeva sedam stadija, a ovisi o količini unesenoga alkohola, odnosno njegovoj koncentraciji u serumu (Tablica 3.44.), iako to nije uvijek podudarno (nekada se teška klinička slika vidi i kod bolesnika sa značajno nižim koncentracijama i obrnuto).
|
Tablica 3.44. Klinička slika alkoholne intoksikacije
|
|
Klinički stupanj
|
Serumska koncentracija
|
Kliničke manifestacije
|
|
Prvi stupanj
|
0,1 - 0,5 ‰
|
Bez odstupanja u ponašanju
|
|
Drugi stupanj
|
0,3 - 1,2 ‰
|
Blaža euforija, dezinhibicija u ponašanju, gubitak koncentracije
|
|
Treći stupanj
|
0,9 - 2,5 ‰
|
Ekscitiranost, izražena dezinhibicija u ponašanju, gubitak koordinacije
|
|
Četvrti stupanj
|
1,8 - 3,0 ‰
|
Mentalna konfuzija, agresija, vrtoglavica, nejasan govor, teturanje
|
|
Peti stupanj
|
2,7 - 4,0 ‰
|
Apatija, somnolencija, nemogućnost hodanja, mučnina, povraćanje
|
|
Šesti stupanj
|
3,5 - 5,0 ‰
|
Besvjesno stanje, očuvani vlastiti refleksi, povraćanje, inkontinencija
|
|
Sedmi stupanj
|
> 4,5 ‰
|
Respiratorna paraliza, smrt
|
Liječenje podrazumijeva želučanu lavažu ako je od ingestije prošlo manje od jednoga do dva sata uz zaštitu dišnoga puta ako je bolesnik bez svijesti ili nesuradljiv. Liječenje je simptomatsko (peroralna ili parenteralna rehidracija), a osnovni postupak uključuje opservaciju bolesnika zbog mogućnosti pada i ozljeđivanja, povraćanja i aspiracije ili zatajenja respiracije. Prije primjene infuzije 5 %-tne glukoze bolesnicima se treba nadoknaditi tiamin (vitamin B1) koji nedostaje kroničnim alkoholičarima, a time se sprečava razvoj Wernickove encefalopatije. Liječenje hemodijalizom indicirano je kod bolesnika s teškim oblikom akutnoga otrovanja etanolom (respiracijska insuficijencija, metabolički i elektrolitni poremećaji). U pravilu niti jedan postupak osim hemodijalize neće ubrzati eliminaciju alkohola iz organizma.
Metilni alkohol (metanol). Ingestija metanola obično je slučajna. On se nalazi u sastavu razrjeđivača, antifriza i sl. Ovisno o količini unesenoga metanola, razlikujemo blago, umjereno i teško otrovanje. Vremenski period od ingestije do pojave kliničkih manfestacija može iznositi 1 do 72 sata, najčešće 24 sata. Blago otrovanje karakteriziraju glavobolja, umor i mučnina te su moguće smetnje vida. Umjereno teško otrovanje karakterizirano je jače izraženim simptomima središnjega živčanog sustava (poremećaj stanja svijesti), dok teško otrovanje prate potpun gubitak stanja svijesti, respiratorna i hemodinamska nestabilnost te razvoj metaboličke acidoze. Liječenje se postiže ispiranjem želuca uz primjenu alkalizirane vode (20 g natrijeva hidrogenkarbonata na 1 L vode) ako od ingestije nije prošlo duže od 2 sata. Antidot metanolu je etanol koji ima veći afinitet za alkoholnu dehidrogenazu te tako koči razgradnju metanola do formaldehida i mravlje kiseline. Etanol se najčešće primjenjuje u obliku peroralno unesenih alkoholnih pića. Nastala metabolička acidoza liječi se intravenskom primjenom natrijeva hidrogenkarbonata. Kod bolesnika s teškom kliničkom slikom indicirano je liječenje hemodijalizom.
Etilen glikol. Trovanje etilen glikolom (antifrizom) najčešće je slučajno s obzirom na to da se radi o bezbojnoj tekućini bez mirisa, slatkastog okusa. Klinička slika otrovanja prolazi kroz tri faze: prva faza u kojoj dominiraju simptomi središnjega živčanog sustava (ataksija, karpopedalni spazmi, konvulzije, poremećaji stanja svijesti), druga faza u kojoj dominiraju metaboličke promjene i promjene kardiovaskularnoga i respiratornog sustava (metabolička acidoza, tahikardija, hipotenzija, miokarditis, pneumonitis, akutni respiratorni distres sindrom) te treća faza u kojoj dominira izlučivanje otrovnih tvari iz organizma te nastanak akutnoga bubrežnog oštećenja. Liječenje se sastoji od ispiranja želuca i primjene aktivnoga ugljena, kao i kod otrovanja metanolom, a i pri ovome se otrovanju također kao antidot primjenjuje etilni alkohol zbog većega afiniteta prema alkoholnoj dehidrogenazi čime se koči metabolizam etilen glikola i sprečava nastanak toksičnih metabolita. U najtežim oblicima indicirano je liječenje hemodijalizom.
Akutno otrovanje ugljičnim monoksidom. Ugljični monoksid je plin bez mirisa, boje i okusa koji nastaje izgaranjem organskih spojeva bez dovoljnoga pristupa zraka. Otrovanje ovim plinom obično se događa tijekom zimskih mjeseci uslijed zagrijavanja prostorija (izgaranje drva ili ugljena) ili izgaranjem koje nastaje u plinskim bojlerima u zatvorenim kupaonicama. Također, rad motora s unutarnjim izgaranjem u zatvorenim prostorima može biti izvor ugljičnoga monoksida (pokušaji suicida u zatvorenim garažama s upaljenim automobilima). Ugljični monoksid ima i do 200 puta veći afinitet vezanja za hemoglobin od kisika zbog čega se smanjuje doprema kisika svim tkivima i organima (sustavna hipoksija). Ovisno o težini otrovanja, tj. postotku karboksihemoglobina u krvi, razlikujemo tri stupnja otrovanja (Tablica 3.45.). Dijagnoza se postavlja na temelju kliničke slike, anamnestičkih podataka i određivanja koncentracije karboksihemoglobina (COHb) u krvi (vrijednosti više od 15 % potvrđuju dijagnozu). Osnovu liječenja čini primjena 100 %-tnoga kisika, bilo na masku ako bolesnik samostalno diše, bilo preko enotrahealnoga tubusa (mehanička ventilacija) ako bolesnik nedostatno ili uopće ne diše. Pri teškim oblicima trovanja ugljičnim monoksidom primjenu kisika treba obavljati u uvjetima hiperbarične komore. Smrtnost kod otrovanja ugljičnim monoksidom kreće se između 1 i 30 %.
|
Tablica 3.45. Klinička slika akutnoga otrovanja ugljičnim monoksidom
|
|
Stupanj i koncentracija COHb
|
Klinička slika
|
|
Blagi oblik (15 – 20 %)
|
Glavobolja, vrtoglavica, mučnina, povraćanje
|
|
Umjereno težak oblik (20 – 40 %)
|
Smetnje vida i koncentracije, stenokardija, dispneja, tahikardija
|
|
Teški oblik (40 – 70 %)
|
Konfuzija, razvoj kome, respiratorna i hemodinamska nestabilnost, smrt
|
Akutno otrovanje organofosfatima. Orgnofosfati su spojevi koji se upotrebljavaju kao insekticidi i kao bojni otrovi, a obično dolaze u obliku praha, tekućine ili raspršivača. Temeljni patofiziološki učinak organofosfata u ljudskom organizmu temelji se na inhibiciji enzima acetilkolinesteraze, a to dovodi do nakupljanja acetilkolina (neurotransmiter) u sinaptičkim pukotinama što uzrokuje neprimjerenu, ekscesivnu neurotransmisiju. U ljudskom organizmu razlikujemo tri oblika acetilkolinesteraze: acetlikolinesteraza u sinaptičkim pukotinama, acetilkolinesteraza vezana na eritrocite te serumska acetilkolinesteraza. Iako organofosfati inhibiraju sve oblike enzima, treba imati na umu da inhibicija serumske acetilkolinesteraze ne odražava inhibiciju acetilkolinesteraze u sinapsama te se zbog toga sniženje vrijednosti serumske acetilkolinesteraze smatra biljegom izloženosti organofosfatima (dijagnostički značaj), ali ne i njegove toksičnosti. Simptomi i znakovi otrovanja organofosfatima mogu biti svrstani u tri skupine ovisno o tome koji su receptori u sinaptičkim pukotinama hiperstimulirani: nikotinski znakovi, muskarinski znakovi te znakovi središnjega živčanog sustava (Tablica 3.46.).
|
Tablica 3.46. Klinička slika otrovanja organofosfatima
|
|
Muskarinske manifestacije
|
Nikotinske manifestacije
|
Manifestacije SŽS-a
|
|
Bronhokonstrikcija, bronhosekrecija;
Hiperhidroza, hipersalivacija;
Mučnina, povraćanje, proljev;
Inkontinencija stolice i urina;
Bradikardija, hipotenzija;
Mioza, nejasan vid.
|
Mišićne fascikulacije;
Opća slabost;
Tahikardija;
Hipertenzija;
Bljedilo;
Midrijaza.
|
Smetenost, zbunjenost;
Glavobolja;
Tremor, ataksija;
Smetnje govora;
Središnja depresija disanja;
Konvulzije, koma.
|
Dijagnoza se postavlja na osnovi kliničke slike, kliničkoga nalaza, anamnestičkih podataka te laboratorijske dijagnostike. Na izloženost organofosfatima ukazuju snižene vrijednosti serumske kolinesteraze, no pri tumačenju nalaza treba imati na umu da ona može biti i posljedica smanjene sinteze uslijed bolesti jetre. Kada je snižena serumska kolinesteraza (biljeg izloženosti), toksični učinak potvrđuje se mjerenjem aktivnosti acetilkolinesteraze (< 50 %), što je moguće samo u nekim laboratorijima. Detekcija organofosfatnih spojeva metodom plinske kromatografije moguća je, ali rijetko korištena metoda u dijagnostičkom postupku.
Liječenje se ponajprije sastoji od mjera resuscitacije vitalnih parametara (respiratorna i hemodinamska stabilizacija) nakon čega slijedi ispiranje želuca i primjena aktivnoga ugljena te specifično liječenje koje uključuje primjenu antidota. Glavni antidoti su atropin koji učinkovito uklanja muskarinske učinke otrovanja te oksimi, lijekovi koji imaju sposobnost reaktivacije acetilkolinesteraze. Atropin djeluje tako da inhibira acetilkolin i sprečava njime posredovanu ekscesivnu neurotransmisiju. Početna doza iznosi 2 do 5 mg kao intravenski bolus nakon čega slijedi kontinuirana infuzija u dozi od 0,02 do 0,08 mg/kg/sat. Lijek se daje sve do postizanja atropinizacije (smanjenje salivacije i bronhosekrecije) za što je često potrebno i po nekoliko grama atropina. Atropin ne djeluje na nikotinske znakove niti na znakove središnjega živčanog sustava. Zbog toga je potrebno započeti istodobno i s primjenom oksima, lijekova koji potpomažu reaktivaciju acetilkolinesteraze i to što ranije, svakako unutar 24 do 36 sati. Najčešće se primjenjuju pralidoksim i obidoksim. Pralidoksim se daje inicijalno u dozi od 1 do 2 g intravenski brzinom 0,5 mg/min, a zatim se nastavlja kontinuranom infuzijom u dozi od 0,5 mg/sat. Obidoksim se može primjenjivati u više dnevnih doza (4 - 6 g/kg svakih četiri do šest sati) ili u obliku kontinuirane infuzije u dozi od 0,5 mg/kg/sat. Prednost se daje primjeni pralidoksima. Lijekovi se primjenuju sve do kliničkoga oporavka što nekada može trajati i preko nekoliko tjedana. Praćenje vrijednosti serumske kolinesteraze nema veći učinak u odluci o prekidanju terapije (odluka o prekidu terapije donosi se samo na osnovi kliničkoga poboljšanja bolesnika).
Akutno otrovanje gljivama (micetizam). Akutno otrovanje gljivama danas se rjeđe susreće, a radi se o potencijalno po život opasnom otrovanju. U načelu razlikujemo dva oblika otrovanja gljivama: otrovanja s kratkim periodom latencije (do tri sata) i otrovanja s duljim periodom latencije (više od šest sati). Otrovanja s kratkim periodom latencije uglavnom se manifestiraju gastrointestinalnim smetnjama te se očekuje potpun oporavak uz simptomatske mjere liječenja, dok otrovanja s duljim periodom latencije imaju lošiju prognozu uz zahvaćanje parenhimatoznih organa. U nastavku teksta prikazani su najčešći oblici otrovanja gljivama te opća načela liječenja.
Faloidinski sindrom nastaje kao posljedica otrovanja gljivom zelenom pupavkom (lat. Amanita phalloides). Period latencije iznosi 6 do 12 sati nakon čega se javljaju simptomi nalik gastroenteritisu (abdominalni grčevi, mučnina, proljev, povraćanje) koji traju do nekoliko dana i tada se smiruju, a potom počinju rasti vrijednosti jetrenih enzima što ukazuje na postupan razvoj hepatocelularne nekroze, a kasnije hepatorenalnoga sindroma i sindroma višeorganskoga zatajenja. Smrtnost iznosi 50 do 90 %.
Giromitrinski sindrom nastaje kao posljedica otrovanja gljivom iz roda smrčaka (lat. Gyromitra esculenta). Period latencije iznosi 6 do 10 sati nakon čega slijede simptomi akutne alimentarne intoksikacije (grčevi, mučnina, povraćanje) uz pokazatelje hematološkoga, bubrežnoga i jetrenoga toksičnog oštećenja. Oporavak kliničkoga stanja očekuje se kroz nekoliko dana.
Muskarinski sindrom nastaje kao posljedica otrovanja od više vrsta gljiva: grlašice (lat. Clitocybe angustissima), muhare (lat. Amanita muscaria), zavodnice (lat. Omphallotus olearius), ludare (lat. Boletus satanas) i bljuvare (lat. Russula emetica). Period inkubacije je kratak, obično iznosi jedan sat, a simptomi su posljedica poremećaja muskarinske neurotransmisije: hipersalivacija, hiperlakrimacija, hiperhondroza, a kod unosa veće količine javljaju se i bolovi u trbuhu, otežano disanje, mučnina i povraćanje.
Panterinski sindrom nastaje kao posljedica otrovanja gljivama koje sadrže ibotensku kiselinu i muscimol, a to su panterovka (lat. Amanita pantherina) i muhara (lat. Amanita muscaria). Simptomi se javljaju unutar tri sata od konzumacije gljiva, a dominiraju znakovi alimentarne intoksikacije i halucinacije.
Liječenje akutnoga otrovanja gljivama pretežno je simptomatsko, osobito za otrovanja s kratkim periodom latencije. Osnovne mjere podrazumijevaju dekontaminaciju probavnoga sustava različitim mjerama, kao što je ispiranje želuca, primjena aktivnoga ugljena, irigacija crijeva i sl. Specifičnija terapija ovisi o pretpostavljenom uzroku otrovanja: penicilin kod otrovanja pupavkom, primjena atropina kod otrovanja koja se prezentiraju muskarinskim sindromom, kod trovanja giromitrom primjenjuje se piridoksin, a kod otrovanja za koje se pretpostavlja da su uzrokovana ibotenskom kiselinom i muscimolom primjenjuje se fizostigmin. Primjena hemodijalize u liječenju akutnoga otrovanja gljivama nije pokazala veće rezultate, ali je opravdana u slučaju razvoja akutnoga bubrežnog oštećenja.
Definicija. Rabdomioliza označava kliničko stanje karakterizirano difuznom nekrozom skeletnih mišića s posljedičnim oslobađanjem intracelularnih komponenata u sistemsku cirkulaciju, što može rezultirati različitim poremećajima, najčešće akutnim bubrežnim oštećenjem. Pojavnost ovoga sindroma procjenjuje se na 2 slučaja na 10 000 osoba u općoj populaciji, a najčešće je povezan s traumatskim oštećenjem mišića. Raspon kliničke težine rabdomiolize kreće se od asimptomatskoga povišenja mišićnih enzima (kreatin-kinaza, mioglobin) do teškoga, po život opasnoga elektrolitnog poremećaja i akutnoga bubrežnog oštećenja.
Etiopatogeneza. Osnovno patofiziološko zbivanje u rabdomiolizi podrazumijeva smrt i nekrozu miocita. Smrt miocita neposredno je povezana s porastom intracitoplazmatske koncentracije kalcija što se može javiti kao posljedica izravne ozljede staničnih membrana (ruptura sarkoleme) ili uslijed iscrpljenja stanične enregije i deplecije ATP-a potrebnoga za rad kalcijske pumpe koja sudjeluje u održavanju intracelularne homeostaze kalcija. Povećana intracitoplazmatska koncentracija kalcija odgovorna je za aktivaciju proteaza i razvoj mitohondrijske disfunkcije, što vodi stanicu u smrt. Nekrozom miocita dolazi do oslobađanja raznih intracelularnih komponenata u krv, poglavito elektrolita i mišićnih enzima, kao što su kreatin-kinaza i mioglobin te se posljedično tome razvija elektrolitni poremećaj (hiperkalijemija, hipokalcijemija, hiperuricemija, hiperfosfatemija, metabolička acidoza) te akutno bubrežno oštećenje (posljedica akutne tubularne nekroze uslijed tubularne opstrukcije mioglobinom). Navedena zbivanja mogu uzrokovati različiti fizikalni, biološki, kemijski i ostali etiološki čimbenici.
Fizikalni uzroci rabdomiolize su: 1) traumatsko oštećenje mišića (crush sindrom, prometne i druge ozljede, produljena imobilizacija); 2) pojačan mišićni rad (naporan fizički rad, stanje nakon dugotrajnoga epileptičkog napadaja, mišićni tremor u sklopu apstinencijskoga sindroma ili delirija i sl.); 3) mišićna hipoksija (tromboembolijski incident, komplikacija kirurških manipulacija) te 4) poremećaji tjelesne temperature (maligna hipertermija, maligni neuroleptički sindrom, hipertermija).
Kemijski, biološki i drugi uzroci rabdomiolize su: 1) lijekovi i toksini (statini, fibrati, antihistaminici, antipsihotici, alkohol, kokain, amfetamini, heroin); 2) infekcije (virusi influenze, Coxsackie virus, Epstein-Barrov virus, Herpes simplex virus, Legionella, Salmonella, Clostridium, Streptococcus pyogenes, Staphylococcus aureus); 3) elektrolitni poremećaji (hipokalijemija, hipofosfatemija, hipokalcijemija, hipo- i hipernatrijemija); 4) endokrini poremećaji (hiperaldosteronizam, hipotireoidizam); 5) autoimuni poremećaji (dermatomiozitis, polimiozitis) te 6) genetski čimbenici (mišićna distrofija, bolesti nakupljanja).
Klinička slika. U kliničkoj slici obično dominiraju simptomi i znakovi osnovne bolesti ili poremećaja koji nalazimo u podlozi, a klasična trijada rabdomiolize uključuje bolove u mišićima (mialgija), mišićnu slabost te tamno obojen urin kao posljedicu mioglobinurije. Često su pridruženi i drugi, nespecifični simptomi i znakovi kao što su opća slabost, vrućica, tahikardija te mučnina i povraćanje. Akutno bubrežno oštećenje razvija se kod gotovo jedne trećine bolesnika s izraženom rabdomiolizom (značajno povišeni mišićni enzimi u krvi) što se manifestira nastankom oligoanurije te retencijom tekućine (edemi). Kod ovih bolesnika moguća je i pojava srčanih aritmija uslijed hiperkalijemije.
Dijagnoza rabdomiolize postavlja se na osnovi kliničke slike, anamnestičkih podataka te laboratorijskih nalaza gdje ključnu ulogu imaju mišićni enzimi kreatin-kinaza i mioglobin. Zlatni standard u laboratorijskoj dijagnostici rabdomiolize peterostruko je povišenje vrijednosti kreatin-kinaze (> 1000 IU/L) koja ujedno ima i prognostički značaj (vrijednosti > 5000 IU/L značajno su povezane s razvojem akutnoga bubrežnog oštećenja). Dijagnostički značaj mioglobina nešto je slabiji s obzirom na njegov kratak poluživot koji iznosi dva do četiri sata zbog čega se normalizacija njegovih nalaza može očekivati već u vremenskom periodu od šest do deset sati od ozljede mišića, dok je vrijeme poluživota kreatin-kinaze 1,5 do 2 dana pa se njegove povišene vrijednosti duže zadržavaju. U dijagnostici od pomoći može biti i određivanje mioglobina u urinu (mioglobinurija). Osim toga, prate se i vrijednosti crvene krvne slike, upalnih parametara, elektrolita i urata u krvi te acidobaznoga statusa arterijske krvi kako bi se na vrijeme uočili i liječili specifični otkloni. Za postavljanje same dijagnoze rabdomiolize nisu potrebne druge dijagnostičke metode, kao što su elektromioneurografija ili biopsija mišića, osim u slučaju sumnje na metaboličku ili genetsku miopatiju (rekurentna pojavnost bez drugoga evidentnog razloga s kojime bi se rabdomioliza mogla povezati, pozitivna obiteljska anamneza i sl.).
Liječenje rabdomiolize u prvome redu podrazumijeva liječenje uzročne bolesti ili stanja. Osnovu konzervativnoga liječenja čini odgovarajuća volumna nadoknada uz alkalizaciju urina čime se potiče izlučivanje mioglobina i sprečava razvoj akutnoga bubrežnog oštećenja. Tijekom liječenja se nastoji postići satna diureza od minimalno 200 ml te alkalizacija urina s vrijednostima višima od 6,5. To se najčešće postiže naizmjeničnom primjenom infuzija fiziološke otopine i 5 %-tne glukoze (500 ml/h), s dodatkom 50 mmol natrijeva bikarbonata u infuziju 5 %-tne glukoze do postizanja željene alkalizacije urina. Često se primjenjuju furosemid ili manitol u svrhu pojačanja diureze, iako nije jasno dokazana korist od njih. Kod bolesnika kod kojih se razvije akutno bubrežno oštećenje unatoč opisanim mjerama liječenja, indicirano je liječenje hemodijalizom pri čemu vrijede indikacije kao i u drugim slučajevima hitnoga liječenja hemodijalizom.
Komplikacije. Najčešće komplikacije koje susrećemo kod bolesnika s rabdomiolizom, njihov mehanizam nastanka i liječenje prikazani su u Tablici 3.47.
|
Tablica 3.47. Najčešće komplikacije rabdomiolize
|
|
Komplikacija
|
Mehanizam nastanka
|
Liječenje
|
|
Hipovolemija
|
Pomak tekućine u mišiće
|
Volumna nadoknada
|
|
Akutno bubrežno oštećenje
|
Izravni učinak mioglobina, hipovolemija
|
Volumna nadoknada, bikarbonati, hemodijaliza
|
|
Komparment sindrom
|
Mišićna ishemija, sekvestracija tekućine
|
Fasciotomija
|
|
Hiperkalijemija
|
Povećano otpuštanje kalija iz miocita, smanjena funkcija bubrega
|
Volumna nadoknada, infuzije glukoze i inzulina, kalcijev glukonat
|
|
Hipokalcijemija
|
Untarstanični pomak kalcija
|
Izbjegavati primjenu kalcijskih preparata
|
|
Hiperfosfatemija
|
Povećano otpuštanje fosfata iz miocita
|
Forsirana diureza, hemodijaliza
|
|
Diseminirana intravaskularna koagulopatija
|
Otpuštanje tromboplastina
|
Svježe smrznuta plazma
|
POREMEĆAJI TJELESNE TEMPERATURE
Poremećaji tjelesne temperature nastali izlaganjem ekstremnim uvjetima vanjskoga okoliša uz očuvane ili narušene termoregulacijske mehanizme mogu dovesti do ozbiljnih poremećaja homeostatskih mehanizama koji nerijetko mogu završiti i smrtnim ishodom, stoga njihovo liječenje i nadzor često zahtijevaju boravak u jedinici intenzivnoga liječenja.
HIPOTERMIJA
Definicija. Hipotermija ili pothlađenost definira se sniženim vrijednostima unutarnje temperature tijela koja iznosi manje od 35℃, bilo da je mjerena rektalno, ezofagealno, intravezikalno ili na membrani timpani. Hipotermija najčešće nastaje izlaganjem niskim temperaturama, čemu često pridonose rizični čimbenici, kao što su zlouporaba i prekomjeran unos droga i alkohola. Nastanku hipotermije najizloženija su djeca i starije osobe zbog manjkavosti termoregulacijskih mehanizama. Etiopatogenetski čimbenici koji pogoduju razvoju hipotermije prikazani su u Tablici 3.48.
|
Tablica 3.48. Etiološki čimbenici hipotermije
|
|
Smanjena proizvodnja topline
|
Povećan gubitak topline
|
Ostali čimbenici
|
|
Teška iscrpljenost;
Malnutricija i mrazam;
Razne bolesti i stanja
|
Ekstremne vanjske temperature;
Vazodilatacija posredovana povećanim unosom alkohola, lijekova ili toksina;
Razne bolesti i stanja
|
Poremećaji termoregulacije (bolesti i traume središnjega živčanog sustava);
Razne bolesti i stanja
|
Podjela. Prema izmjerenim vrijednostima temperature, hipotermija se dijeli na blagu (32 – 35℃), umjerenu (28 – 32℃) i tešku hipotermiju (< 28 ℃). Prema uvjetima nastanka, hipotermija može biti namjerna (medicinski indicirana) ili slučajna, odnosno zadesna, koja se može dalje dijeliti na primarnu pri kojoj bolesnici imaju očuvane termoregulacijske mehanizme te sekundarnu kod koje bolesnici imaju poremećene termoregulacijske mehanizme (npr. bolesti i ozljede središnjega živčanog sustava).
Patofiziologija. Djelovanje niskih temperatura na organizam dovest će do aktivacije termoregulacijskoga centra u hipotalamusu koji će svojim mehanizmima nastojati održati tjelesnu temperaturu u vrijednostima iznad 35℃, no produljena izloženost niskim temperaturama (ili manjkavost termoregulacijskih mehanizama) dovest će do pada tjelesne temperature što se održava na gotovo sve organske sustave. Najznačajniji utjecaj hipotermija ima na kardiovaskularni sustav (vazokonstrikcija, bradikardija, smanjena kontraktilnost miokarda, pad minutnoga volumena) i središnji živčani sustav (smanjenje metaboličke aktivnosti i posljedični kvalitativni i kvantitativni poremećaji svijesti, povećana sekrecija antidiuretskoga hormona), ali ima učinak i na druge sustave, kao što su hematopoetski (smanjena disocijacija hemoglobina, koagulopatija), mokraćni (početno poliurija uslijed pojačanoga lučenja antidiuretskoga hormona, kasnije oligoanurija, akutno bubrežno oštećenje, poremećaj elektrolita), gastrointestinalni (hipoperistaltika, hiposekrecija), lokomotorni (pojačana mišićna aktivnost, kasnije gubitak snage i zamor) te kožni (histaminom posredovana urikarija na hladnoću). Sve promjene dovode do smanjenja bazalnoga metabolizma te smanjenja potrebe tkiva za kisikom što povećava mogućnost preživljenja, kao i opravdanosti produljenoga reanimacijskog postupka te započinjanje reanimacije i nakon dužega vremena nego je to preporučeno.
Klinička slika. Težina kliničkih manifestacija ovisi o stadiju hipotermije. Početno su bolesnici pri svijesti uz izražene simptome pojačane aktivnosti simpatikusa kao što su drhtanje, tahikardija i tahipneja, a koža je blijeda i hladna. Postupno dolazi do razvoja poremećaja svijesti i neuroloških deficita (smušenost, somnolencija, ataksija, koma, hiporefleksija, arefleksija) te bradikardije i bradipneje. Ukočenost mišića i zglobova javlja se pri tjelesnoj temperaturi ispod 28 ℃ te nalikuje na mrtvačku ukočenost (lat. rigor mortis), što uz druge oslabljene vitalne znakove može dovesti do pogrešnoga proglašavanja srčanoga aresta.
Dijagnoza se postavlja na osnovi anamnestičkih podataka, kliničke slike i kliničkoga nalaza te mjerenja unutarnje temperature tijela. Unutarnja temperatura tijela najpouzdanije se mjeri se posebnim termometrima koje možemo plasirati u mokraćni mjehur preko urinarnoga katetera ili u jednjak ili rektum te oni daju najvjerodostojniju vrijednost. U elektrokardiogramu se često u lateralnim odvodima prate tzv. „J“ ili Osbornovi valovi čija amplituda raste s porastom temperature. Također, mogu se bilježiti i znaci produljenoga provođenja (prošireni QRS-kompleksi) te promjene ST-spojnice i T-vala. Laboratorijski nalazi ovise o stupnju hipotermije, a u najtežim oblicima obično nalazimo povišene vrijednosti hematokrita (za svaki stupanj ispod 36℃ vrijednosti hematokrita rastu za 2 %), kombiniranu respiracijsko-metaboličku acidozu, hiperkalijemiju, poremećen koagulogram, povišene vrijednosti kreatin-kinaze i mioglobina kao rezultat lezije mišića, povišene vrijednosti dušičnih metabolita kao rezultat akutnoga bubrežnog oštećenje i dr. Sve bolesnike treba detaljno pregledati i potražiti vanjske znakove traume kako se ne bi previdjelo traumatsko zbivanje.
Liječenje. Ako se radi o bolesniku s arestom, treba započeti s mjerama reanimacije poštivajući preporuke i osobitosti ovih bolesnika. Temeljna metoda liječenja je zagrijavanje bolesnika uz primjenu drugih potpornih mjera liječenja ovisno o bolesnikovom stanju.
Posebnosti kardiopulmonalne reanimacije. Hipotermija može imati zaštitan učinak na mozak i druge vitalne organe, zbog čega ovi bolesnici mogu tolerirati dulje vremenske periode aresta bez da razviju ireverzibilne promjene (npr. mozak na temperaturi od 18℃ može tolerirati cirkulatorni arest deset puta dulje nego pri temperaturi od 37℃). Razumno je započeti reanimaciju kod svih pothlađenih bolesnika, osim ako imaju očigledne ozljede koje su nespojive sa životom ili imaju smrznut prsni koš, a provode se sve dok bolesnik ne dosegne temperaturu od minimalno 32℃ (tzv. postulat "bolesnik nije mrtav dok nije zagrijan i mrtav"). Kod pothlađenih je bolesnika potreban dodatan oprez pri samome postavljanju dijagnoze kardijalnoga aresta s obzirom na to da oni mogu biti bradikardični, a puls nepravilan i slabo punjen. Ako je potvrđen arest, započinje se kardiopulmonalna reanimacija prema važećim smjernicama uz dodatne napomene: 1) tijekom reanimacijskoga postupka potrebno je mjeriti i pratiti tjelesnu temperaturu, a pri tome se preporuča mjerenje istim uređajima i na istim mjestima; 2) lijekovi se pri reanimaciji ne primjenjuju sve dok tjelesna temperatura nije viša od 30℃; 3) pri tjelesnoj temperaturi između 30 i 35℃ potrebno je udvostručiti vremenski interval između primjenjivanih doza lijekova (dvostruko dulje od uobičajenih); 4) kada tjelesne temperatura prijeđe 35℃ lijekovi se primjenjuju kao i u standardnom protokolu; 5) u slučaju teške bradikardije ili bloka provođenja elektrostimulacija je indicirana tek kada se postigne normalna tjelesna temperatura; 6) u slučaju ventrikularne fibrilacije ili tahikardije bez pulsa primjenjuje se električni šok, a ako ona i dalje perzistira nakon isporučena tri šoka, daljnje pokušaje treba odgoditi sve dok temperatura ne bude viša od 30℃.
Zagrijavanje bolesnika. Metode zagrijavanja bolesnika mogu biti pasivne i aktivne. Pasivne metode zagrijavanja uključuju utopljavanje i izolaciju cijeloga tijela vunenim ili električnim dekama, aluminijskom folijom i sl. S tim je mjerama potrebno započeti već na terenu i nastaviti u bolnici, a često se primjenjuju zajedno s mjerama aktivnoga zagrijavanja. Aktivno zagrijavanje može biti vanjsko i unutarnje. Mjere aktivnoga vanjskog zagrijavanja uključuju zagrijavanje toplim zrakom te toplim infuzijskim otopinama ugrijanima na 42℃ dok mjere aktivnoga unutarnjeg zagrijavanja uključuju gastričnu, peritonealnu, intravezikalnu ili intrapleuralnu primjenu toplih otopina ugrijanih na 40℃ te u najtežim slučajevima izvantjelesno zagrijavanje. Mjere aktivnoga vanjskog zagrijavanja omogućavaju zagrijavanje tijela brzinom od 0,3 do 1,2℃/sat, aktivnoga unutarnjeg zagrijavanja oko 3 ℃/sat, a izvantjelesnoga zagrijavanja 8 – 12℃/sat.
Ostalo simptomatsko liječenje ovisi o bolesnikovom stanju. Kod bolesnika koji su bez svijesti i respiratorno insuficijentni indicirana je endotrahealna intubacija i mehanička ventilacija, kod hemodinamskih nestabilnih bolesnika indicirano je liječenje vazopresorima (noradrenalin), a preporuča se i gastroprotekcija te profilaksa duboke venske tromboze ako su koagulacijski parametri uredni. Tijekom i neposredno nakon zagrijavanja obično je potrebna agresivnija intravenska nadoknada tekućine zbog nastale vazodilatacije i pada krvnoga tlaka.
Komplikacije. Najčešće komplikacije koje prate hipotermiju su srčane aritmije, arterijska hipotenzija, pneumonija, diseminirana intravaskularna koagulopatija, akutno bubrežno oštećenje, metabolička acidoza, pankreatitis, peritonitis, gastrointestinalno krvarenje i dr.
Prognoza ovih bolesnika ponajprije ovisi o stupnju hipotermije, kao i o zdravstvenom stanju bolesnika. Umjerena i teška hipotermija, osobito kod bolesnika s višestrukim komorbiditetima i drugim rizičnim čimbenicima (alkoholizam, malnutricija i sl.) može imati stupu smrtnosti i preko 50 %.
HIPERTERMIJA
Definicija. Hipertermija je naziv za stanje koje karakterizira izrazito povišenje tjelesne temperature i to u vrijednostima iznad 40,6℃ mjereno u debelom crijevu (rektalno). Može nastati kao posljedica izlaganja uvjetima vanjskoga okoliša (toplinski udar) ili uslijed unutarnjih (endogenih) poremećaja, što se najčešće viđa pri malignoj hipertermiji i malignom neuroleptičkom sindromu.
TOPLINSKI UDAR
Definicija. Toplinski udar ili pregrijavanje označava hipertermiju koja nastaje uslijed izlaganja organizma visokoj vanjskoj temperaturi, a to je obično praćeno poremećajem stanja svijesti i razvojem višeorganskoga zatajenja. Razlikujemo dva oblika toplinskoga udara: 1) klasičan toplinski udar bez tjelesnoga napora koji se pojavljuje u uvjetima povišene temperature okoliša, a najčešće se viđa kod starijih osoba tijekom visokih vrućina te 2) toplinski udar pri naporu koji nastaje kada su osobe izložene visokim temperaturama tijekom iscrpnoga fizičkog rada (npr. građevinski radnici i sl.). Toplinski udar predstavlja teško stanje praćeno visokom stopom mortaliteta (10 – 50 %).
Patofiziologija. Toplinski udar nastaje uslijed izlaganja organizma visokim temperaturama okoliša čemu dodatno pridonose zatajenje termoregulacijskih mehanizama i/ili pojačana proizvodnja topline (npr. fizički rad). Osnovno patofiziološko zbivanje podrazumijeva temperaturom izazvanu koagulaciju proteina zbog čega se razvija višeorgansko zatajenje. Općoj hipoperfuziji tkiva i organa pridonosi sistemska vazodilatacija koja dovodi do gubitka intravaskularnoga volumena i smanjenja venskoga priljeva uz posljedični razvoj hipotenzije.
Rizični čimbenici. Glavni rizični čimbenici koji pogoduju razvoju toplinskoga udara su oslabljena aklimatizacija (starije osobe), težak fizički rad, dehidracija, pretilost, alkoholizam, kardiovaskularna oboljenja, hipertireoza, opsežne kožne promjene, kao i neki lijekovi (antikolinergici, simpatomimetici, amfetamin, kokain).
Klinička slika. Toplinski udar osim povišene unutarnje tjelesne temperature karakteriziraju i sljedeće kliničke manifestacije: suha, vruća i hiperemična koža (osobito lica), ekstremni umor, glavobolja, mučnina i povraćanje, tahikardija, hipotenzija, tahidispneja, oligurija, konvulzije, poremećaja stanja svijesti i dr. Diferencijalno dijagnostički kod ovih bolesnika treba pomišljati i na toksičnost lijekova, sepsu, maligni neuroleptički sindrom, apstinencijsku krizu, infekciju središnjega živčanog sustava te endokrine poremećaje kao što su tireotoksikoza ili feokromocitom.
Liječenje toplinskoga udara u prvome redu podrazumijeva provođenje mjera rashlađivanja uz primjenu ostalih potpornih metoda liječenja, ovisno o bolesnikovom stanju. Tehnike hlađenja uključuju širok spektar mjera, kao što su primjena hladnih obloga, tuširanje bolesnika u mlakoj vodi, hlađenje ledom u području magistralnih arterija (iznad femoralnih, aksilarnih ili karotidnih arterija), primjena rashlađenih infuzijskih otopina, ispiranje mokraćnoga mjehura ili gastrična lavaža hladnom vodom, pa sve do naprednih metoda kao što je primjena intravaskularnih katetera za hlađenje, uređaja za površinsko hlađenje ili u krajnjoj liniji primjena metoda ekstrakorporalne cirkulacije. Navedene mjere rashlađivanja primjenjuju se sve dok temperatura ne padne na vrijednost od 38℃. Primjena lijekova u smislu snižavanja temperature u ovih bolesnika nije pokazala veću korist. Paralelno s provođenjem mjera rashlađivanja provode se i druge potporne mjere liječenja: respiratorna resuscitacija, volumna resuscitacija, primjena vazopresora kod protrahirane hipotenzije koja ne reagira na primjenu volumena, kupiranje epileptičkih napadaja benzodiazepinima i dr.
MALIGNA HIPERTERMIJA
Maligna hipertermija rijetka je nasljedna bolest koja nastaje uslijed mutacije RYR1 gena koji se nalazi na 19. kromosomu, čiji genski produkt sudjeluje u regulaciji otpuštanja kalcija iz sarkoplazmatske mrežice u skeletnim mišićima. Posljedično toj mutaciji dolazi do ekscesivnoga otpuštanja kalcija iz sarkoplazmatskoga retikuluma unutar skeletnih mišića što uvjetuje njihovu produljenu kontrakciju, hipoperfuziju i nekrozu (rabdomioliza), a to se javlja nakon izlaganja bolesnika inhalacijskim anesteticima (izofluran, halotan, sevofluran), depolarizirajućim miorelaksansima (sukcinilkolin) ili nekim vrstama psihoaktivnih tvari kao što su amfetamini i ecstasy (ekstazi). Bolest se najčešće klinički manifestira nakon uvođenja bolesnika u opću anesteziju, rjeđe nakon konzumacije navedenih droga. Kliničke manifestacije posljedica su produljene kontrakcije skeletnih mišića i nastale rabdomiolize, a samo povišenje temperature nastaje uslijed oslobađanja energije u obliku topline uslijed kontrakcije, kao i djelovanjem oslobođenih pirogenih tvari iz nekrotizirajućih mišića. Najčešće kliničke manifestacije prikazane su u Tablici 3.49. Dijagnoza se postavlja na temelju kliničkoga nalaza i anamnestičkih podataka. Liječenje se sastoji od prekida izloženosti uzročnom čimbeniku, a glavni lijek i lijek izbora u liječenju ovoga poremećaja je dantrolen koji blokira otpuštanje kalcija iz sarkoplazmatske mrežice. Primjenjuje se u dozi od 2 mg/kg kao intravenski bolus, uz ponavljanje svakih pet minuta do ukupne doze od 20 mg/kg. U svrhu prevencije ponovnoga napadaja moguće je nastaviti primjenu u dozi od 1 mg/kg intravenski ili 2 mg/kg per os četiri puta na dan kroz tri dana. Dantrolen se ne daje kod bolesnika s uznapredovalom bolesti jetre jer može biti hepatotoksičan, a glavne nuspojave su mišićna slabost, glavobolja i povraćanje.
|
Tablica 3.49. Kliničke manifestacije maligne hipertermije
|
|
Rane manifestacije maligne hipertermije
|
Kasne manifestacije maligne hipertermije
|
|
Trizmus
Mišićna ukočenost
Tahikardija
Hiperkapnija
Laktacidoza
|
Hipertermija
Rabdomioliza
Akutno bubrežno oštećenje
Hipotenzija
Srčane aritmije
|
MALIGNI NEUROLEPTIČKI SINDROM
Maligni neuroleptički sindrom rijetka je komplikacija primjene antipsihotika koja nastaje uslijed blokade dopaminskih receptora u području hipotalamusa i bazalnih ganglija što dovodi do poremećaja termoregulacije te pojave mišićnoga spazma. Sindrom se najčešće javlja kod bolesnika koji su na terapiji klasičnim antipsihoticima (haloperidol), ali se može registrirati i kod primjene drugih psihofarmaka kao što su litij, selektivni inhibitori ponovne pohrane serotinina, inhibitori monoaminooksidaze te triciklički antidepresivi. Pojava malignoga neuroleptičkog sindroma nije povezana s dozom lijeka niti s duljinom primjene lijeka. Glavni simptomi su hiperpireksija i generalizirana mišićna ukočenost, a mogu se javiti i tahikardija, hipotenzija ili hipertenzija, znojenje i izražena hipersalivacija. U laboratorijskim se nalazima pojavljuje leukocitoza te povišene vrijednosti kreatin kinaze i mioglobina. Glavne su komplikacije rabdomioliza, akutno bubrežno oštećenje, akutna respiratorna insuficijencija, simptomatska epilepsija, akutni infarkt miokarda te diseminirana intravaskularna koagulopatija. Dijagnoza se postavlja na temelju kliničke slike, laboratorijskih nalaza te anamnestičkih podataka o uzimanju navedenih lijekova. Osnovna mjera liječenja je prekid uzimanja antipsihotika uz potporne mjere koje ovise o ugroženosti bolesnika. Osnovu liječenja čini primjena dantrolena koji se daje početno kao intravenski bolus od 2 mg/kg te se ponavlja svakih pet minuta do poboljšanja ili ukupne doze od 10 mg/kg nakon čega se nastavlja njegova peroralna primjena u dozi od 50 - 200 mg 3 – 4 x/dan. Kod bolesnika koji ne reagiraju na dantrolen ili imaju jetreno oštećenje primjenjuje se bromokriptin (dopaminski agonist) u dozi od 3 x 2,5 - 10 mg/dan. Liječenje se provodi 7 do 14 dana, odnosno dok se ne postigne eliminacija iz organizma psihofarmaka koji je uzrokovao ovo stanje. Unatoč navedenim mjerama liječenja, smrtnost se kod ovih bolesnika kreće i do 25 %.
SINDROM STEČENE SLABOSTI I NAČELA PREHRANE U JEDINICI INTENZIVNOGA LIJEČENJA
Sindrom stečene slabosti u jedinici intenzivnog liječenja (engl. intensive care unit acquired weakness) označava razvoj mišićne slabosti kod kritično oboljelih osoba i predstavlja jedan od najčešćih oblika tjelesnoga oštećenja u jedinici intenzivnoga liječenja koji se susreće kod više od 25 % takvih bolesnika. Nastaje kao posljedica kataboličkoga stresa koji uvjetuje nesrazmjer između sinteze i razgradnje proteina zbog čega bolesnik progresivno gubi na mišićnoj masi, a taj gubitak može iznositi i do 800 g/dan. Sindrom stečene slabosti povezan je s produljenim boravkom bolesnika u jedinici intenzivnoga liječenja, duljom ovisnosti o mehaničkoj ventilaciji, povećanom stopom mortaliteta te razvoja komplikacija (posebno infekcija), kao i narušenom kvalitetom života nakon otpusta iz bolnice.
Klinička prehrana bolesnika u jedinici intenzivnoga liječenja predstavlja jednu od osnovnih mjera liječenja, a podrazumijeva odgovarajući unos osnovnih nutrijenata kao što su ugljikohidrati, masti i proteini, voda, elektroliti i oligoelemenati, bilo enteralnim, bilo parenteralnim putem, u skladu s okolnostima i potrebama bolesnika. Odgovarajućom prehranom bolesnika osigurava se unos dostatne energije potrebne za normalno funkcioniranje organizma i održavanje homeostaze, kao i sprečavanje nastanka sindroma stečene slabosti.
Procjena nutritivnoga rizika. Osnovni korak u planiranju prehrane bolesnika u jedinici intenzivnoga liječenje je procijeniti njegov nutritivni rizik, odnosno rizik od nutritivnoga deficita. On se određuje prema NRS-2002 bodovnom sustavu (nutritional risk screening) koji se temelji na bodovnom ocjenjivanju općega nutritivnog statusa bolesnika i težine njegove bolesti. kao i na uvažavanju dobi bolesnika. Ukupan broj bodova svrstava bolesnike u jednu od tri skupine: skupina bez rizika, s blagim rizikom i s teškim rizikom. Bolesnici koji imaju težak rizik od razvoja nutritivnoga deficita zahtijevaju provođenje plana kliničke prehrane.
Određivanje nutritivnih potreba. Nakon što je postavljena indikacija za pružanje nutritivne potpore, najprije se mora odrediti bolesnikova dnevna kalorijska potreba izražena u kalorijama na dan (kcal/dan). Ona se dobiva izračunom kalorijske potrebe bazalnoga metabolizma (Harris-Benedictova formula), a dobivena se vrijednost množi s korektivnim kataboličkim faktorom koji ovisi o kliničkom stanju, odnosno dijagnozi (npr. sepsa 1,2, tumori 1,1 i dr.). Okvirno, energetske potrebe bolesnika u jedinici intenzivnoga liječenja iznose 20 do 25 kcal/kg idealne tjelesne mase u akutnoj fazi bolesti i 25 do 30 kcal/kg idealne tjelesne mase u fazi oporavka. Potrebe za makronutrijentima iznose 1,0 do 1,5 g/kg za proteine, 3,0 do 3,5 g/kg za glukozu te 0,8 do 1,5 g/kg za lipide uz dodatak vitamina topljivih u mastima i oligoelemenata.
Načini i vrste prehrane kritično oboljelih bolesnika. Enteralna prehrana predstavlja prvi izbor u zbrinjavanju i osiguravanju nutritivnih potreba bolesnika koji se nalaze u jedinici intenzivnoga liječenja, dok je parenetralna prehrana indicirana samo kod bolesnika koji imaju afunkcionalni gastrointestinalni trakt ili se enteralnom prehranom ne može osigurati dostatan kalorijski unos.
Enteralna prehrana podrazumijeva unos hrane u probavnu cijev, bilo peroralnim putem - ako to dopušta stanje svijesti, bilo preko nazogastrične ili nazojejunalne sonde ili drugoga umjetnog puta (gastrostoma, jejunostoma). Ona predstavlja fiziološki način prehrane te sprečava atrofiju crijevnih resica i s njom povezanu bakterijsku translokaciju i druge komplikacije. Na ovaj se način može primjenjivati posebno pripravljena hrana iz bolničke kuhinje, kao i gotovi monomerni ili polimerni pripravci koji su svojim sastavom, volumnim i kalorijskim opterećenjem obično prilagođeni kliničkom stanju bolesnika (maligno oboljenje, šećerna bolest, bubrežno ili jetreno zatajenje i sl.). Enteralna se prehrana može primjenjivati na dva načina: bolusno ili kontinuirano. Bolusno davanje hrane podrazumijeva primjenu obroka manjih volumena (50 do 200 ml) više puta tijekom dana (šest do deset puta na dan), dok kontinuirano davanje hrane podrazumijeva primjenu posebnih pripravaka putem enteralnih pumpi kroz period od 16 do 18 sati (20 - 150 ml/sat), što je posebno pogodno kod bolesnika s nazojejunalnom sondom. Uvođenje enteralne prehrane može biti povezano s razvojem mučnine, nadutosti, meteorizma, regurgitacije, aspiracije ili različitih metaboličkih komplikacija, kao što su hiperglikemija, hiperfofatemija ili hiperkalijemija, osobito ako se unos započne naglo nakon perioda dužega gladovanja. Također, moguć je razvoj i komplikacija vezanih uz umjetni probavni put, kao što su pomak i ispadanje sondi, ulceracije nosne šupljine, jednjaka ili želuca i sl.
Parenteralna prehrana podrazumijeva primjenu hranjivih tvari izravno u sistemsku cirkulaciju putem intravenske infuzije, zaobilaženjem probavnoga sustava. U osnovi razlikujemo totalnu i parcijalnu parenteralnu prehranu. Totalana parenteralna prehrana je ona kod koje se cjelokupna prehrana odvija putem intravenske primjene odgovarajućih pripravaka, dok parcijalna parenteralna prehrana predstavlja dodatan oblik prehrane kod bolesnika koji djelomične energetske potrebe ostvaruju enteralnim putem.
Indikacije i kontraindikacije. Parenteralna prehrana indicirana je kod svih bolesnika koje se ne može na zadovoljavajući način hraniti enteralnim (oralnim) putem i/ili bolesnika s nefunkcionalnim gastrointestinalnim traktom (indikacije za parentralnu prehranu navedene su u Tablici 3.50.). Apsolutne kontraindikacije za provođenje parenteralne prehrane su akutna faza bolesti, stanje šoka, hiperlaktatemija (laktati > 3 mmol/L), teška hipoksija (PaO2 < 7 kPa) te teška acidoza (pH < 7,2). U načelu, s parenteralnom prehranom kod kritično oboljelih osoba treba započeti tek nakon stabilizacije vitalnih parametara.
|
Tablica 3.50. Indikacije za primjenu parenteralne prehrane u jedinici intenzivnoga liječenja – ESPEN preporuke*
|
- Kod svih bolesnika koji ne mogu zadovoljiti svoje nutritivne potrebe enteralnim putem nakon dva dana prehrane preporuča se uvesti parcijalnu parenteralnu prehranu.
- Kod svih bolesnika kod kojih se ne očekuje odgovarajući nutritivni unos enteralnim putem u vremenu dužem od tri dana preporuča se započeti totalnu parenteralnu prehranu.
- Kada parenteralna prehrana preko periferne vene ne osigurava pokrivanje energetskih potreba treba razmisliti o centralnom venskom putu.
- Kritično oboljelim osobama s malnutricijom također je potrebno uvesti parcijalnu parenteralnu prehranu kao dodatak enteralnoj prehrani.
|
* European Society for Parenteral and Enteral Nutrition
Put primjene. Parentrealna prehrana odvija se putem perifernoga venskog puta, centralnoga venskog katetera ili drugih vaskularnih pristupa (Hickmanov kateter, venski port), što ponajprije ovisi o očekivanom trajanju parenteralne prehrane. Ako je očekivano vrijeme trajanja parenteralne prehrane sedam do deset dana, ona se može primjenjivati perifernim venskim putem (za otopine do 850 mosmol/L) ili centralnim venskim putem (za otopine preko 850 mosmol/L). Ako je očekivano trajanje parenteralne prehrane dulje od deset dana, preporuča se primjena preko centralnoga venskog puta ili drugih oblika vaskularnoga pristupa (Hickmanov kateter, venski port) ako se očekuje trajanje njezine primjene duže od tri tjedna.
Izbor otopina za parenteralnu prehranu. Danas se za parenteralnu prehranu koriste standardizirane trokomorne otopine koje sadrže odgovarajuće količine lipida, ugljikohidrata i proteina, a međusobno se razlikuju prema volumnom i kalorijskom opterećenju, osmolalnosti, udjelu pojedinih makronutijenata i sl. Pri izboru otopine, osim energetskih potreba, mora se voditi računa i o specifičnim stanjima bolesnika koja nalažu primjenu posebnih otopina. Tako se kod bolesnika s kroničnom bolesti bubrega i jetre koriste otopine s manje proteina, kod bolesnika s respiratornom insuficijencijom otopine s manje ugljikohidrata, kod bolesnika sa srčanim popuštanjem otopine manjega volumena, dok se kod pothranjenih i iscrpljenih bolesnika koriste otopine s visokim udjelom proteina. Osim primjene makronutijenata (lipidi, ugljikohidrati, proteini), moraju se zadovoljiti i bolesnikove potrebe za vitaminima i oligoelementima što se postiže dodatnom primjenom posebnih pripravaka koji omogućavaju njihovu suplementaciju. Zadovoljavanje isključivo potreba za makronutrijentima bez zadovoljavanja potreba za mikronutrijentima čini parenteralnu prehranu nedovoljnom i nezadovoljavajućom.
Strategija primjene parenteralne prehrane. Primjena parenteralne prehrane može biti u obliku kontinuirane intravenske infuzije kroz 24 sata ili cikličke intravenske primjene koja podrazumijeva primjenu pripravka kroz 16 sati nakon čega slijedi pauza od 8 sati. Kod početka primjene parenteralne prehrane prvi se dan primjenjuje 50 % izračunate energetske potrebe, drugi dan 75 % izračunate energetske potrebe, a tek se od trećega dana primjenjuje 100 % izračunate energetske potrebe. Takva strategija smanjuje opasnost od razvoja metaboličkih komplikacija.
Praćenje bolesnika. Tijekom provođenja parenteralne prehrane potrebna je redovna kontrola laboratorijskih nalaza kako bi se izbjegle i na vrijeme uočile moguće metaboličke komplikacije. Inicijalni laboratorijski testovi uključuju određivanje kompletne krvne slike, koagulograma, jetrenih i pankreasnih biljega, metabolita dušika, glukoze u plazmi, lipidograma, ferograma i statusa vitamina B i D te proširenoga ioniograma. Kontrolni laboratorijski testovi na dnevnoj bazi podrazumijevaju određivanje glukoze, natrija, kalija i acidobaznoga statusa, dok se na tjednoj bazi određuju jetreni enzimi, lipidogram te koagulacijski parametri.
Komplikacije. Glavne komplikacije vezane uz parenteralnu prehranu su: hiperglikemija i hiperlipidemija, refeeding sindrom, hepatalne komplikacije (prolazni porast transaminaza), bilijarne komplikacije (kolestaza, kolelitijaza, kolecistitis), infekcije vezane uz katetere, opterećenje tekućinom (kardiopati) te metabolički poremećaji kostiju ako se parenteralna prehrana primjenjuje dulje od tri mjeseca. Hiperglikemija je najčešća metabolička komplikacija, a njezin nastanak potiče hiperkorticizam koji je fiziološki prisutan kod kritično oboljelih osoba. Zbog toga se kod ovih bolesnika češće mjere vrijednosti glukoze u plazmi, a nastala hiperglikemija regulira se primjenom inzulina kratkoga djelovanja. Refeeding sindrom predstavlja ozbiljan metabolički poremećaj koji se razvija uslijed nagloga uvođenja prehrane kod bolesnika nakon dužega perioda gladovanja. On se javlja unutar prvih 24 sata od uvođenja prehrane, a nastaje uslijed pojačane sekrecije inzulina potaknute unosom ugljikohidrata koji povećava sintezu proteina i glikogena za što su potrebni elektroliti i drugi metaboliti koji se brzo troše pa se razvijaju hipokalijemija, hipomagnezijemija, hipofosfatemija, deficit tiamina uz zadržavanje soli i vode i nastanka edema. Postupnim uvođenjem prehrane kod bolesnika koji su prošli duži period gladovanja prevenira se nastanak ovoga sindroma.
- Baglin T, Barrowcliffe TW, Cohen A, Greaves M. for the British Committee for Standards in Haematology. Guidelines on the use and monitoring of heparin. Br J Haematol 2006;133: 19–34.
- Barbour T, Johnson S, Cohnez S, Hughes P. Thrombotic microangiopathy and associated renal disorders. Nephrol Dial Transplant 2012; 27: 2673–85.
- Bosnjak B , Culjak-Aleksić M, Gojceta, K , Golubić-Cepulić B , Debeljak, Z , Dodig, J i sur. Smjernice za heparinom izazvanu trombocitopeniju (HIT). Liječnički Vjesnik 2012;134(9-10): 253-8.
- Briel M, Meade M, Mercat A, Brower RG, Talmor D, Walter SD, et al. Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: systematic review and metaanalysis. JAMA. 2010;303:865-873.
- Burks AC, Byers DE. Temperature Alterations. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia: Wolters Kluwer; 2018. p. 212-7.
- Burks AC. Respiratory Acid-Base Disorders. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia: Wolters Kluwer; 2018. p. 180-3.
- Cheng R, Hachamovitch R, Kittleson M, Patel J, Arabia F, Moriguchi J,et al. Complications of extracorporeal membrane oxygenation for treatment of cardiogenic shock and cardiac arrest: a meta-analysis of 1,866 adult patients. Ann Thorac Surg. 2014;97:610-6.
- Cheng S, Younus U. Metabolic Acid–Base Disorders. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia: Wolters Kluwer; 2018. p.173-9.
- Clark WF. Thrombotic microangiopathy: current knowledge and outcomes with plasma exchange. Semin Dial 2012; 25: 214–9.
- Cook DJ. Approach to the patient in a critical care setting. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 650-2.
- Degmečić D. Hitna stanja u psihijatriji. Medicus 2017; 26(2):199-204.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41:580-637.
- Durand F, Graupera I, Ginès P, Olson JC, Nadim MK. Pathogenesis of hepatorenal syndrome: implications for therapy. Am J Kidney Dis. 2016;67(2):318–28.
- Frerk C, Mitchell VS, McNarry A F, Mendonca C, Bhagrath R, Patel A et al. Difficult Airway Society intubation guidelines working group. Difficult Airway Society 2015 guidelines for management of unanticipated difficult intubation in adults. Br J Anaesth 2015; 115(6): 827-48.
- Ganz T, Nemeth E. The hepcidin-ferroportin system as a therapeutic target in anemias and iron overload disorders. Hematology Am Soc Hematol Educ Program. 2011;2011:538-42.
- Gašparović V. Svrha, organizacija i razvoj intenzivne medicine. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 379-83.
- Gašparović V. Višestruko zatajenje organa. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 412-3.
- Gašparović V., Ivančan V. Metode nadzora u odjelima intenzivnog liječenja. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str.383-6.
- Hala H, Hisham I, Yehia K, Ezzat A. Ventilation and ventilators in the ICU: What every intensivist must know. Current Anaesthesia & Critical Care 2006;17: 77–83.
- Hall C, Castro M. Status Asthmaticus. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia : Wolters Kluwer; 2018. p. 66-72.
- Hamdi T, Latta S, Jallad B, Kheir F, Alhosaini MN, Patel A. Cisplatin-induced renal salt wasting syndrome. South Med J 2010;103:793-9.
- Hollenberg SM. Cardiogenic shock. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 681-685.
- Hoste EA, Bagshaw SM, Bellomo R, Cely CM, Colman R, Cruz DN et al. Epidemiology of acute kidney injury in critically ill patients: the multinational AKI-EPI study Intensive Care Med. 2015;41:1411–23.
- Hua MS, Li G, Blinderman CD, Wunsch H. Estimates of the need for palliative care consultation across United States intensive care units using a trigger-based model. Am J Respir Crit Care Med. 2014;189:428-36.
- Isakow W. An Approach to Respiratory Failure. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia: Wolters Kluwer; 2018. p. 48-50.
- Ivanović D., Baršić B. Sepsa. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 391-5.
- Ivanović D., Radonić R. Kardiopulmonalna-cerebralna resuscitacija. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008., str. 387-91.
- Ivanović D., Radonić R. Šok. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 396-412.
- Jukema JW, Cannon CP, de Craen AJ, Westendorp RG, Trompet S. The controversies of statin therapy: weighing the evidence. J Am Coll Cardiol. 2012 Sep 4;60(10):875-81.
- Kannam M, Saxena R, Adiguzel C, FareEd J. An update on a prevalence and characterization of H-PF4 antibodies in Asian-Indian patients. Semin Thromb Haemost 2009;35(3):337–43.
- Klobučar Majanović S, Crnčević Orlić Ž, Zorić Č. Hitna stanja u endokrinologiji. Medicina fluminensis 2013;49(4):391-404.
- Kollef MH. Anaphylactic Shock. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia: Wolters Kluwer; 2018. p. 37-9.
- Kollef MH. Hypovolemic Shock. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia: Wolters Kluwer; 2018. p. 24-6.
- Kollef MH. Introduction to Shock. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia: Wolters Kluwer; Wolters Kluwer, Philadelphia, 2018. p. 21-3.
- Kulkarni S, Cronin DC. Fulminant hepatic failure. In: Hall JB, Schidt GA, Wood LD. Principles of Critical Care. 3rd ed. New York: McGraw-Hill Professional; 2005:1279–88.
- Legendre CM, Licht C, Muus P, Greenbaum LA, Babu S, Bedrosian C et al. Terminal complement inhibitor eculizumab in atypical hemolytic-uremic syndrome. N Engl J Med 2013; 368: 2169–81.
- M. Ratković, D. Radunović, B. Gledović. Bubrežna funkcija bolesnika s trombotičkom trombocitopeničnom purpurom. Acta Med Croatica. 2014;(68)183-9.
- Majerić-Kogler V. Osnovna načela mehaničke respiracije. U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 416-8.
- Maldini B. Goranović T., Šimunjak B. Zbrinjavane dišnog puta: jučer, danas, sutra. Acta Med Croatica. 2018; 72(1):5-10.
- Marino Paul L. Marino`s The Little ICU Book, Second Edition. Philadelphia: Wolters Kluwer; 2017.
- Marković D, Unić-Stojanović D, Jevđić J, Janjević D. Mechanical Ventilation Modes. Serbian Journal of Anesthesia and Intensive Therapy. 2014;36(1-2): 43-9.
- Martin MG, Whitlatch NL, Shah B, Arepaly GM. Thrombotic thrombocytopenic purpura induced by trimethoprim sulfamethoxasole. Am J Hematol. 2007;82:679-81.
- Martinez JJG., Bendjelid K. Artificial liver support systems: whatis new over the last decade? Ann. Intensive Care. 2018; 8:109.
- Matthay MA, Slutsky AS. Acute Respiratory Failure. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 655-64.
- McConville JF, Kress JP. Weaning patients from the ventilator. N Engl J Med. 2013;368:1068-9.
- Micek ST, Kollef MH. Sepsis and Septic Chock. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia: Wolters Kluwer; 2018. p. 26-9.
- Morrow LE, Kollef MH. Recognition and prevention of nosocomial pneumonia in the ICU and infection control in mechanical ventilation.C rit Care Med. 2010;38(8):S352–62.
- Musher DM, Thorner AR. Community-acquired pneumonia. N Engl J Med. 2014 Oct 23;371(17):1619-28.
- Myku M, Schilling JC. Cardiogenic Shock. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. , Philadelphia: Wolters Kluwer; 2018. p. 30-6.
- Narick C, Triulzi DJ, Yazer MH. Transfusion-associated circulatory overload after plasma transfusion. Transfusion. 2012;52:160-5.
- Nelson LS, Ford MD. Acute poisoning. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 696-711.
- Novelli G, Rossi M, Pretagostini M, Pugliese F, Ruberto F, Novelli L et al. One hundred sixteen cases of acute liver failure treated with Mars. Transplant Proc. 2005, 37:2557-2559.
- O`Connor FG, Deuster PA. Rhabdomyolysis. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 723-726.
- O`Dwyer MJ, Pearse RM, Hinds CJ. Critical care medicine. In: Kumar P, Clark M. Kumar & Clark`s Medicine. 9th edition. London: Elsevier; 2017. p. 1139-72.
- Oster JR, Singer I. Hyponatremia, hyposmolality, and hypotonicity: tables and fables. Arch Intern Med 1999;159:333-6.
- Palevsky PM, Liu KD, Brophy PD, Chawla LS, Parikh CR, Thakar CV et al. KDOQI US commentary on the 2012 KDIGO clinical practice guideline for acute kidney injury.J Kidney Dis. 2013 May;61(5):649–72.
- Petrović D., Čanović P., Mijailović Ž, Jaćović S. Haemolytic-Uremic Syndrome: etiopathogeneis, diagnostics and basic principles of treatment. Med J (Krag) 2015; 49(2): 59-65.
- Radonić R., Degoricija V. Akutno oštećenje pluća i akutni respiratorni distres sindrom (ARDS). U: Vrhovac B, Jakšić B, Reiner Ž, Vucelić B, urednici. Interna medicina. 4. izdanje. Zagreb: Ljevak; 2008. str. 414-6.
- Ralston SH, Penman ID, Strachan MWJ, Hibson RP. Acute Medicine and Critical Illnes. In: Davidsons Principles and Practice of Medicine, 23rd Edition. London: Elsevier; 2018. p. 174-213.
- Ralston SH, Penman ID, Strachan MWJ, Hibson RP. Environmental medicine. In: Davidsons Principles and Practice of Medicine, 23rd Edition. London: Elsevier; 2018. p. 164-71.
- Ralston SH, Penman ID, Strachan MWJ, Hibson RP. Poisoning. In: Davidsons Principles and Practice of Medicine, 23rd Edition. London: Elsevier; 2018. p. 132-50.
- Rawal G, Kumar R, Yadav S, Singh A. Anemia in Intensive Care: A review of Current Concepts. The Journal of Critical Care Medicine 2016;2(3):109-14.
- Rivers EP. Approach to the patinet with shock. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia : Elsevier Saunders; 2016. p. 672-81.
- Ronco C, Bellomo R, Homel P, Brendolan A, Dan M, Piccinni P, et al. Effects of different doses in continuous veno-venous haemofiltration on outcomes of acute renal failure: a prospective randomised trial. Lancet. 2000;356(9223):26–30.
- Russell JA. Shock syndromes related to sepsis. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia : Elsevier Saunders; 2016. p. 685-91.
- Ryska M, Laszikova E, Pantoflicek T, Ryska O, Prazak J, Koblihova E. Fractionated plasma separation and adsorption significantly decreases intracranial pressure in acute liver failure: experimental study. Eur Surg Res. 2009;42(4):230–5.
- Saliba F. The Molecular Adsorbent Recirculating System (MARS) in the intensive care unit: a rescue therapy for patients with hepatic failure. Crit Care. 2006 Feb;10(1):118.
- Slutsky AS. Mechanical Ventilation. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia: Elsevier Saunders; 2016. p. 665-72.
- Sodhi SS, Cooper DH. Cardiac Arrhythmias and Conduction Abnormalities. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia: Wolters Kluwer; 2018. p.122-33.
- Sood S, Witt CA. Acute Exacerbations of Chronic Obstructive Pulmonary Disease. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia: Wolters Kluwer; 2018. p. 73-7.
- Stefanović D. B, Stefanović D, Kalezić N. Inicijalni tretman bolesnika u hemoragijskom šoku. U: Kalezić N. Inicijalni tretman urgentnih stanja u medicini. Beograd: Medicinski fakultet Univerziteta u Beogradu; 2016. str. 521-44.
- Stoller JK, Hill NS. Respiratory Monitoring in critical care. In: Goldman L, Schafer A. Goldman-Cecil Medicine, 25th edition. Philadelphia : Elsevier Saunders; 2016. p.652-5.
- Širanović M, Kovač J, Gopčević A, Kelečić M, Vučić M, Kovač N i sur.. Constant cardiac output monitoring using the picco and lidco methods versus pak in septic patients: when to do calibration? Acta Clin Croat 2011; 50:267-72.
- Timmermann A. Supraglottic airways in dii cult airway management: Successes, failures, use and misuse. Anaesthesia .2011;66(2): 45-56.
- Torres PA, Helmstetter JA, Kaye AM, Kaye AD. Rhabdomyolysis: Pathogenesis, Diagnosis, and Treatment. The Ochsner Journal. 2015;15:58–69.
- Trupka T, Kollef MH, Tobin GS. Diabetic Ketoacidosis and Hyperosmolar Hyperglycemic State. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia: Wolters Kluwer; 2018. p. 192-6.
- Turk Wensveen T, Krznarić Zrnić I, Hauser G. Hiponatrijemija – dijagnostički i terapijski pristup. Medicina fluminensis 2014; 50.(4):414-24.
- Watanabe T. Rhabdomyolysis and acute renal failure in children. Pediatr Nephrol. 2001 Dec;16(12):1072-1075.
- Younus U, Goldberg S. Electrolyte Abnormalities. In: Kollef MH, Isakow W, Burks Ac, Despotovic VN. The Washington Manual of Critical Care. 3rd edition. Philadelphia: Wolters Kluwer; 2018. p.153-171.
- Zarychanski R, Houston DS. Assessing thrombocytopenia in the intensive care unit: the past, present, and future. Hematology Am Soc Hematol Educ Program. 2017 Dec 8;2017(1):660-6.